HPLC-ELSD测定咽速康气雾剂中每揿胆酸含量
2013-09-27常新全杨娜宋潇
常新全,杨娜,宋潇
(1.中国药材公司,北京 102600;2.华颐药业有限公司,北京 102600)
HPLC-ELSD测定咽速康气雾剂中每揿胆酸含量
常新全1*,杨娜2,宋潇2
(1.中国药材公司,北京 102600;2.华颐药业有限公司,北京 102600)
目的:建立咽速康气雾剂中每揿君药人工牛黄中胆酸的含量测定方法。方法:采用高效液相色谱-蒸发光散射检测法,流动相:以甲醇为流动相A,以0.1%冰醋酸溶液为流动相B,梯度洗脱,流速:1.0 mL·min-1,柱温:35 ℃,漂移管温度:35 ℃,载气:高纯氮气,气体压力:33 psi,进样量:15 μL。结果:胆酸在0.254 1~1.270 5 μg呈现良好的线性关系(r=0.999 9),平均回收率为100.27%,RSD=2.13%(n=6)。结论:方法专属性强,精密度良好,准确度高,线性良好,耐用性适宜,使用期和瓶间均一性好,可以测定咽速康气雾剂每揿胆酸的含量。
咽速康气雾剂;胆酸;含量测定
咽速康气雾剂是由人工牛黄、珍珠、雄黄、蟾酥、人工麝香、冰片等中药制成的气雾剂,方剂组成来源于“六神丸”,具有解毒、消肿、止痛功能,临床用于咽喉肿痛、单双乳蛾的肺胃实热证,疗效确切。人工牛黄为方中君药,胆酸为人工牛黄主要有效成分。化学药品中绝大部分定量阀门气雾剂检查每揿主药含量[1],《中国药典》一部自2000年版起规定中药定量阀门气雾剂需检查每揿主药含量[2-3],经查阅公开文献,至今无中药气雾剂检查每揿主药含量的研究报道[4-5]。另外,气雾剂不同于口服、注射等给药途径的制剂,测定气雾剂瓶内每毫升药液主药含量,并不代表实际服用量,因此,为了精确控制定量阀门气雾剂主药的服用量,参照文献[6]方法,研究建立咽速康气雾剂使用过程中每揿胆酸含量测定的方法。
1 仪器与试药
1.1 仪器
Waters公司高效液相色谱仪:包括Waters600泵,Waters717plus自动进样器,Waters 2424ELSD检测器,Empower2色谱工作站。
1.2 试药
甲醇(色谱纯),高纯水,其他试剂均为分析纯。胆酸(购自中国食品药品检定研究院,批号:110731-200513)。咽速康气雾剂(华颐药业有限公司,批号:1105001,1105002,1105003)。人工牛黄阴性样品系按处方比例,除去人工牛黄,其余中药按咽速康气雾剂制备工艺制得。
2 方法与结果
2.1 色谱条件
色谱柱为Kromasil(250 mm×4.6 mm,5 μm);以甲醇为流动相A,以0.1%冰醋酸溶液为流动相B,按表1进行梯度洗脱,流速:1.0 mL·min-1,柱温:35℃。蒸发光散射检测器检测参数:漂移管温度为35 ℃,载气为高纯氮气,气体压力为33 psi;进样量为15 μL。理论板数以胆酸峰计算应不低于2 500。

表1 胆酸流动相洗脱条件
2.2 对照品溶液制备
取胆酸对照品适量,精密称定,加甲醇制成每1 mL含胆酸0.05 mg的溶液,即得。
2.3 供试品溶液制备
取50 mL烧杯,加入15 mL无水乙醇。取本品,试喷5下,洗净喷口,充分干燥。将喷口置烧杯底部(液面下约2 cm),喷10次,每次喷射时间间隔5秒,每喷射前充分振摇,取出药瓶,用无水乙醇洗净喷头,合并无水乙醇液,水浴浓缩至约1 mL,转移至5 mL容量瓶中,加入甲醇2 mL,超声处理(功率150 W,频率25 kHz)15 min,取出,放至室温,加甲醇稀释至刻度,摇匀,用微孔滤膜(0.45 μm)滤过,取续滤液,即得。
2.4 专属性试验
取人工牛黄阴性样品适量,精密称定,按2.3制备方法制成阴性对照溶液,按照上述色谱条件,注入液相色谱仪,与胆酸对照品色谱图、咽速康气雾剂样品色谱图对比,结果见图1~3。
图1 胆酸对照品色谱图(Rt:14.255 min)

图2 人工牛黄阴性样品色谱图

图3 咽速康气雾剂样品色谱图(Rt:14.218 min)
结果表明,阴性样品色谱图在胆酸保留时间处无色谱峰,在试验条件下,其他中药对测定无干扰。
2.5 线性关系考察试验
分别精密吸取胆酸对照品溶液(0.050 82 mg·mL-1)5,10,15,20,25 μL,注入液相色谱仪中,以进样量(取对数)为横坐标,峰面积积分值(取对数)为纵坐标进行回归处理,得回归方程:Y=0.930 4X+3.872 6,r=0.999 9,结果表明胆酸在0.254 1~1.270 5μg呈现良好的线性关系。
2.6 精密度试验
2.6.1 仪器精密度 按2.3制备方法,制备供试品溶液1份,按照色谱条件,进样6次,结果平均峰面积为944.5,RSD=3.99%,表明仪器精密度良好。
2.6.2 重复性试验 按2.3制备方法,分别按正常取样喷次(10次)的50%(5次)、100%(10次)、150%(15次)的喷次数取样,各平行处理3份,共9份供试品溶液,取供试品溶液15 μL,注入液相色谱仪,计算9份供试品每揿胆酸的平均含量为24.9 μg,RSD=3.88%,说明该方法的高、中、低浓度的重复性良好。
2.7 加样回收率试验
取50 mL烧杯,加入15 mL无水乙醇,取咽速康气雾剂,试喷5下,洗净喷口,充分干燥,将喷口置烧杯底部(液面下约2 cm),喷5次,每喷射前充分振摇,水浴浓缩至约1 mL,转移至5 mL量瓶中,精密加入胆酸的对照品溶液(0.050 82 mg·mL-1)2.0 mL,加甲醇至刻度,摇匀,即得。平行操作6份,测定,计算回收率。结果表明,本试验方法的回收率在95.20%~109.25%,平均回收率为105.01%,RSD=5.13%,说明本方法的准确度较高。
2.8 检测限及定量限
在选定的色谱条件下,参照文献[7],以信噪比3∶1时注入液相色谱仪对应的胆酸的量为本方法的检测限,信噪比10∶1时注入液相色谱仪对应的胆酸的量为本方法的定量限。结果表明,胆酸的检测限和定量限分别为0.064 μg,0.13 μg。
2.9 剂量均一性试验
2.9.1 使用期剂量均一性 取3瓶样品(批号为1105002),参照文献[8],按照以上测定方法,每个样品分别在使用期的初期(6~15喷次),中期(36~45喷次),后期(66~75喷次)各测定1次,结果表明样品使用期内剂量均一性良好,见表2。
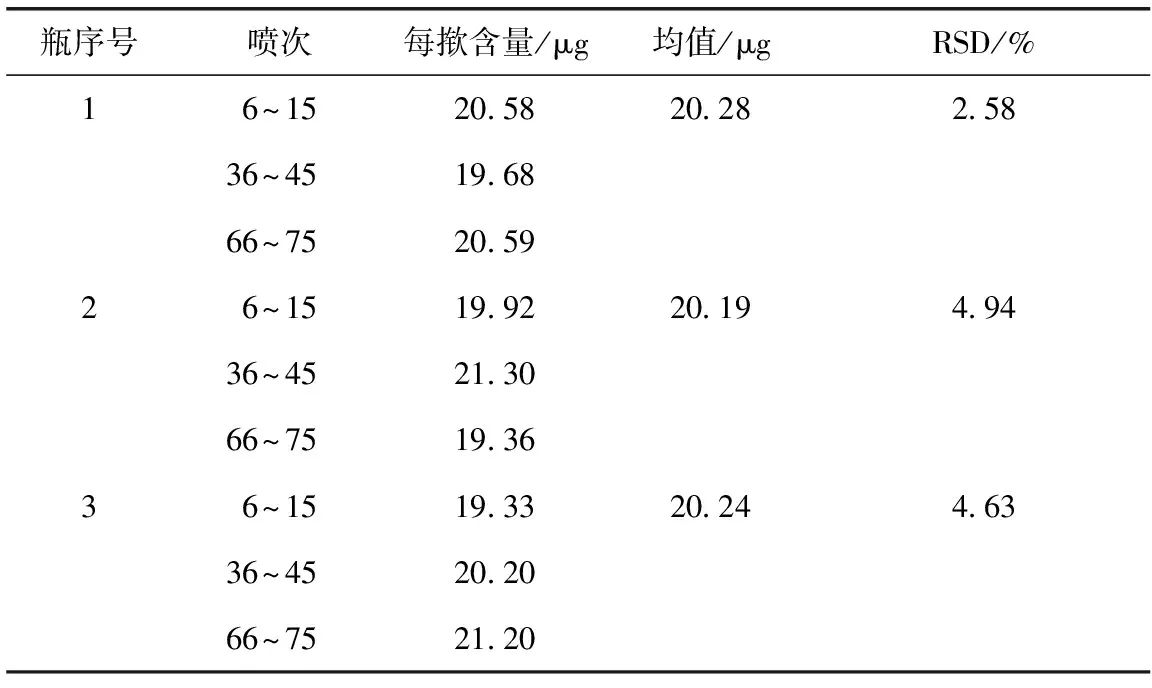
表2 使用期剂量均一性实验结果
2.9.2 瓶间剂量均一性 取10瓶样品(批号为1105002),按照供试品溶液制备方法,每瓶样品制备1份供试品溶液,注入液相色谱仪,进行测定,结果表明咽速康气雾剂瓶间胆酸均一性很好,见表3。

表3 瓶间剂量均一性实验结果
2.10 耐用性试验
2.10.1 溶液稳定性试验 按2.3方法制得供试品溶液,于制备后第0,4,8,12,24,48 h测定胆酸含量,结果表明供试品溶液的胆酸含量在48 h之内变化不大,RSD=1.7%,表明供试品溶液在48 h内相对比较稳定。
2.10.2 提取时间的影响试验 取3份本品药液,每份10 mL,置25 mL容量瓶中,分别加入甲醇10 mL,超声处理(功率150 W,频率25 kHz)15,30,45 min,取出,放至室温,加甲醇定容至刻度,滤过,取续滤液测定,比较不同超声时间胆酸的含量。结果提取时间变化后胆酸含量的RSD=1.1%,表明提取时间在15~45 min变化对胆酸的提取基本没有影响。考虑到方法的简捷性,选择超声处理15 min作为提取时间。
2.10.3 柱温的影响试验 按2.3方法制备供试品溶液,柱温分别设定为25,35,40 ℃,其他色谱条件不变,测定,计算各个柱温时的供试品中胆酸的含量。试验结果表明,柱温在25~40℃变化时,胆酸含量的RSD=0.53%,对胆酸含量测定结果影响很小。
2.10.4 色谱柱的影响试验 取3份本品药液,每份10 mL,按2.3方法制备供试品溶液,分别选用3个品牌的C18色谱柱试验,其他色谱条件不变,测定,计算不同色谱柱时的供试品中胆酸的含量。试验结果表明,更换不同品牌的C18色谱柱,胆酸含量的RSD=0.58%,对胆酸含量测定影响很小。
从上述的溶液稳定性试验,提取时间、柱温、色谱柱的变化试验,说明本方法耐用性良好。
2.11 样品含量测定
采用上述方法对3批咽速康气雾剂(批号:1105001,105002,1105003)进行含量测定,结果每揿胆酸含量分别为19.14,21.35,19.32 μg。
3 讨论
3.1 供试品溶液制备时取样揿次选择
咽速康气雾剂每毫升含胆酸最低限为0.5 mg,正常情况下每瓶含胆酸1.5 mg,按平均揿次95次计算,每揿含胆酸理论值为15.3 μg,经以每揿喷出药液制备供试品溶液,以进样量15 μL计,仅有0.046 μg胆酸进样,所得胆酸峰面积低于定量限。经推算与试验,选择10揿次喷出药液制备供试品溶液较为合适。
3.2 胆酸每揿含量指标确定
通过对咽速康气雾剂每揿人工牛黄中胆酸含量测定方法的验证,说明本实验方法专属性强、精密度良好、准确度高、线性良好、耐用性适宜和剂量均一性良好,故应将其列入咽速康气雾剂药品标准。
结合3批咽速康气雾剂每揿含量测定实际值,考虑到该产品生产工艺的复杂性,确定每揿中人工牛黄含胆酸不得少于11 μg。
作者经过研究探索,建立了HPLC-ELSD测定咽速康气雾剂中每揿胆酸含量的方法,并经方法学考察,能够精确控制使用环节咽速康气雾剂的实际服用量,填补了中药气雾剂每揿主药含量检查的空白,是中药气雾剂质量控制水平的进步。另外,咽速康气雾剂还含有大毒中药蟾酥和雄黄,为了保障其安全性,我们也建立了这两味中药的每揿毒性成分含量测定方法及上下限控制范围,将另文发表。
[1] 岳志华,张启明,牛秀华.对几种气雾剂的质量考察和新版药典气雾剂质量标准修订的建议[J].中国药品标准,2007,8(6):445-447.
[2] 国家药典委员会.中国药典[S].一部.附录ⅠZ.北京:化学工业出版社,2000:附录19.
[3] 国家药典委员会.中国药典[S].一部.附录ⅠZ.北京:中国医药科技出版社,2010:附录16.
[4] 张慧燕.关于完善中药气雾剂质量标准的建议[J].中国药品标准,2005,6(1):55-56.
[5] 刘华钢.中药气雾剂的研究概况[J].广西中医学院学报,2003,6(1):58-62.
[6] 季艳艳,周林,常新全,等.HPLC-ELSD测定咽速康气雾剂中胆酸的含量[J].中国实验方剂学杂志,2010,16(10):91-92,95.
[7] 曹进,徐燕,王义明,等.清开灵注射液中三种胆酸含量测定方法比较[J].中成药,2003,25(9):705-708.
[8] 金方,侯曙光,魏农农.氟利昂替代后吸入气雾剂(MDIs)的研究要求和进展I—欧美抛射剂替代的MDIs研发和质量控制[J].中国医药工业杂志,2009,40(7):543-548.
HPLC-ELSDDeterminationofBileAcidperActuationinYansukangAerosol
CHANG Xin-quan1*,YANG Na2,SONG Xiao2
(1.ChinaNationalCorp.ofTraditional&HerbalMedicine,Beijing102600,China; 2.HuayiPharmaceuticalCo.,Ltd,Beijing102600,China)
Objective: To develop a high performance liquid chromatography(HPLC)method for the quantification of bile acid,a main active ingredient of artificial bezoar in Yansukang aerosol,for the purpose of assaying the drug content per actuation.Methods: HPLC-evaporative light scattering method was used.Mobile phase:methanol was mobile phase A,0.1% glacial acetic acid solution was mobile phase B,gradient elution.Flow velocity:1.0mL·min-1.Column temperature:35 ℃.Temperature of drift tube:35 ℃.Carrier gas:high purity nitrogen.Gas pressure:33 psi.Sample size:15 μL.Results: Bile acid linear rage was 0.254 1~1.270 5 μg,r=0.999 9.The average recovery rate was 100.27%,RSD=2.13%(n=6).Conclusion: The method was specific,and had good precision,high accuracy,good linearity,appropriate durability,and good homogeneity.The assay was demonstrated to be suitable to measure bile acid content per actuation in Yansukang aerosol.
Yansukang aerosol; Bile acid; Content determination
2013-02-22)
*
常新全,高级工程师,Tel:(010)61252991,E-mail:13911273610@139.com
