环孢素A体内抗日本血吸虫的实验研究
2013-09-26胡奇丰柳建发
胡奇丰,柳建发
血吸虫病是世界上严重危害人类健康的寄生虫病之一。现已发现对人类致病的血吸虫主要有以下3种:埃及血吸虫、曼氏血吸虫和日本血吸虫[1]。我国流行的是日本血吸虫,主要分布于长江流域及以南的广大流域,大多为我国农业生长的重要基地,人口密集。血吸虫病严重危害人民的健康和经济发展。
日本血吸虫病是日本血吸虫寄生在门静脉系统所引起的疾病,主要病变为肝与结肠由虫卵引起的肉芽肿。目前,吡喹酮是治疗血吸虫病的首选药物[2],但国外报道指出,已发现对吡喹酮具有抗药性的虫株[3-4]。因此,临床上急需一种新的抗血吸虫病的药物。大量研究结果显示,临床使用的免疫抑制剂环孢素A(CsA)不仅能有效杀灭体内疟原虫、血吸虫、绦虫和线虫等多种寄生虫,具有广谱抗寄生虫的功能,而且对人和动物寄生虫都有着良好的预防和治疗作用[5]。研究结果表明,CsA在体内外对曼氏血吸虫的抗虫效果尤其显著,体内用药效果根据相对感染的治疗时间、给药的途径、剂量而呈现不同,但目前其抗虫机制尚不明确[6-7]。而CsA对体内抗日本血吸虫的作用效果还未见报道,本实验主要通过长爪沙鼠血吸虫模型研究CsA体内抗虫效果。
1 材料与方法
1.1 实验动物 健康雄性长爪沙鼠96只,清洁级,体重50~60g,购自浙江省动物中心。日本血吸虫尾蚴购自江苏省血吸虫病防治研究所。
1.2 主要试剂和仪器 环孢素A为瑞士Borel教授馈赠,2.5%戊二醛和4%多聚甲醛溶液为本实验室制备。生物显微镜(CX 40)为日本OLYMPUS公司产品,扫描电镜(S-3400N)和透射电镜(H-7650)为日本日立公司产品。Masson染色试剂盒购自福建迈新生物技术开发有限公司。苏木素-伊红(HE)染液由宁波大学医学院病理教研室提供。
1.3 实验方法 96只长爪沙鼠随机分8组,每组12只,A 组为正常组,B组为对照组,C、D、E、F、G和H为治疗组。B、C、D、E、F、G和 H组以腹部贴片法感染日本血吸虫尾蚴,每鼠感染120±2条尾蚴,建立血吸虫病动物模型。于感染后(Day 0)对C、D和 E 3组分别给予3种不同剂量(10,20,50 mg/kg·d)的环孢素A治疗,连续5d,于背部皮肤注射给药。于感染后第3周(Day 21)对F、G和H三组给予同样剂量的环孢素A治疗,连续5天。5周后解剖全部沙鼠,经门静脉灌注收集成虫,计数虫荷,计算减虫率。每组虫体根据性别分为雌雄两组,用2.5%戊二醛固定后,扫描电镜(SEM)和透射电镜(TEM)观察虫体表面损害情况。病理学观察:取沙鼠肝脏和肠壁制作常规病理切片,切片厚度为4 μm,然后进行HE染色观察虫卵肉芽肿面积大小,Masson染色观察肝脏纤维化程度。
1.4 统计学分析 用SPSS17.0软件对数据进行统计学分析,采用方差分析检验(检验水准α=0.05)。
2 结 果
2.1 减虫率计算
减虫率计算公式=模型组检获虫数-治疗组检获虫数×模型组检获虫数100%
从表1可以看出,和模型组相比,感染后立即给药(Day 0)的沙鼠,低剂量给药组(C)和中剂量给药组(D)虫体减少不明显(P>0.05),而高剂量给药组(E)虫体数显著减少(P<0.05);感染后3周给药的沙鼠(Day 21),低剂量给药组(F)虫体无明显减少(P>0.05),而中剂量组(G)和高剂量组(H)减虫效果显著(P<0.01)。
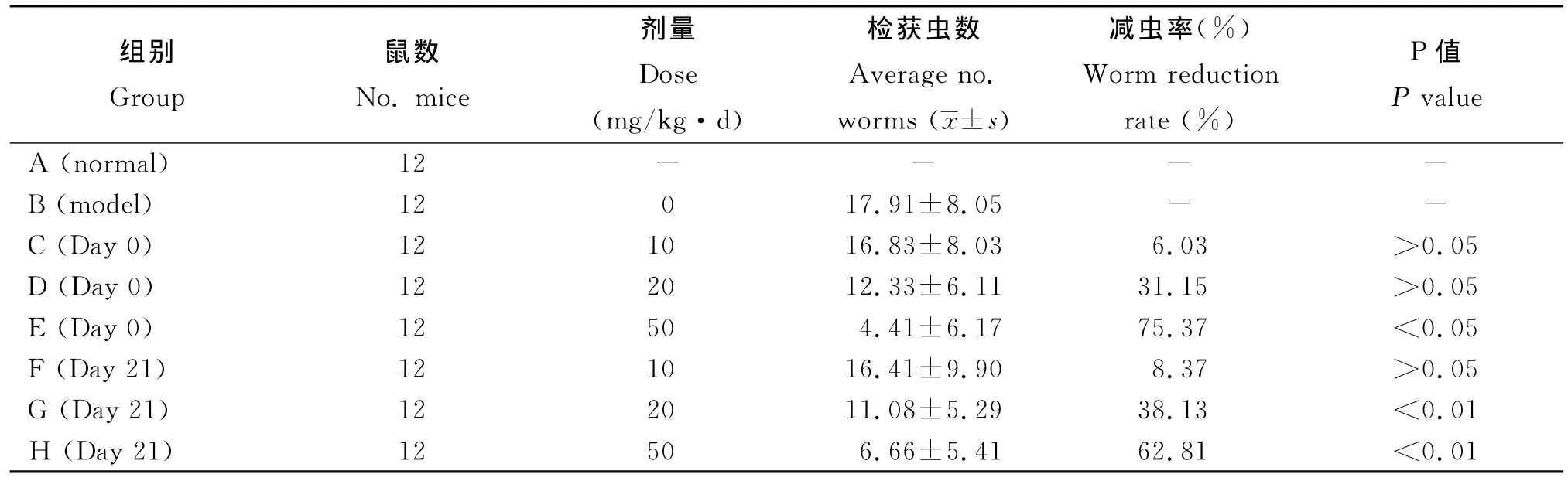
表1 减虫率Tab.1 Worm reduction rate
2.2 肝脏大体观察 肉眼观察肝脏大体可见正常组沙鼠肝脏颜色鲜艳,呈红褐色,质地柔软,表面光滑,无任何病理症状(Fig.1A)。模型组沙鼠肝脏颜色变灰褐色,表面有大量粟粒状白色斑点,质地变硬,表面粗糙(Fig.1B)。经CsA治疗后,低剂量组的沙鼠肝脏与模型组呈现相似的病理症状(Fig.1C,1F)。中剂量组虫卵结节减少,颜色虽较正常暗淡,但和模型组相比已有明显改善(Fig.1D,1G)。高剂量组治疗效果显著,几乎未见虫卵结节,颜色、质地与正常肝脏相近(Fig.1E,1H)。各治疗组肝脏大体观察结果表明,CsA治疗呈剂量依赖性,用药时间对本实验结果无显著影响。
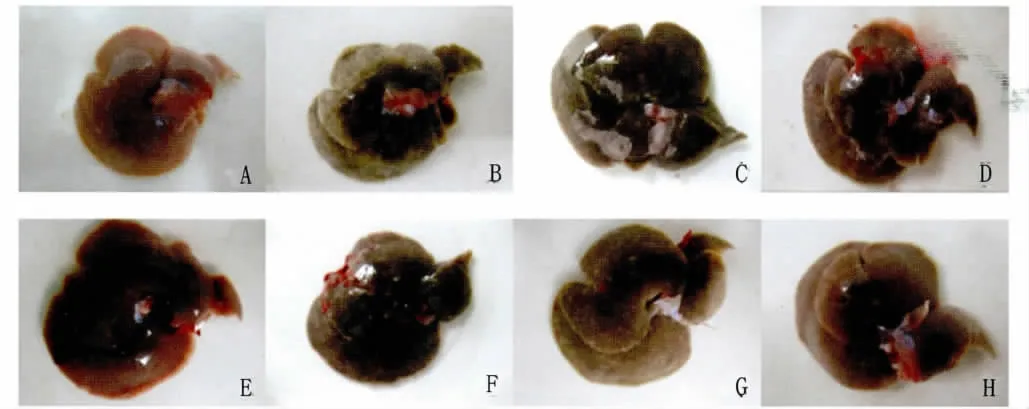
图1 肝脏大体观察A:正常组;B:模型组;C:低剂量组(Day 0);D:中剂量组(Day 0);E:高剂量组(Day 0);F:低剂量组(Day 21);G:中剂量组(Day 21);H:高剂量组(Day 21)Fig.1 Liver observationA:Normal group;B:Model group;C:Low does group(Day 0);D:Mid does group(Day 0);E:High does group(Day 0);F:Low does group(Day 21);G:Mid does group(Day 21);H:High does group(Day 21)
2.3 肝脏HE染色 光镜下观察可见正常组小鼠肝小叶结构正常,中央静脉及肝细胞呈放射状排列,肝细胞无肿胀变性坏死,无任何病理症状(Fig.2A)。而模型组肝组织内虫卵散布沉积,部分汇管区内虫卵成堆聚集,汇管区及虫卵周围大量淋巴细胞及嗜酸性粒细胞浸润,形成大面积的虫卵肉芽肿,肝组织损伤严重,肝细胞大量凝固性坏死(Fig.2B)。经CsA治疗后,低剂量组与模型组无明显差异,大面积的虫卵肉芽肿连接成片(Fig.2C,2F)。中剂量组可见肉芽肿面积有所减小,肝组织损伤减轻(Fig.2D,2G)。高剂量组肉芽肿面积显著减小,肝组织完整几乎无损伤,虫卵数量明显减少,零散分布,无大面积聚集区域(Fig.2E,2H)。HE实验结果显示,CsA治疗时间和肝脏肉芽肿大小之间并无显著联系,只呈剂量依赖关系。
2.4 肠壁HE染色 正常组肠壁组织结构层次清楚,肠绒毛完整清晰(Fig.3A)。模型组肠壁黏膜下层发现大量虫卵沉积,黏膜破碎,肠壁内虫卵密度较高,虫卵周围出现肉芽肿反应(Fig.3B)。经CsA治疗后,低剂量组与模型组无明显差异(Fig.3C,3F)。中剂量组可见虫卵减少,肉芽肿面积减小(Fig.3D,3G)。高剂量组只有很少虫卵产生,部分虫卵死亡及钙化,肠壁组织几乎无损伤(Fig.3E,3H)。和HE结果类似,CsA治疗时间和肠壁肉芽肿大小之间并无显著联系,只呈剂量依赖关系。
2.5 Masson染色 正常组肝脏汇管区及中央静脉有少量胶原纤维(Fig.4A)。模型组可见肉芽肿周围出现大量纤维化组织围绕,并向四周延伸(Fig.4B)。CsA低剂量组胶原染色面积未见明显减少(Fig.4C,4F),中剂量组纤维面积较模型组和低剂量组有所减少,但仍可见大量纤维化组织围绕(Fig.4D,4G),在高剂量组中,胶原纤维显著减少,只可见零星纤维化组织(Fig.4E,4H)。
2.6 扫描电镜(SEM)观察 正常雄、雌虫体体壁表面呈海绵状,具有明显而复杂的褶嵴、凹窝、体棘和感觉乳突(Fig.5A,5E)。用药后虫体体壁表面主要变化是皮层褶嵴肿胀,出现大量泡状物,随药物剂量增加而不断扩展加重,在中、高剂量组可见皮层大面积糜烂和破溃,致使皮层下组织显露。在所用剂量下,药物对雌、雄虫体壁表层的损害作用相仿(图5)。
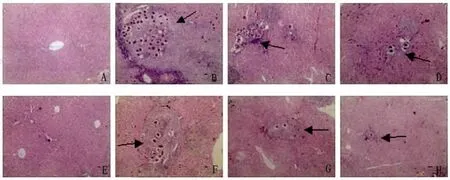
图2 肝脏肉芽肿的病理变化 (HE染色,×100)A:正常组;B:模型组;C:低剂量组(Day 0);D:中剂量组(Day 0);E:高剂量组(Day 0);F:低剂量组(Day 21);G:中剂量组(Day 21);H:高剂量组(Day 21)Fig.2 Histopathological changes in liver granulomas(HE staining,×100)A:Normal group;B:Model group;C:Low does group(Day 0);D:Mid does group(Day 0);E:High does group(Day 0);F:Low does group(Day 21);G:Mid does group(Day 21);H:High does group(Day 21)
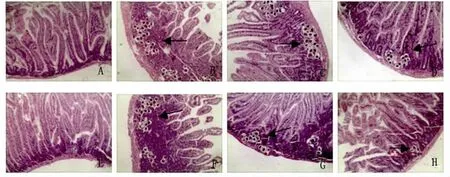
图3 肠壁肉芽肿的病理变化 (HE染色,×100)A:正常组;B:模型组;C:低剂量组(Day 0);D:中剂量组(Day 0);E:高剂量组(Day 0);F:低剂量组(Day 21);G:中剂量组(Day 21);H:高剂量组(Day 21)Fig.3 Histopathological changes in intestine granulomas(HE staining,×100)A:Normal group;B:Model group;C:Low does group(Day 0);D:Mid does group(Day 0);E:High does group(Day 0);F:Low does group(Day 21);G:Mid does group(Day 21);H:High does group(Day 21)
2.7 透射电镜(TEM)观察 正常雄、雌虫体体表结构完整清晰,由体被、基膜及体被下层构成(Fig.6A,6E)。用后可见雌、雄虫皮层细胞质有不同程度的突起肿胀,体表结构紊乱。在高剂量组可看到大量巨大空泡产生,细胞质破溃或溶解(图6)。
3 讨 论
CsA是从真菌中提取的一种具有强效免疫抑制力的环状多肽[8],在体外可抑制许多寄生虫的生长[9]。已知CsA引起的虫体损坏与药物的一种结合蛋白——亲环蛋白(cyclophilin)有关。亲环蛋白是一类蛋白质家族,存在于所有的真核生物和原核生物中,可抑制肽基脯氨酰顺反异构酶活性,以及在不同程度上结合免疫抑制剂CsA[10]。亲环蛋白与CsA结合形成的复合物可抑制钙调磷酸酶活性,但该抑制作用不参与抑制信号转导途径[11]。另外还发现NF-AT样转录因子是一种对CsA敏感的蛋白家族,它可能的作用与调节宿主体内寄生虫的生长和分化有关,且具有编码Sm28GST蛋白分子的功能。研究证明经CsA处理曼氏血吸虫的幼虫,其Sm28GST蛋白表达受到抑制[12]。现已知亲环蛋白-CsA复合物可抑制NF-AT样转录因子的去磷酸化作用,使转录因子不能转移到细胞核内,从而阻断细胞转录相关的基因复制[13]。上述研究结果为了解CsA抗血吸虫作用提供了一种新视野。
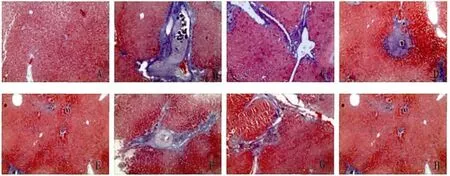
图4 肝脏胶原面积的变化 (Masson染色,×100)A:正常组;B:模型组;C:低剂量组(Day 0);D:中剂量组(Day 0);E:高剂量组(Day 0);F:低剂量组(Day 21);G:中剂量组(Day 21);H:高剂量组(Day 21)Fig.4 Changes of liver collagen(Masson staining,×100)A:Normal group;B:Model group;C:Low does group(Day 0);D:Mid does group(Day 0);E:High does group(Day 0);F:Low does group(Day 21);G:Mid does group(Day 21);H:High does group(Day 21)
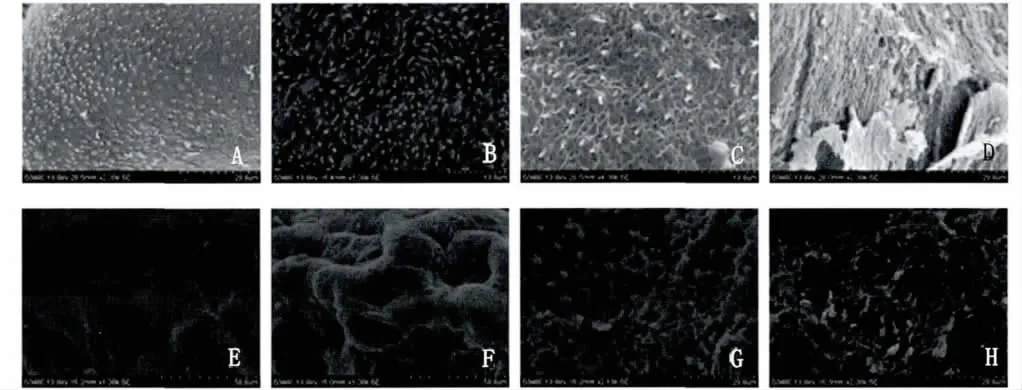
图5 虫体体壁SEM观察A:正常雄虫;B:雄虫(低剂量组);C:雄虫(中剂量组);D:雄虫(高剂量组);E:正常雌虫;F:雌虫(低剂量组);G:雌虫(中剂量组);H:雌虫(高剂量组)Fig.5 Worm surface observation by SEMA:Male(Normal);B:Male(Low does group);C:Male(Mid does group);D:Male(High does group);E:Female(Normal);F:Female(Low does group);G:Female(Mid does group);H:Female(High does group)
最近Page等[14]从马来丝虫中分离出一个cDNA克隆,该克隆表达一种和亲环蛋白类似的N末端区和亲水性C末端区。原核表达结果表明,该蛋白具有肽基脯氨酰顺反异构酶活性。该蛋白与CsA结合的位点中,组氨酸取代了色氨酸,因此马来丝虫对CsA的耐药性显著增加。其可能的作用机制为,组氨酸取代色氨酸后,亲环蛋白类似物与CsA的亲和力降低,影响NF-AT样转录因子的去磷酸化作用,从而使虫体对CsA的耐药性增加[15]。上述研究均表明寄生虫中亲环蛋白的存在和功能与CsA的抗虫作用有紧密联系[16]。
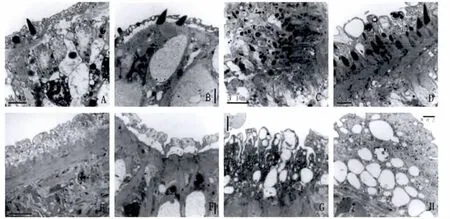
图6 虫体体壁TEM观察A:正常雄虫;B:雄虫低剂量组;C:雄虫中剂量组;D:雄虫高剂量组;E:正常雌虫;F:雌虫低剂量组;G:雌虫中剂量组;H:雌虫高剂量组Fig.6 Worm surface observation by TEMA:Male(Normal);B:Male(Low does group);C:Male(Mid does group);D:Male(High does group);E:Female(Normal);F:Female(Low does group);G:Female(Mid does group);H:Female(High does group)
目前国外已对CsA抗血吸虫的研究取得初步进展,认为CsA可直接作用于曼氏血吸虫的早期,干扰虫体生存[17]。单独使用CsA可减少虫荷数并优先作用于雌虫,而单独使用抗血清对虫荷数无显著影响,若两者联合使用则可显著地减少虫荷数。CsA还损坏虫体表面,暴露虫体特异性抗原[18]。扫描电镜下观察旋毛虫发现,经CsA处理之后,成虫体表组织损坏,外层起皱脱落,特别是皮下毛孔增厚,出现不规则排列。CsA对虫体表皮的破坏和其作用机制有重要联系[19]。小口膜壳绦虫经CsA处理后,虫体表面形成突起,节片肿胀。研究结果表明CsA能使虫体表面细胞膜渗透性改变,但具体机制还未被阐明[20]。CsA同样能干扰绦虫表皮的正常功能,使其摄取葡萄糖的功能受损[21]。而CsA及其类似物均能在体外引起寄生虫表面和线粒体的损坏[22]。
我国是日本血吸虫病的流行区。当日本血吸虫尾蚴接触到人或哺乳动物皮肤后,尾蚴尾部脱落形成童虫,童虫在皮下组织停留短暂时间后转移入体内,最后汇集于肝门静脉,大概21d后变成成虫。童虫和成虫的抗原成分均可诱导宿主产生免疫反应。所以本实验分别选取感染后(Day 0)与第3周(Day 21)给予CsA药物治疗,以观察CsA对童虫和成虫的作用效果。实验结果显示,经CsA治疗后,肝脏和肠壁中的虫卵减少,肉芽肿面积减小,纤维化程度减轻,且该治疗效果和CsA给药剂量正相关。电镜结果显示CsA对雌、雄虫体表面皮层均有损害作用,表明CsA对童虫和成虫均有杀伤作用,且呈剂量依赖性。动物实验表明CsA能抑制T淋巴细胞参与调节的免疫反应,而不影响B淋巴细胞和巨噬细胞的功能[23-24]。CsA 通过结合亲环蛋白抑制T淋巴细胞增殖,而T淋巴细胞参与调节的免疫反应介导了虫卵肉芽肿的产生,导致肝纤维化形成。所以CsA选择性的抑制作用可能是减轻肝纤维化程度的原因。
总而言之,CsA在抗寄生虫方面的有着明显的作用,而且没有免疫抑制力的环孢素类衍生物在某些寄生虫病上也有很大的临床应用潜力[25]。CsA对日本血吸虫具有明显的抗虫效果,能有效减少宿主体内的虫卵数,对童虫和成虫均有灭杀作用,减少肝脏和肠壁虫卵数,减轻肝脏纤维化作用,作用效果呈剂量依赖型。综上所述,CsA具有明显的抗日本血吸虫功能,但具体的作用机制还有待进一步阐述。我们可以进一步应用分子生物学的方法,对于其具体的作用机制进行更深入的研究。
[1]Engels D,Chitsulo L,Montresor A,etal.The global epidemiological situation of schistosomiasis and new approaches to control and research[J].Acta Trop,2002,82(2):139-146.DOI:10.1016/S0001-706X(02)00045-1
[2]Fenwick A,Savioli L,Engels D,etal.Drugs for the control of parasite disease:current status and development in schistosomiasis[J].Trends Parasitol,2003,19(11):509-515.DOI:10.1016/j.pt.2003.09.005
[3]Fallon PG,Sturrock RF,Capron A,etal.Diminished susceptibility to praziquantel in a Senegal isolate of Schistosoma mansoni[J].Am J Trop Med Hyg,1995,53(1):61-62.
[4]Fallon PG,Mubarak JS,Fookes RE,etal.Schistosoma mansoni:Maturation rate and drug susceptibility of different geographic isolates[J].Exp Parasitol,1997,86(1):29-36.DOI:10.1006/expr.1997.4149
[5]Chappell LH,Wastling JM.Cyclosporin A:antiparasite drug,modulator of the host-parasite relationship and immunosuppressant[J].Parasitology,1992,105:25-40.
[6]Bueding E,Hawkins J,Cha YN.Antischistosomal effects of Cyclosporine A[J].Agents Actions,1981,11(4):380-383.
[7]Millership JJ,Chappell LH,Fallon PG.Synergistic action of cyclosporin A and polyspecific rabbit anti-sera against murine Schistosomamansoni[J].Parasite Immunol,1996,18(2):71-77.
[8]Borel JF,Baumann G,Chapman I,etal.In vivo pharmacological effects of ciclosporin and some analogues[J].Adv Pharmacol,1996,35:115-246.
[9]Page AP,Kumar S,Carlow CK.Parasite cyclophilins and antiparasite activity of cyclosporin A[J].Parasitol Today,1995,11(10):385-388.
[10]Yang Y,Moir E,Kontopidis G,etal.Structure-based discovery of a family of synthetic cyclophilin inhibitors showing a cyclosporin-A phenotype in Caenorhabditis elegans[J].Biochem Biophys Res Commun,2007,363(4):1013-1019.DOI:10.1016/j.bbrc.2007.09.079
[11]Roberts HC,Sternberg JM,Chappell LH.Characterization of calcineurin from Hymenolepism icrostomaand H.diminutaand its interaction with cyclosporin A[J].Parasitology,1997,114(3):279-283.
[12]Serra EC,Lardans V,Dissous C.Identification of NF-AT-like transcription factor in Schistosoma mansoni:its possible involvement in the antiparasitic action of cyclosporin A[J].Mol Biochem Parasitol,1999,101(1-2):33-41.
[13]Clipstone NA,Crabtree GR.Identification of calcineurin as a
key signalling enzyme in T-lymphocyte activation[J].Nature,19923576380695-697.DOI10.1038357695a0
[14]Page AP,Landry D,Wilson GG,etal.Molecular characterization of a cyclosporine A-insensitive cyclophilin from the parasitic nematode Brugia malayi[J].Biochemistry,1995,34(36):11545-11550.
[15]Ellis PJ,Carlow CK,Ma D,etal.Crystal structure of the complex of brugia malayi cyclophilin and cyclosporin A[J].Biochemistry,2000,39(3):592-598.
[16]Roberts HC,Sternberg JM,Chappell LH.Hymenolepis diminuta and H.microstoma:uptake of cyclosporin A and drug binding to parasite cyclophilins[J].Parasitology,1995,111(5):591-597.
[17]Pons HA,Adams S,Stadecker MJ.Schistosoma mansoni:the basis for the antischistosomal effect of cyclosporine A[J].Exp Parasitol,1988,67(2):190-198.
[18]Millership JJ,Chappell LH,Fallon PG.Synergistic action of cyclosporin A and polyspecific rabbit anti-sera against murine Schistosoma mansoni[J].Parasite Immunol,1996,18(2):71-77.
[19]Boulos LM,Abu-Samra LM,el-Azzouni MZ.Cyclosporin A in experimental trichinosis scanning electron microscopic study[J].J Egypt Soc Parasitol,1992,22(3):767-773.
[20]Wastling JM,MacKenzie K,Chappell LH.Effects of cyclosporin A on the morphology and tegumentary ultrastructure of Hymenolepis microstoma in vivo[J].Parasitology,1992,104(Pt 3):531-538.
[21]Wastling JM,Chappell LH.Cyclosporin A:drug treatment in vivo affects the kinetics of[14C]glucose transport in Hymenolepis microstoma in vitro[J].Parasitology,1994,108(2):223-228.
[22]McLauchlan PE,Roberts HC,Chappell LH.Mode of action of cyclosporin A against Hymenolepis microstoma (Cestoda):relationship between cyclophilin binding and drug-induced damage[J].Parasitology,2000,121(6):661-670.
[23]McLauchlan PE,Roberts HC,Chappell LH,etal.Effects of the new anti-lymphocytic peptide cyclosporin A in animals[J].Immunology,1977,32(6):1017-1025.
[24]Thomson AW,Whiting PH,Simpson JG.Cyclosporine:immunology,toxicity and pharmacology in experimental animals[J].Agents Actions,1984,15(3-4):306-327.
[25]Bell A,Roberts HC,Chappell LH.The antiparasite effects of cyclosporin A:possible drug targets and clinical applications[J].Gen Pharmacol,1996,27(6):963-971.DOI:10.1016/0306-3623(95)02148-5
