二聚体蝎型探针荧光定量PCR快速检测志贺菌方法的建立及初步应用
2013-09-26吴尔翔丁锁顺邵亚平唐晓宇
陈 峰,吴尔翔,丁锁顺,邵亚平,章 杰,唐晓宇
志贺菌是一种常见人兽共患病原菌,在公共卫生学领域十分重视[1-2]。志贺菌属于常见且重要的肠道致病菌,易引起人类的食物中毒,导致相应的消化道症状,且易于传播,因此早期的检测、治疗并控制传染源有着重要意义[3]。目前临床针对志贺菌的检测仍采取细菌培养鉴定,抗原、抗体的血清免疫学检查为主的方式。由于病原微生物的分离、培养、鉴定、分型、标记等检测过程繁琐,不能满足临床的需要。因此建立快速、敏感且特异性高的志贺菌检测方法非常必要,可有效地预防该病,控制疾病的传播[4]。本研究根据志贺菌的ipaH基因序列为模板,设计引物和探针,应用荧光定量PCR法,特异性检测的志贺菌,以便为进一步应用于志贺菌快速检测法的建立奠定基础。
1 材料和方法
1.1 材料
1.1.1 菌株 福氏志贺菌购于中国菌种保藏中心;大肠埃希菌、金黄色葡萄球菌、白色念珠菌、铜绿假单胞菌、伤寒沙门氏菌、肠球菌为实验室分离鉴定后的保存菌株。
1.1.2 实验材料 7500型荧光定量PCR仪(美国ABI公司);PCRMix、Taq酶、dNTP、基因组 DNA提取试剂盒购于TaKaRa公司。
1.1.3 引物设计与合成 根据GenBank公布的福氏志贺菌M32063株ipaH基因序列,采用Primer软件设计PCR引物,上游引物F1:5′-GCTCTCCACTGCCGTGAAGG-3′,下游引物 R1:5′-AGTACAGCATGCCATGGTCC-3′,引物序列由上海英骏公司合成。二聚体蝎型探针的上游引物F2、标记的荧光报告基团的核苷酸链由hexethylene glyco1(HEG)连接如下,5′-FAM-CCGACACGCCATAGAAACGC-HEG-AGCTCTCCACTGCCGT
GAAGG-3′,标 记 猝 灭 基 团 的 互 补 链 为 5′-GCGTTTCTATGGCGTGTCGG-DABCYL-3′, 下游引物 R2:5′-ATAGCTTCGGCAGTGCGGAGG-3′,由生工生物工程(上海)有限公司合成方法。
1.2.1 志贺菌重组标准品的制备
1.2.1.1 细菌DNA提取 接种菌落于琼脂平板上,37℃培养12~16h;刮取1~2接种环菌苔加入100μL三蒸水中,混匀,100℃煮沸10min;12 000 r/min离心10min,取上清,-20℃保存备用。
1.2.1.2 PCR 反应体系总体积25μL:10×Buffer:2.5μL;MgCl2:2.0μL;dNTP mix(10mmol/L):2.0μL;F1(10μmol/L):1.0μL;R1(10μmol/L):1.0μL;DNA:5.0μL;Taq DNA 聚合酶:0.5 μL;ddH2O:11μL。反应条件:94℃变性10min,30个循环(94℃10min,94℃1min,55℃1min,72℃65 s),72℃延伸10min。
1.2.1.3 pMDl8-T-ipaH 重组质粒的构建 PCR扩增片段经1.5%糖凝胶电泳,用胶回收试剂盒回收目的片段,用DNA连接试剂盒16℃过夜连接经PCR扩增回收的目的片段和质粒pMDl8-T,将连接产物转化大肠埃希菌H5α后涂在氨苄青霉素(Amp+)的1.5%琼脂LB平板。
1.2.1.4 pMDl8-T-ipaH 重组质粒的鉴定 挑取少量菌落,接种于LB液体培养基内,100℃水浴5 min,立即置于冰上,12 000r/min离心10s,吸取上清行PCR扩增反应,扩增产物酶切后,使用1.5%琼脂糖凝胶电泳。取鉴定后筛选出的阳性克隆重组质粒,送至上海英骏公司测序并鉴定。
1.2.2 标准曲线绘制 将上述各已知浓度的重组质粒DNA标准品分别按10倍梯度稀释,获得8个浓度的系列标准品,浓度分别为108~101copies/μL,后以每个浓度的标准品为模板,行实时定量PCR反应,浓度的对数为X轴,相对应的阈值循环数(threshold cycle,Ct)为 Y 轴,经软件处理得标准曲线。
1.2.3 实时定量PCR检测体系的建立 在20μL反应体系中,加入1μLDNA,二聚体蝎型探针上游引物F22μL,淬灭链2μL,下游引物 R22μL,dNTP1.6μL,Mg2+2μL,10×Buffer2μL,Taq酶0.2μL,ddH2O 7.2μL。预变性3min,93℃变性反应20s,53℃退火延伸15s,进行40个循环,于53℃检测荧光信号。
1.2.4 实时定量PCR实验条件的优化
1.2.4.1 敏感性 将质粒按l0倍比例稀释至浓度极限101copies/μL,双蒸水为阴性对照,进行荧光定量PCR反应,以可区别阴性对照的最低质粒浓度为最低检测值。
1.2.4.2 特异性 用福氏志贺菌、大肠埃希菌、金黄色葡萄球菌、白色念珠菌、铜绿假单胞菌、伤寒沙门氏菌、肠球菌制备模板,用建立的方法进行检测。1.2.4.3 稳定性 将不含Taq酶及模板外的全部PCR试剂混合为反应液,分别取107~101copies/μL梯度的质粒,制作标准曲线,将剩余的反应液及标准品质粒置于-20℃冻存,每两天冻融一次,1月后后使用相同试剂再次制作标准曲线,对比两条标准曲线。
1.2.4.4 重复性 批内重复性:一次检测对一个浓度临床样品重复做10个平行管,以Ct值计算SD和CV。批间重复性:1天之内对一个浓度临床样品重复检测10次,以Ct值计算SD和CV。天间重复性:检测一个浓度临床样品,每天测一次,连续测定10d,记录结果并以Ct值计算SD和CV。
1.2.4.5 临床粪便标本的检测 将收集临床可疑粪便样本15份,取约黄豆大小的可疑粪便于0.5 mL PBS 0.1mmol/L pH 值为7.4,漩涡混匀,取上层至另一离心管中,10 000r/min离心5min,弃上清液,洗涤1次,加入100μL裂解液,漩涡混匀,100℃煮沸10min,10 000r/min离心5min。取上清液进行荧光定量PCR扩增反应,分离培养组作为对照。1.2.4.6 与TaqMan方法比较 应用商品化的志贺菌TaqMan检测试剂盒(上海科兴生物科技有限公司)与建立的二聚体蝎型探针法同时检测25份可疑粪便标本,检测结果进行统计学分析。
2 结 果
2.1 志贺菌标准品重组质粒的构建 使用志贺菌基因组DNA进行PCR扩增,产物经琼脂糖凝胶电泳,得到约151bp片段,结果见图1。产物纯化回收,将目的基因克隆至载体,提取构建质粒进行酶切、测序等工作,证实扩增片段与目的序列相符。
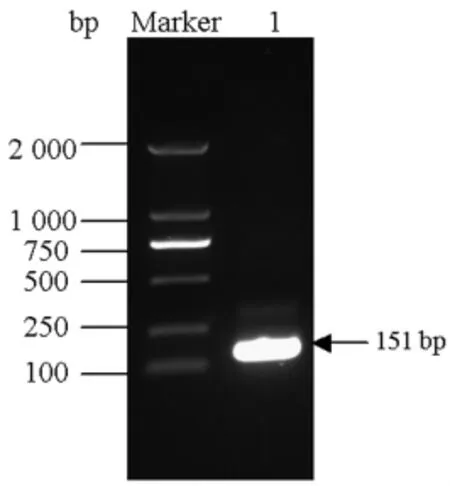
图1 PCR扩增ipaH基因电泳结果Marker:DNA 标 准 品 (DL-2000);1:PCR 产 物 (151 bp)Fig.1 PCR amplification of ipaH productsMarker:DNA marker-DL2000;1:PCR products of ipaH (151bp)
2.2 标准曲线的绘制 将制备的志贺菌重组质粒标准品稀释,采用上述的荧光定量PCR扩增体系进行反应,重组质粒标准品的浓度调整与108~101copies/μL时,可出现理想的扩增曲线(图2)和标准曲线(图3)。
2.3 特异性 利用所建立的方法进行检测,结果发现仅有福氏志贺菌为阳性,其余的均为阴性,证明该方法的特异性好。
2.4 敏感性 将标准品原液作梯度稀释,分别为108~101copies/μL,进行荧光定量 PCR 反应(图4),本法最低可检测浓度为10copies/μL。
2.5 稳定性 试剂经反复冻融后,制作标准曲线分别为:Y=-3.472 9X+39.121,相关系数为0.9972;与冻融前的标准曲线比较:Y=-3.5279X+39.851,相关系数为0.996 7;证实试剂的稳定性较好,反复冻融对检测结果的影响小,结果分别见图5、图6。
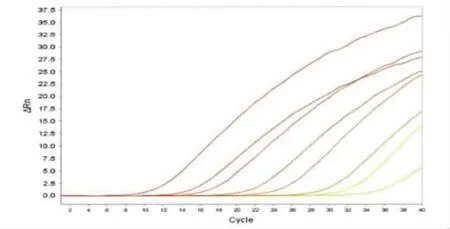
图2 志贺菌重组质粒标准品荧光定量PCR扩增曲线从左至右分别为108~101copies/μL 8个不同浓度标准品的荧光曲线Fig.2 Amplification curves of the recombinant plasmid From the left to the right:108-101copies/μL of the recombinant plasmid fold dilution respectively.
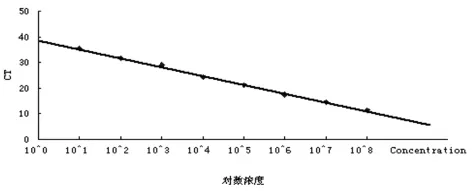
图3 志贺菌重组质粒标准品荧光定量PCR标准曲线Fig.3 Standard curve of the recombinant plasmid

图4 荧光定量PCR的敏感性试验与x轴接近平行的荧光曲线为阴性对照Fig.4 Results of sensitivity test of RT-PCR Fluorescence curve parallel to X axis is the negative control.
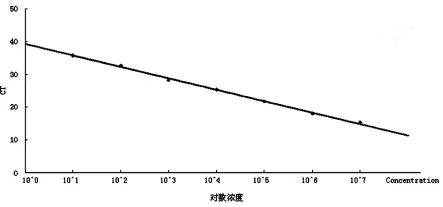
图5 试剂反复冻融前标准曲线Fig.5 Standard curve before repeated freezing and thawing of reagent
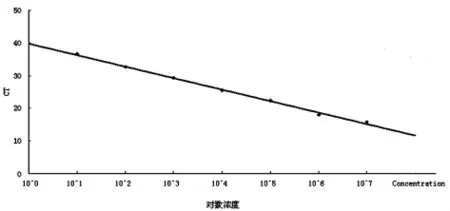
图6 试剂反复冻融后标准曲线Fig.6 Standard curve after repeated freezing and thawing of reagent
2.6 重复性 结果表明样品的批内重复性、批间重复性和天间重复性CV分别为1.61%、1.93%、2.10%,具有良好的重复性。
2.7 临床粪便标本的检测结果 应用实时荧光定量PCR方法和分离培养法分别对15份可疑的粪便标本进行检测,并对比分析,结果显示荧光定量PCR法检测9例为阳性,阳性检出率为:60% ;分离培养法检测7例为阳性,阳性检出率:46.7%。可见荧光定量PCR法于分离培养法均能有效的检测出粪便标本中少量的志贺菌,但荧光定量PCR法仅需要4h,而分离培养法需要3~4d,时间差异明显。
2.8 与TaqMan方法比较结果 应用本方法和志贺菌TaqMan检测试剂盒分别对25份可疑粪便标本进行检测,本法阳性14例,阳性检出率为:56%;TaqMan定量试剂盒检测9例阳性,阳性检出率为36%。Fisher精确概率计算两法检出率差异有统计学意义(P<0.05),二聚体蝎型探针法的敏感性高于TaqMan方法。9例标本两法检测均为阳性,其结果呈偏态分布,经符号秩检验差异无统计学意义(P>0.05)。
3 讨 论
志贺菌属于无动力、无芽孢的G-杆菌,是引起细菌性痢疾发病及传播的主要致病菌,通过受到污染的水源、食物,经过粪口途径传播,可引起大范围的爆发及流行,严重危害公共安全,因此一直受到重点监测,一旦出现可疑病例,往往动用多方资源,早期的隔离治疗[5]。在我国,菌痢被列为法定传染病,须及时上报,危害性仅次于结核和肝炎,在感染性腹泻的发病比例中居首位。志贺菌属可分为痢疾志贺菌、福氏志贺菌、鲍氏志贺菌、宋内志贺菌四个群属,分别简标为 A、B、C、D[6-7]。近年来通过分子生物学的相关手段检测志贺菌的临床应用已普遍开展,且有逐渐取代常规的生物培养鉴定、抗原与抗体检测的趋势,准确性较高,对于疾病的早期诊断、治疗、患者隔离有重要的意义。因此通过分子生物学方法建立敏感、特异的志贺菌检测方法是当务之急[8]。
所有产毒的志贺菌中都有侵袭性大质粒,大小约220kb。侵袭性质粒抗原基因(ipaH)同时存在于染色体和侵袭性大质粒上,而且是多拷贝分散存在(4~10个),因而从ipaH设计引物建立PCR方法应该有较高的敏感性,并可避免因基因突变、质粒丢失而导致的假阴性。因此ipaH通常作为志贺菌属的鉴定基因[9-10]。
荧光定量PCR广泛的应用于基础医学研究及临床应用中,但由于现有的Taqman探针存在较难纯化、标记的缺陷,且该检测对Taqman自身的要求高,反应时间长,较难满足要求[11-12]。因此通过二聚体蝎形荧光探针技术进行定量检测,有更好的可操作性及准确性。应用蝎形荧光探针进行检测无特异性产物时,淬灭链与报告链杂交,检测不到荧光;当有特异产物时,分子内部的杂交比分子间容易,因此报告链更易与产物连杂交,可检测到荧光[13]。因为整个杂交反应过程是单个分子内部的作用,背景的干扰低,荧光信号易于检测,且检测灵敏度高,便于临床的开展及应用[14]。
可疑粪便标本检测结果显示,本方法灵敏度明显高于利用Taqman技术建立的方法,这是由于此种探针的荧光强度高于TaqMan探针。这种探针具有快循环的特点,我们自行设计探针扩增出的片段长82bp,扩增条件:93℃3min、93℃20s、53℃15 s,并采集荧光信号,经40个循环左右约70min即可得到结果,所需时间较Taqman探针(2h左右)明显缩短。这种探针设计简单,不需要专门软件,合成成本较低,所需的条件和技术水平较低,即使一般的实验室也比较容易开展。
与传统的志贺菌定量检测不同,本研究根据志贺菌中特异的ipaH基因为目的片段,成功的构建质粒,转染入志贺菌属,制备了可供大量使用的标准品。后应用二聚体蝎形荧光探针技术,通过荧光定量PCR法检测志贺菌,以期为志贺菌的快速检测奠定实验基础。通过建立二聚体蝎形探针荧光定量PCR法,检测志贺菌,结果证实该检测法快速灵敏,特异性高,稳定性好,实验结果达到了预期效果,可满足对于志贺菌的早期筛查、确诊需要,今后可在传染病监测等工作方面开展应用。
[1]Sujatha N.Molecular epidemiology of tuberculosis in Indian[J].J Med Res200410233-247.DOI10.1128JCM.40.12.4785-4788.2002
[2]Vrints M,Mairiaux E,Van Meervenne E,etal.Surveillance of antibiotic susceptibility patterns among Shigella sonnei strains isolated in Belgium during the 18-year period 1990to 2007[J].J Clin Microbiol,2009,47(5):1379-1385.DOI:10.1128/JCM.02460-08
[3]Zuker M.Mfold web server for nucleic acid folding and hybridization prediction[J].Nucleic Acids Res,2003,31:3406-3415.DOI:10.1093/nar/gkg595
[4]Dubois V,Parizano MP,Arpin C,etal.High genetic stability of integrons in clinical isolates of Shigellaspp.of worldwide origin[J].Antimicrob Agents Chemother,2007,51(4):1333-1340.DOI:10.1128/AAC.01109-06
[5]Broccolo F,Scarpellini P,Locatelli G,etal.Rapid diagnosis of mycobacterial infections and quantitation of Mycobacterium tuberculosis load by two real-time calibrated PCR assays[J].J Clin Microbio,2003,41:4565-4572.DOI:10.1128/JCM.41.10.4565-4572.2003
[6]Seol SY,Kim YT,Jeong YS,etal.Molecular characterization of antimicrobial resistance in Shigellasonneiisolates in Korea[J].Med Microbiol,2006,55(7):871-877.DOI:10.1099/jmm.0.46441-0
[7]Scoott AN,Menzies D,Tannenbaum TN,etal.Sensitivities and specificities of spoligotyping and mycobacterial interspersed repetitive unit-variable-number tandem repeat typing methods for studying molecular epidemiology of tuberculosis[J].J Clin Microbio,2005,43:89-94.DOI:10.1128/JCM.43.1.89-94.2005
[8]Bangtrakulnonth A,Vieira AR,Lo Fo Wong DM,etal.Shigellafrom humans in Thailand during 1993to 2006:spatial-time trends in species and serotype distribution[J].Foodborne Pathog Dis200856774-784.DOI10.1089fpd.2008.0109
[9]Vcnkatesan MM,Buysse JM,Kopecko DJ.Use of Shigella ftexneri ipaC and ipaH gene sequences for the general identification of Shigella spp.and enteroinvasive Escherichia coli[J].J Clin Microbiol,1989,27(12):2687-2691.
[10]Vargas M,Gascon J,Jimenez De Anta MT,etal.Prevalence of Shigella enterotoxins 1and 2among Shigella strains isolated from patients with traveler s diarrhea[J].J Clin Microbiol,1999,37(11):3608-3611.
[11]Mamishi S,Mashoori N,Mahboobi N,etal.Increasing resistance to nalidixic acid in Shigella subgroups in a comparative study between 2001-2003and 2004-2006[J].Singapore Med J,2009,50(8):791-793.
[12]Nagano Y,Nagano N,Wachino J,etal.Novel chimeric betalactamase CTX-M-64,a hybrid of CTX-M-15-like and CTX-M-14beta-lactamases,found in a Shigella sonnei strain resistant to various oxyimino-cephalosporins,including ceftazidime[J].Antimicrob Agents Chemother,2009,53(1):69-74.DOI:10.1128/AAC.00227-08
[13]Piddock LJ.Clinically relevant chromosomally encoded multidrug resistance efflux pumps in bacteria[J].Clin Microbiol Rev,2006,19(2):382-402.DOI:10.1128/CMR.19.2.382-402.2006
[14]Mu RR,Zhu FR,Duan GC,etal.The expression analysis of drug effiux gene emrE mRNA in Shigella spp.by real-time RTPCR[J].Chin Agr Sci Bull,2011,27(21):221-224.(in Chinese)穆瑞瑞,朱凤荣,段广才,等.实时荧光定量RT-PCR法对志贺菌外排泵基因emrE的表达分析 [J].中国农学通报,2011,27(21):221-224.
