猪IL-18在酵母中表达及活性检测
2013-09-23曹素芳祁画丽
曹素芳,祁画丽
(郑州牧业工程高等专科学校,河南 郑州450011)
白细胞介素18(interleukin-18,IL-18)是一种多功能细胞因子,既参与天然免疫应答,又参与特异性免疫应答[1]。不但能够诱导T细胞和NK细胞产生IFN-γ,增强T细胞和NK细胞的细胞毒作用等功能,而且能够诱导分泌GM-CSF[2]。许多研究表明,IL-18具有显著的免疫佐剂作用,在增强免疫、抗肿瘤、抗病原微生物感染等[3]方面有着潜在的应用前景。近年来,Yohsuke Ogawa等[4]利用猪红斑丹毒丝菌表达了猪IL-18,Shao PanFeng等[5]利用真核表达系统对猪IL-18进行了表达及生物活性研究,牛伟等[6]构建了PRRSV ORF6与猪IL-18的共表达真核质粒,并对猪IL-18的免疫作用进行了研究,王振亚等[7]利用杆状病毒/
昆虫系统对猪IL-18进行了表达。猪IL-18克隆、表达及生物学活性的研究,为猪病的防控及免疫佐剂研究提供了有力的理论依据。
本研究应用酵母表达系统,对猪IL-18进行高效表达,分析其生物学活性,为进一步研究其功能及与其他细胞因子之间的关系奠定基础,有助于将其开发为新的分子免疫佐剂。
1 材料与方法
1.1 菌株与载体 大肠杆菌DH5α为笔者所在实验室保存,pGEMT/pIL-18重组质粒由笔者构建保存,酵母菌株PichiapastorisX-33、载体pPICZαA均由韩先干博士提供。
1.2 酶及试剂 限制性内切酶EcoRⅠ,XbaⅠ,SacⅠ,DL-2 000DNA Marker,低分子量蛋白质Marker,Agarose Gel DNA Extraction Kit,均购自TaKaRa公司;T4DNA连接酶,购自Promega公司;酵母DNA抽提试剂盒PUREGENE DNA Iso-lafion Kit,购自深圳晶美生物工程公司;酵母氮碱YNB和抗生素Zeocin,购自Invitrogen公司;酵母培养基YPD、BMGY和BMMY等的配制参照Invitrogen公司 Easy Select Piehia Expr-ession Kit的方法进行。
1.3 引物设计与合成 根据已获得的猪IL-18全基因序列,在其成熟蛋白[猪前体在IL-1β转换酶(ICE)的作用下,去除信号肽序列,才能变为有活性的蛋白]编码基因两端合成1对引物。上游引物5′-CCGGAATT CTACTTTGGTAAG CTTG-3′,下游引物为5′-TGCTCTAGACT AGTTCTTGTTTTGAA-3′;同时设计根据pPICZαA的通用引物序列合成1对检测引物:5′AOX1:5′-GACTGGTT CCAATT GACA AG C-3′;3′AOX1:′-GCAA ATGGCATTCT GACA TCC-3′。两对引物均由宝生物工程(大连)有限公司合成。
1.4 猪IL-18基因毕赤酵母表达载体的构建 以pGEMT/pIL-18为模板扩增猪IL-18成熟蛋白基因,PCR产物用回收后,用EcoRⅠ和XbaⅠ双酶切,回收约474bp大小的DNA片段,将其插入到毕赤酵母分泌表达质粒pPIZαA相应位点中,构建了重组质粒pPICZ/pIL-18,转化大肠杆菌 DH5α,用25μg/mL的抗生素Zeocin筛选重组大肠杆菌,提取质粒,用限制性内切酶EoRⅠ和XbaⅠ进行双酶切鉴定,并送TaKaRa公司测序。
1.5 毕赤酵母的转化与鉴定 取5~10μg重组表达质粒pPICZ/IL-18,经SacI酶切线性化后,回收,电击转化毕赤酵母X-33,在500μg/mL Zeocin YPDS平板上筛选高拷贝转化子,30℃培养平板2~3d至出现乳白色的菌落。用试剂盒PURE-GEN DNA Isolation Kit抽提毕赤酵母染色体DNA,以抽提的DNA为模板进行PCR鉴定。
1.6 猪IL-18的诱导表达及纯化 将鉴定为阳性的酵母菌接种于YPD液体培养基中,30℃260r/min进行振荡培养16h,按5%比例将菌液转接于10mL BMGY培养基中,30℃振荡培养至菌体D600nm达到2~6时,离心弃上清,更换10mL BMMY培养基,用甲醇诱导培养5d,使其终浓度为0.5%,期间每24h取样并同时加入甲醇,收集上清进行SDS-PAGE,并用凝胶成像系统扫描分析表达产物。
将表达酵母菌进行扩大培养,收集表达上清,用丙酮沉淀法浓缩。将预处理的Sephadex G-200装柱后,用0.01moL/L的PBS进行平衡,加入1mL收集上清,用相同的缓冲液进行洗脱,流速为0.5 mL/min,收集不同时段的蛋白组分。
1.7 表达的猪IL-18(pIL-18)活性检测 无菌采集健康猪抗凝血,沿管壁轻轻加入等体积的淋巴细胞分层液面上,2 000r/min离心15min,小心收集中间的白色细胞层,转入另一离心管中,加入0.5mL的PBS,混匀,8 000r/min离心1min,去上清,再用PBS洗涤2次,最后将细胞重悬于完全培养基DMED中,将细胞稀释成密度为2×106/mL的细胞悬液。
取100μL单细胞悬液于96孔培养板内,设4组,每组设10个重复孔,同时设不含细胞的培养液空白对照。除空白对照组外,另4组分别加入100 μL纯化pIL-18、未纯化pIL-18、LPS及 ConA,于37℃5%CO2培养箱中培养72h,用MTT法检测。采用SPSS软件对获得的数据进行处理。
2 结果
2.1 重组质粒pPICZ/pIL-18的构建与鉴定 重组质粒pPICZ/pIL-18经用目的基因引物PCR扩增获得了约474bp的目的片段(图1);用通用引物进行PCR鉴定,得到1条约1.0kb的条带(图2);重组质粒分别用EcoRⅠ、XbaⅠ单酶切,均得到1条约4.1kb的条带;用EcoRⅠ和XbaⅠ双酶切,得到1条3.6kb和1条0.5kb的条带,均与预期相符(图3)。重组质粒测序的结果也与已知序列相符(数据略)。
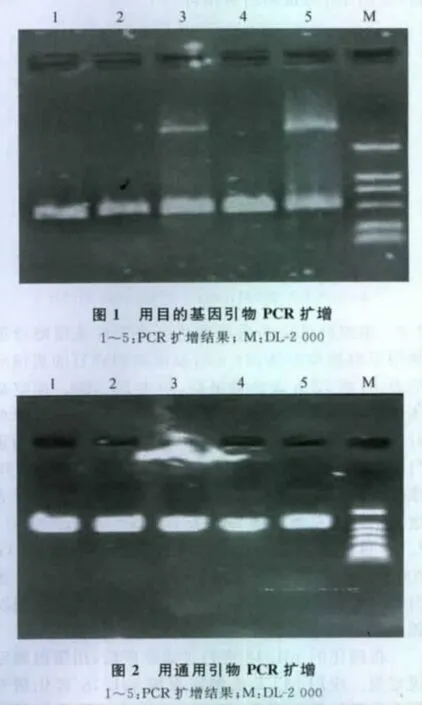
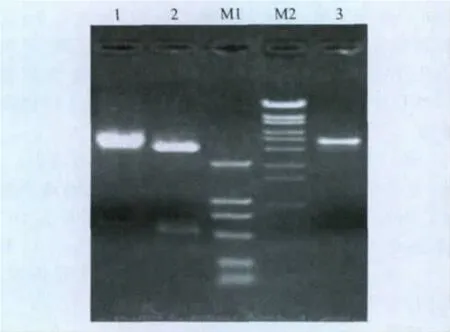
图3 pPICZ/pIL-18酶切鉴定结果
2.2 重组三元猪IL-18基因酵母菌株的鉴定 将阳性酵母表达质粒pPICZ/pIL-18用SacⅠ线性化后,电转化酵母X-33感受态细胞,筛选整合了猪IL-18基因的酵母。提取酵母基因组DNA,以此DNA为模板,利用毕赤酵母载体pPICZαA通用引物进行PCR鉴定,获得了2.2kb和约1.0kb两条带(见图4),与预期结果相符。
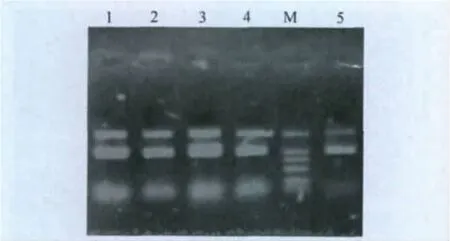
图4 重组酵母菌株的PCR鉴定
2.3 重组酵母菌的诱导表达 将阳性重组酵母菌株用甲醇诱导表达,24h后就能检测到目的蛋白质的表达,到72h表达量最高,约为22kDa。而空载体pPICZαA转化的酵母菌株诱导上清和阴性酵母对照菌株诱导上清液中在相应位置均未出现目的蛋白条带(如图5),表达上清中其他杂蛋白很少。电泳凝胶的扫描分析显示,目的蛋白约占酵母诱导表达上清液中总蛋白的38%左右。
2.4 目的蛋白质pIL-18纯化 利用Sephadex G-200对表达的菌液上清进行分离纯化,收集两个蛋白峰的组分,浓缩后进行SDS-PAGE分析,发现洗脱出的目的蛋白比较纯,几乎没有杂蛋白(图6)。
将纯化的pIL-18进行过滤除菌后,用蛋白测定仪定量。应用MTT法测定重组pIL-18转化猪外周血淋巴细胞的活性,用SPSS统计软件分析结果表明,纯化的重组蛋白pIL-18与丝裂原ConA均能显著促进猪外周血淋巴细胞的增殖 (P<0.05),二者间没有显著差异。未纯化的重组蛋白pIL-18与LPS也均能促进猪外周血淋巴细胞的增殖 (P<0.05),二者间没有显著差异,但与纯化后的重组pIL-18和ConA促进作用差异显著(表2)。

表1 猪IL-18重组蛋白促进猪淋巴细胞转化
3 讨论
干猪IL-18是一类重要的细胞因子,具有免疫调节、抗感染及抗肿瘤等多种生物学活性。除诱导产生IFN-γ外,还与许多细胞因子相互作用,参与体内复杂的免疫应答,在机体免疫应答中发挥着重要的免疫调节作用[8]。近年来研究表明,IL-18主要免疫调节作用表现为显著活化T细胞,促进其产生IFN-γ、IL-2及 GM-CSF 等多种细胞因子,增强细胞毒性T细胞(TCL)及NK细胞杀伤活性,促进NK细胞肿瘤坏死因子(TNF)、IL-1、胞间粘附分子(ICMA-1)等表达[9-10],清除被病原感染的细胞,提高机体免疫功能。而猪IL-18前体蛋白无任何生物活性,在第35位天冬氨酸残基处有一个潜在的剪切位点ICE(白细胞介素1β转换剪切酶位点),剪切后变为具有生物活性的猪IL-18成熟蛋白[11]。
为了获得高表达的阳性酵母菌株,在本试验中,设计引物时我们将个别碱基置换成酵母系统偏爱的密码子,但其编码的氨基酸不变,以期获得高分泌的酵母菌株。阳性表达质粒pPICZ/pIL-18经SacⅠ线性化后,电转化毕赤酵母感受态细胞,经甲醇(终浓度含0.5%体积)诱导72h后,SDS-PAGE电泳显示,得到1条分子量约为22.0kDa的蛋白条带,与猪IL-18大小一致。其表达的可溶性蛋白约占酵母表达上清液中总蛋白的38%。结果表明,改造后的猪IL-18成熟蛋白基因在毕赤酵母X-33中获得了高效分泌表达,经纯化后得到pIL-18可溶性蛋白。由于本试验所选用的酵母表达载体pPICZαA是一种分泌表达载体,它能够使外源基因在毕赤酵母中表达后分泌到上清液中,并能使表达的外源蛋白pIL-18进行正确的折叠和糖基化修饰,使其具有与天然活性蛋白基本相似的空间结构,因此所获得的重组pIL-18无需变性复性就具有较高的生物学活性。
猪IL-18能促进淋巴细胞增殖。用MTT法检测重组pIL-18对猪淋巴细胞转化,结果表明,pIL-18能够促进猪外周血淋巴细胞的转化,纯化后的重组pIL-18其活性接近ConA的刺激效果,优于LPS的刺激效果。
目前,在养猪业中,许多免疫抑制病毒感染猪后导致严重的免疫抑制或疫苗的免疫失败,给猪传染病的防控带来很大的难度,严重制约着养猪业的发展。应用猪IL-18作为免疫佐剂以提高机体免疫应答水平,充分发挥免疫细胞对病原微生物的清除功能,是解决免疫失败的有效方法。pIL-18重组蛋白的制备和活性检测,为研究其在临床中的应用提供物质支持。
[1] Qiaomei Dai,Yang Li,Fengshan Zhang.Therapeutic effect of low-dose IL-18combined with IL-10on collagen-induced arthritis by down-regulation of inflamma-tory and Th1responses and induction of Th2responses[J].Rheumatol Int,2009,29:615-622.
[2] Hivert M F.Sun Q,Shrader P,etal.Circulating IL-18and the risk of type 2diabetes in women[J].Diabetologia,2009,52:2101-2108.
[3] 方礼禄,陈书明,武文君.鸡白细胞介素18(IL-18)与临床疾病相关性的研究进展[J].青海畜牧兽医杂,2011,41(5):47-48.
[4] Yohsuke Ogawa,Yu Minagawa,Fang Shi,etal.Immunostimulatory Effects of Recombinant Erysipelothrix rhusiopathiae Expressing Porcine Interleukin-18in Mice and Pigs[J].Clinical and vaccine immunology,2012,19(9):1393-1398.
[5] Shao PanFeng,Cui Pei,Zheng LanLan,etal.Construction of eukaryotic expression plasmid of porcine IL-18gene and identification of bioactivity of its expressed protein[J].Northwest A&F University-Natural Science Edition,2009,37(12):85-90.
[6] 牛伟,王中华,王晓莉,等.PRRSV ORF6及IL-18基因重组真核质粒试验免疫研究[J].中国兽医学报,2011,31(12):1691-1694.
[7] 王振亚,王彦彬,陈红英,等.猪IL-18在杆状病毒/昆虫细胞中的表达[J].生物工程学报,2011,27(1):118-123.
[8] Yun Huang,Min Xu,Jie Hong,etal.607C/A polymorphism in the promoter of IL-18gene is associated with 2hpost-loading plasma glucose level in Chinese[J].Endocrine,2010,37:507-512.
[9] Hee Jung Kim,Seok Bean Song,Jung Min Choi,etal.IL-18 Downregulates Collagen Production in HumanDermal Fibroblasts via the ERK Pathway[J].Investigative Dermatology,2010,130:706-715.
[10]Carl F,Fortin,Thornin Ear,Patrick P.McDonald.Autocrine role of endogenous interleukin-18on inflammatory cytokine eneration by human neutrophils[J].FASEB,2009,23(1):194-203.
[11]Ghayur T,Banerjee S,Hugunin M,etal.Caspase-1processes IFN-γ-inducing factor and regulates LPS-induced IFN-γ production[J].Nature,1999,386:619-623.
