猪瘟病毒感染对猪外周血细胞因子转录的影响
2013-09-23范学政朱长康张正兴史兰广宁宜宝郑世军
范学政,陈 锴,徐 璐,朱长康,张正兴,赵 燕,史兰广,郑 然,宁宜宝,王 琴,郑世军
(1.中国农业大学动物医学院,北京 海淀100193;2.中国兽医药品监察所,北京 海淀100081;3.四川农业大学动物医学院,四川 雅安625014)
猪瘟(ClassicalSwineFever,CSF)是由猪瘟病毒(ClassicalSwineFeverVirus,CSFV)引起的猪的高度致死性、接触性传染病,并世界动物卫生组织(OIE)被列为必须报告的疫病之一,在我国被列为一类动物疫病[1]。近年来,猪瘟的流行方式和病症特点已发生了显著变化,出现了所谓非典型性和温和性猪瘟,并造成持续感染[2]。因此猪瘟病毒致病机理的研究,特别是对病毒与宿主互相作用的研究为人们所关注,其中细胞免疫反应相关机制尤为受到重视。CSFV感染巨噬细胞后能够诱导多种细胞因子的表达,并能通过此种方式抑制猪的非特异性免疫并延缓猪的特异性免疫应答,白介素、干扰素及其调控因子和肿瘤坏死因子等抗病毒相关因子在调控过程中起关键作用。为进一步了解CSFV毒株对猪体免疫系统的调节,本试验使用中等致病力CSFV毒株人工感染试验猪后,定期采集猪外周血,提取总RNA运用qRT-PCR技术对免疫相关因子的mRNA转录水平进行分析。
1 材料与方法
1.1 材料
1.1.1 病毒与细胞 CSFV 毒株 HeBHH1/95(TCID50为10-3.5/0.2mL),由中国兽医药品监察所猪瘟参考实验室分离保存,属中等致病力毒株[3]。
1.1.2 试验动物及分组 15头试验猪为三元长白猪,购自河北保定山区,为非免疫猪群,30日龄、体重约7~10kg、健康状况良好、经检测CSFV、BVDV、PRRSV、PCVII、PRV、PPV和FMDV等抗原抗体阴性,试验前隔离观察1周。试验时随机分成感染组和空白对照组。感染组在负压洁净室饲养,对照组在正压洁净室饲养。
1.1.3 荧光定量PCR主要试剂 SYBR®Premix ExTaqTM(Perfect Real Time)试剂盒为TaKaRa公司产品;SuperScriptTMⅢ(200U/μL)反转录酶为Invitrogen公司产品。
1.2 方法
1.2.1 动物感染和样品采集 将15头试验猪饲养至40日龄后,随机挑选5头作为对照组,10头作为感染组,隔离饲养。采用肌肉注射(0.5mL/头)接种HeBHH1/95株进行感染,对照组每头注射0.5 mL细胞培养液。感染后,每天记录体温并观察感染组和对照组试验猪的食欲、体温、粪便、精神状态以及眼睑、结膜和皮肤等部位有无病变特征,并根据Everett等的方法对试验猪进行临床症状打分[4],感染组和对照组分别在 0dpi、1dpi、2dpi、5dpi、7 dpi、9dpi、12dpi、16dpi、20dpi、23dpi、28dpi、30 dpi、35dpi、43dpi采集抗凝血5mL,分离PBMC,对照组做平行处理。
1.2.2 相对定量PCR对各细胞因子基因转录水平进行检测 对1.2.1中分离的PBMC样品进行RNA抽提,抽提的RNA用SuperScriptTMⅢ反转录酶进行cDNA 合成。应用SYBR Premier ExTaqTM试剂盒进行 Real time RT-PCR,以猪β-actin基因作为内参,各因子引物及循环条件按参考文献[5]进行。最后将检测结果进行分组分析。
2 结果
2.1 试验猪的临床症状及体温变化 感染组在感染后1~4dpi,食欲、精神和体况均正常。3dpi后感染组体温上升,开始出现轻微精神轻度沉郁,进食减少。8dpi体温超过40℃,精神沉郁,食量下降。有6头猪持续高烧8~10d后体温快速下降并死亡,期间精神重度沉郁,食欲废止,眼角出血,共济失调,食欲废止,眼角出血,喜卧,步态不稳,全身潮红,在18dpi开始出现试验猪死亡。有4头猪耐过,体温在高烧5~7d后缓慢下降并恢复正常。对照组猪未出现上述临床症状。
从临床打分来看,在5dpi感染组的临床得分开始升高,在21dpi时达到最高峰,耐过猪在21d后临床得分开始下降,死亡猪与耐过猪临床得分详见图1。
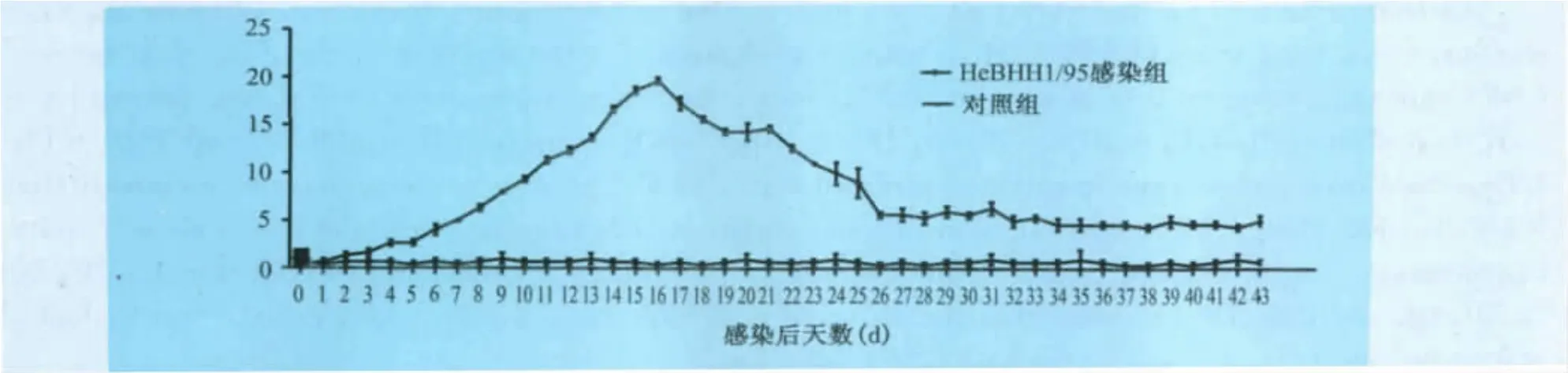
图1 CSFV感染后试验动物临床得分统计
根据试验动物的临床表现,将感染过程分为感染早期(体温升高至40℃,初步出现猪瘟感染典型症状,1~10dpi),症状明显期(食欲不振、共济失调,出现严重猪瘟感染典型症状,约11~20dpi),濒死期(濒临死亡,约20~24dpi)3个时期,将各时期采集的数据(感染早期10头,症状明显期10头,濒死期6头)进行统计分析。
2.2 CSFV感染后外周血PBMC免疫相关因子转录水平检测
2.2.1 干扰素及其调控因子转录水平检测 在感染早期,Ⅰ型干扰素IFN-α,IFN-β转录水平上升显著,RQ值均大于14,IFN-γ转录水平(RQ=1.08)提高幅度低于IFN-α,IFN-β,干扰素调控因子中MxA转录水平显著上升(RQ=230.58),PKR(RQ=0.375)和OAS(RQ=5.47)转录水平虽有提高,但与MxA相比提高并不显著。症状明显期时,IFN-α,IFN-β,IFN-γ转录水平持续提高;干扰素调控因子MxA与感染早期相比转录水平显著降低,与此相反的是PKR的转录水平上升显著;在整个感染过程中,OAS转录改变不大。在濒死期,干扰素及其调控因子转录水平均较症状明显期呈下调趋势(RQ<0),见图2。
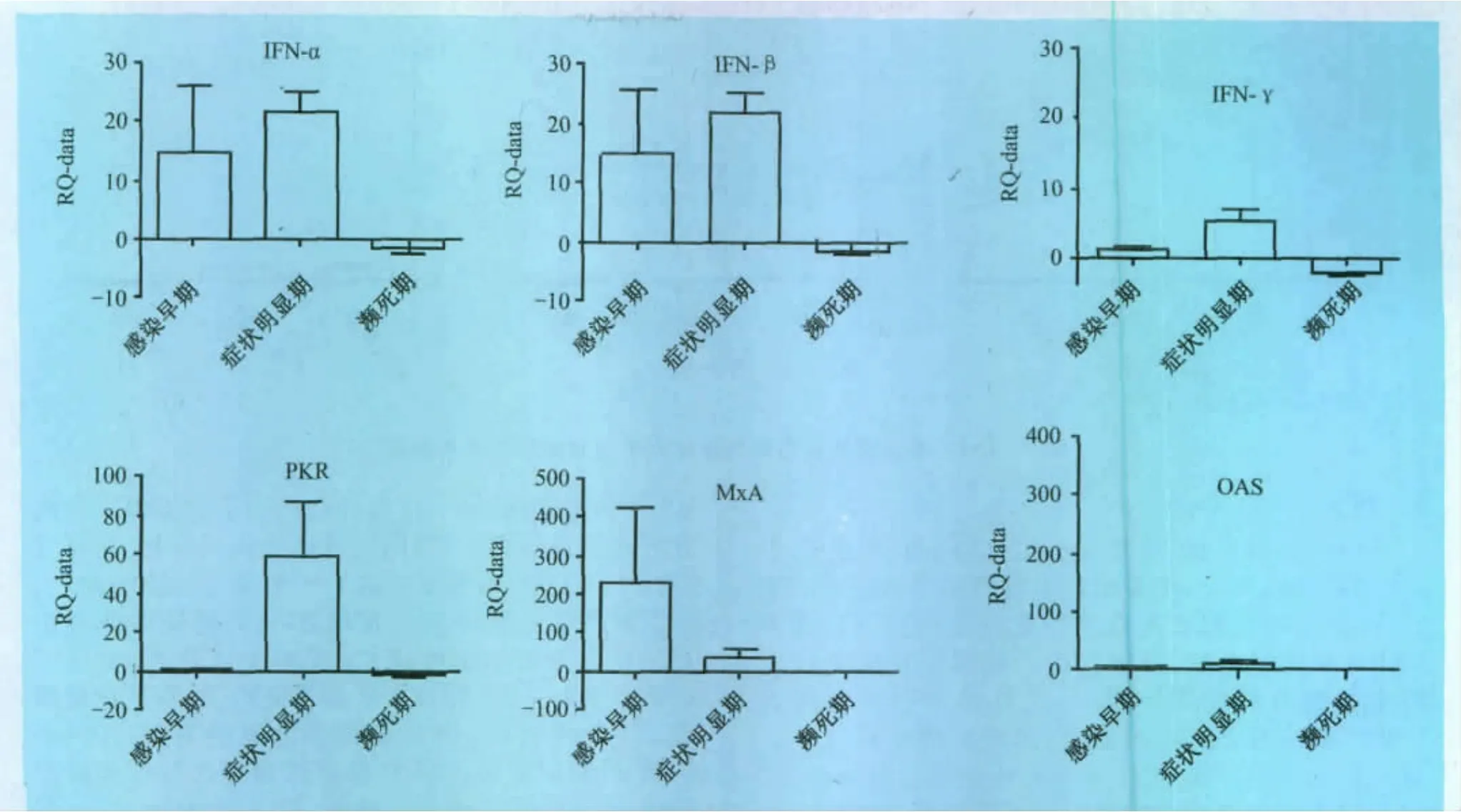
图2 CSFV感染后干扰素及其调控因子变化
2.2.2 白介素类细胞因子转录水平检测 在感染早期,IL-1α(RQ=3.77),IL-1β(RQ=4.03),IL-2(RQ=25.98)、IL-4(RQ=15.86)、IL-8(RQ=4.47)转录水平上升显著,IL-6转录水平并不显著(RQ=0.74);症状明显期是,IL-6(RQ=27.99)转录水平提高显著,IL-1α、IL-2、IL-4、IL-8转录水平持续提高,IL-6转录水平略有下降;在濒死期,除IL-1α,IL-1β外所检测的白介素类细胞因子转录水平均较症状明显期均呈下调趋势(RQ<0),见图3。
2.2.3 其他类细胞因子转录水平检测 在感染早期,肺泡巨噬细胞趋化因子1(RQ=28.45)和肺泡巨噬细胞趋化因子2(RQ=13.16)转录水平显著上升,肿瘤坏死因子(RQ=3.61)转录水平虽有提高但是较肺泡巨噬细胞趋化因子1和肺泡巨噬细胞趋化因子2为低。在症状明显期,肺泡巨噬细胞趋化因子1(RQ=9.08)较感染早期转录水平略有降低,而肺泡巨噬细胞趋化因子2转录水平进一步升高至0dpi的40余倍,TNF维持感染早期转录水平不变。在濒死期,3种细胞因子转录水平均呈下调趋势(RQ<0),见图4。
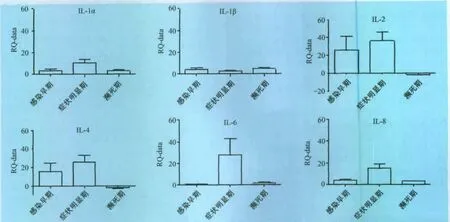
图3 CSFV感染后白介素及其调控因子变化
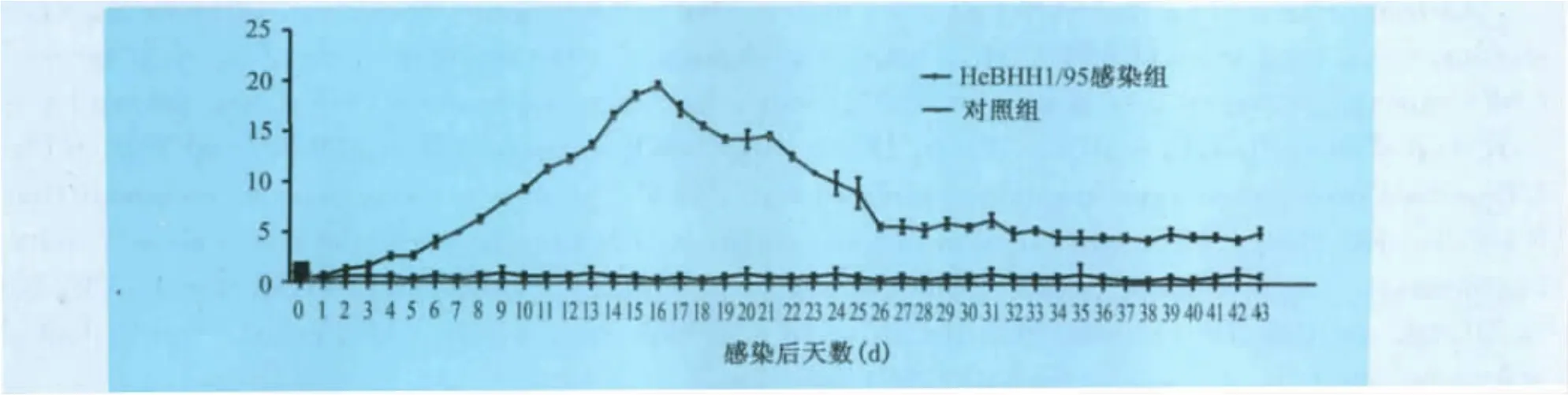
图4 CSFV感染肺泡巨噬细胞趋化因子和肿瘤坏死因子变化
3 讨论
CSFV强致病力毒株感染后能够造成几乎100%的死亡率,而中等致病力毒株感染后造成的死亡率较低,且能损伤免疫系统使得耐过猪可转变为CSFV慢性感染猪,而细胞因子在感染机体免疫应答中起重要的作用。因此,通过使用中等致病力CSFV毒株感染试验用猪,在感染过程中对这些关键的抗病毒基因在mRNA水平上进行定量检测,可以了解野毒感染过程中免疫应答的激发和调控。
机体对CSFV感染进行的免疫应答中,PBMC细胞群体及其分泌的白介素类和干扰素类细胞因子起着重要的作用。干扰素是抗病毒感染中最重要的免疫因子之一,除可以直接限制病毒的复制和扩散外,还具有强大的免疫调节作用,当病毒粒子进入机体并被受体识别后,IFNα/β在细胞内的快速产生,是机体抵御病毒感染的第一道防线。黄病毒科病毒的Npro蛋白是IFNα/β表达的拮抗物,能抑制dsRNA的表达和病毒介导的IFNα/β的表达,缺失了Npro基因的CSFV不能在加入IFNα/β的细胞中复制[6]。在本试验中,在感染早期和症状明显期,IFNα/β转录水平高于IFN-γ,Ⅰ型干扰素通路在抗猪瘟病毒感染中发挥了关键作用。MxA基因在Ⅰ型干扰素(IFN-α/β)或病毒诱导下可表达具广谱抗病毒作用的Mx蛋白,研究中感染早期MxA基因的转录水平提高极其显著,但在症状明显期时转录水平较感染早期为低,而PKR转录水平显著提高,提示在CSFV感染和临床症状的不同阶段干扰素对其作用元件的选择不同,此种改变是宿主与病毒共同作用的结果。
IL-1主要由单核巨噬细胞产生,可剌激B细胞分化和分泌抗体,并刺激T细胞分化及IL-2和IFN-γ的产生,刺激嗜中性粒细胞产生,提高NK细胞杀伤活性,增强机体免疫功能,在炎症和免疫方面起关键递质的作用。IL-6是一种广泛的促炎细胞因子,能直接刺激B细胞分泌IgA,并可通过刺激补体成分引起抗体反应,间接增加IgA分泌[7],同时还促进CTL分化,并协同IL-2增强CTL穿孔素基因的表达并增加T细胞IL-2产生和IL-2受体的表达。IL-6 和 IL-1 能 激 活 内 皮 细 胞 释 放 IL-8 和MCP、表达粘附因子(adhesion molecules),诱导粒细胞进入炎性区域。在包括CSFV在内的单链RNA病毒的感染中,这两种细胞因子均能强有力的介导血管渗透性,并能间接的诱导包括高热、血凝等症状[8]。TNF的重要功能之一是参与细胞的凋亡。本实验室的前期研究中发现,CSFV感染后能够引起外周血免疫细胞的凋亡,在本次试验中,验证了CSFV感染TNF转录水平显著提高,证明了猪瘟病毒、TNF转录水平和细胞凋亡之间的关系,在国外同类 研究中发现,CSFV感染试验猪的脾脏和淋巴结中有同样现象出现。此外,趋化性细胞因子,如AMCF 1,2(肺泡巨噬细胞趋化性因子1,2)和IL-8家族蛋白在体内和体外均是嗜中性粒细胞的化学引诱物,与CXC v因子协同,促进白细胞的再生[9]。
本次试验感染猪在整个试验过程中及剖检后的眼观变化出现了猪瘟病毒亚急性感染的典型症状,通过qRT-PCR对CSFV感染后猪外周血淋巴细胞的11种细胞因子mRNA的转录水平的分析,表明CSFV感染可以导致PBMC细胞分泌的细胞因子mRNA转录水平增高,从而影响机体的细胞免疫应答和体液免疫应答功能。
[1] 一、二、三类动物疫病病种名录,中华人民共和国农业部公告(第1125号)[EB].2008年12月.
[2] 宁宜宝,王琴,赵耘.猪瘟病毒持续感染与猪瘟预防控制[J].中国兽药杂志,2005,39(5):331-335.
[3] 王琴,宁宜宝,赵耘,等.9株猪瘟分离毒株的致病特性[J].中国兽医学报,2007,27(2):145-149.
[4] Everett H,Salguero F J,Graham S P,etal.Characterisation of experimental infections of domestic pigs with genotype 2.1 and 3.3isolates of classical swine fever virus[J].Vet Microbiol,2010,142(1-2):26-33.
[5] Borca M V,Gudmundsdottir I,Fernandez-sainz I J,etal.Patterns of cellular gene expression in swine macrophages infected with highly virulent classical swine fever virus strain Brescia[J].Virus Res,2008,138(1-2):89-96.
[6] Bauhofer O,Summerfield A,Mccullough K C,etal.Role of double-stranded RNA and Npro of classical swine fever virus in the activation of monocyte-derived dendritic cells[J].Virology,2005,343(1):93-105.
[7] Kim J J,Yang J S,Vancott T C,etal.Modulation of antigenspecific humoral responses in rhesus macaques by using cytokine cDNAs as DNA vaccine adjuvants[J].J Virol,2000,74(7):3427-3429.
[8] Storkson R H,Aamodt R,Vetvik K K,etal.mRNA expression of adipocytokines and glucocorticoid-related genes are associated with downregulation of E-cadherin mRNA in colorectal adenocarcinomas[J].Int J Colorectal Dis,2012,27(8):1021-1027.
[9] Meylan E,Tschopp J,Karin M.Intracellular pattern recognition receptors in the host response [J].Nature,2006,442,39-44.
