莲子心总黄酮的大孔吸附树脂纯化及其抑菌活性
2013-09-22曾绍校林志钦许丽宾郑宝东福建农林大学食品科学学院福建福州350002
曾绍校,林志钦,陈 玲,许丽宾,郑宝东(福建农林大学食品科学学院,福建福州350002)
莲子心又名薏、苦薏、莲薏和莲心等,属于睡莲科水生草本植物莲(Nelumbo nucifera Gaertn)成熟种子中的胚根及幼叶.莲子心含有黄酮类物质、生物碱、甾醇、维生素和微量元素等营养成分,使其有降血压、消炎、抗氧化、止血、止渴等功效,具有极高的药理研究价值[1-3].黄酮类化合物具有广泛的生理活性作用,如抗肿瘤、抗炎镇痛、抗氧化及抗菌、抗病毒等作用[4-6],但关于莲子心总黄酮的纯化及抑菌研究尚未见报道.
黄酮类化合物的分离纯化方法主要有溶剂萃取法、柱层析法和高效液相色谱法.柱层析填充材料主要有硅胶、葡聚糖凝胶、聚酰胺和大孔吸附树脂4种.其中,大孔吸附树脂具有吸附效果好、再生简便、使用寿命长等优点,可适用于大量生产[7-8].
本试验在提取研究[9]的基础上,研究大孔树脂纯化的莲子心总黄酮对青霉、根霉、金黄色葡萄球菌、沙门氏菌、大肠杆菌、假单胞杆菌和枯草芽孢杆菌的抑菌作用,并测定其最低抑菌浓度,旨在为莲子心总黄酮的纯化及作为天然防腐剂的开发和利用提供一定的理论依据.
1 材料与方法
1.1 材料
莲子心产自福建建宁.
金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、假单包杆菌(Pseudomonas)由福建师范大学生命科学学院微生物实验室提供;青霉(Penicillium)、根霉(Rhizopus)由福建农林大学食品科学学院微生物实验室提供;沙门氏菌(Salmonella)由福建省疾控中心提供.
平板菌落计数培养基(PDA)由杭州微生物试剂厂出品;15000 U·g-1纤维素酶由中国医药集团上海化学试剂公司出品;芦丁对照品由拓康生物医药科技有限公司出品,纯度≥98%;X-5型大孔吸附树脂由南开大学化工厂出品;氯化钠、葡萄糖等试剂均为分析纯(AR).
主要仪器与设备有101A型数显电热鼓风干燥箱(上海阳光实验仪器有限公司)、L-530型台式低速离心机(湖南湘仪实验室仪器开发有限公司)、UV-2000型紫外可见分光光度计(上海尤尼柯仪器有限公司)、AL104型电子天平(上海梅特勒—托利多仪器有限公司)、PB-10型pH计(北京赛多利斯科学仪器有限公司)、SYQ-DSX-280B型手提式不锈钢压力蒸汽灭菌器(上海申安医疗器械厂).
1.2 莲子心总黄酮的测定
采用姜国芳等[10]的NaNO2-Al(NO3)3比色法测定莲子心总黄酮的含量.根据测定结果,用最小二乘法进行线性回归,得芦丁标准曲线回归方程:Y=0.6174X+0.0011(R2=0.9999).式中,Y为光密度;X/(mg·mL-1)为芦丁标准溶液的含量.
取1 mL莲子心总黄酮提取液,按上述方法进行显色后,根据芦丁标准回归曲线方程计算莲子心总黄酮的含量.
1.3 莲子心总黄酮的制备
干莲子心除去杂质和灰尘,粉碎,过60目筛后,按液料比为19∶1的比例加入50%乙醇,添加0.3%纤维素酶,调节pH至5.5,置60℃恒温水浴锅中酶解2 h,沸水浴灭酶5 min,离心过滤.过滤液经旋转蒸发得莲子心总黄酮粗浓缩液,冷冻干燥后即得莲子心总黄酮样品,备用.
1.4 X-5型大孔吸附树脂的预处理
参考付艳丽等[11]的方法,称取一定量的X-5型大孔吸附树脂(以下简称树脂),分别加入2倍体积的95%乙醇浸泡,至流出液加水(乙醇∶水=1∶5)无白色浑浊现象为止.用蒸馏水洗涤树脂至树脂不含乙醇(无醇味).用5%NaOH和10%HCl分别浸泡2-4 h,用蒸馏水洗至中性,浸在蒸馏水中,备用.
1.5 树脂吸附条件的确定
1.5.1 上样液含量的测定 取已活化的树脂5 mL用蒸馏水冲洗,吸干其表面水分后,装入150 mL的锥形瓶中.加入莲子心总黄酮50 mL,置恒温振荡器上振荡,温度为25℃,振荡速率为120 r·min-1,振荡吸附3 h,取上清液测定莲子心总黄酮的含量.
1.5.2 上样液含量对树脂静态吸附的影响 取 pH 为 6,含量分别为 1.1、2.1、3.1、4.1、5.1、6.1 mg·mL-1的莲子心总黄酮进行树脂静态吸附试验.
1.5.3 上样液 pH 对树脂静态吸附的影响 取含量为5.1 mg·mL-1,pH 分别为3.5、4.5、5.0、5.5、6.0、6.5的莲子心总黄酮,进行树脂静态吸附试验.
1.5.4 上样液流速对树脂动态吸附的影响 取pH为6,含量为5.1 mg·mL-1的莲子心总黄酮,分别以2、3、4 BV·h-1的流速加入装有20 mL树脂的层析柱中进行动态吸附试验.
1.6 树脂解析条件的确定
1.6.1 洗脱剂含量对树脂静态解析的影响 取吸附饱和后的树脂5 mL置于150 mL锥形瓶中,分别加入50 mL去离子水和10%、30%、50%、70%、95%乙醇,置25℃的恒温水浴锅上振荡解析4 h,振荡速率为120 r·min-1,过滤并测定洗脱剂中莲子心总黄酮的含量,以确定最适的洗脱剂含量.
莲子心总黄酮的解析率/%=树脂吸附的莲子心总黄酮量/树脂解析的莲子心总黄酮量×100.
1.6.2 洗脱剂流速对树脂动态解析的影响 取吸附平衡后的树脂20 mL,以50%乙醇为洗脱剂,分别以2、3、4 BV·h-1的流速在层析柱中进行动态解析试验.收集流出液,每10 mL为一份,测定每一份流出液中的莲子心总黄酮含量,以确定最佳的洗脱剂流速和用量.
1.7 莲子心总黄酮抑菌活性的测定
1.7.1 菌种活化及菌悬液的制备 将青霉、根霉、金黄色葡萄球菌、沙门氏菌、大肠杆菌、假单胞杆菌和枯草芽孢杆菌进行活化培养2-3代(细菌用马铃薯葡萄糖琼脂培养基于37℃培养,真菌用平板菌落计数培养基于28℃培养).用无菌生理盐水洗下菌苔制得菌液,配制成含菌数为106cfu·mL-1的菌悬液.
1.7.2 滤纸片法测定莲子心总黄酮的抑菌活性 分别将马铃薯葡萄糖琼脂培养基和平板菌落计数培养基的各个无菌平皿分为4个区域.分别吸取0.20 mL菌悬液至平板上进行涂布培养.参考周玮婧等[12]的方法制备无菌滤纸片.将沾有莲子心总黄酮的小滤纸片分别轻贴于培养基平板的4个区域中心,待干燥后倒置于恒温培养箱中培养.霉菌于28℃培养24 h,细菌于37℃培养24-48 h.去掉滤纸片,测量抑菌直径.
1.7.3 杯碟法测定莲子心总黄酮的抑菌活性 分别将马铃薯葡萄糖琼脂培养基和平板菌落计数培养基的各个无菌平皿分为4个区域.分别吸取0.20 mL菌悬液至平板上进行涂布培养.参考李谷才等[13]的方法制备无菌牛津杯.在涂好供试菌的培养基平板上均匀放置4个无菌牛津杯,分别移入0.1 mL莲子心总黄酮,放置30 min后放入恒温培养箱中培养.霉菌于28℃培养24 h,细菌于37℃培养24-48 h.移去牛津杯,测量抑菌直径.
1.8 莲子心总黄酮最低抑菌浓度的测定
分别用 8、6、4、2、1、0.5、0.25、0 mg·mL莲子心总黄酮配制培养基,待冷却后将细菌涂布于培养基上,于37℃培养24-48 h.观察菌落生长情况,测量抑菌直径以确定莲子心总黄酮的最低抑菌浓度.
2 结果与分析
2.1 树脂吸附条件的确定
2.1.1 上样液含量对树脂静态吸附的影响 由图1可见,上样液含量在一定范围内,树脂的吸附量随上样液含量的增加而增大,但当上样液含量大于5.1 mg·mL-1后,吸附量增加的速度渐缓.故上样液含量以5.1 mg·mL-1较适宜.
2.1.2 上样液pH对树脂静态吸附的影响 由图2可见,莲子心总黄酮在树脂上的吸附量受上样液pH的影响.随上样液pH的增大,树脂对其吸附量的变化整体上呈先上升后下降的趋势.当上样液pH为6时,吸附量最高.
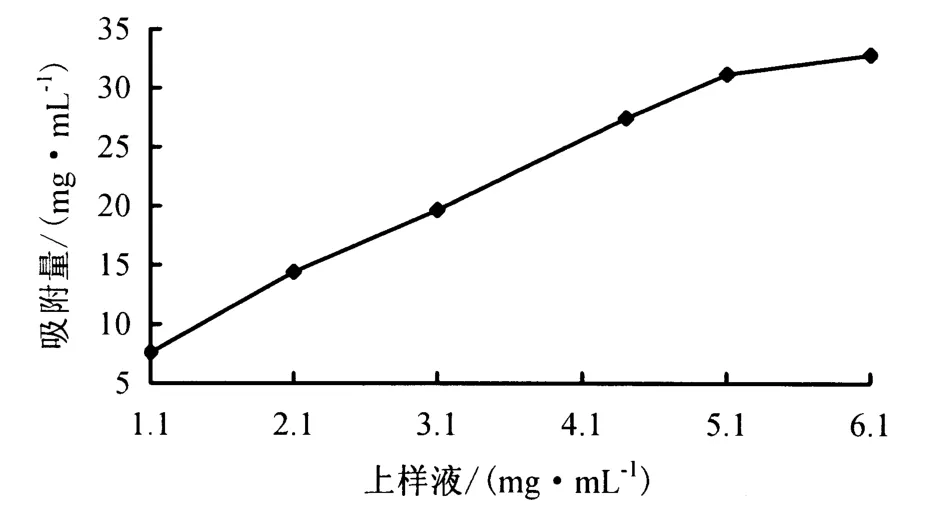
图1 上样液含量对莲子心总黄酮吸附量的影响Fig.1 Influence of sample concentration on adsorption
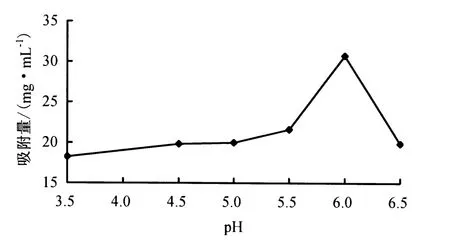
图2 上样液pH对莲子心总黄酮吸附量的影响Fig.2 Influence of sample pH on adsorption
2.1.3 上样液流速对树脂动态吸附的影响 由图3可见,随上样液流速的加快,树脂的吸附量随之减小.这可能是因为上样液流速比较慢时,被吸附的物质与树脂充分接触,从而使树脂的吸附量变大;当流速过快时,被吸附的物质来不及扩散到树脂表面就流失掉,使上样液提早泄漏,导致吸附量下降.综合考虑吸附效果及泄漏点出现的时间,选择上样液流速为2 BV·h-1,上样量为2 BV.
2.2 树脂解析条件的确定
2.2.1 洗脱剂含量对树脂静态解析的影响 由图4可见:蒸馏水和10%乙醇作为洗脱剂时,莲子心总黄酮的解析率较低;50%乙醇的解析率最高(54.03%);乙醇含量超过50%时,解析率反而降低.因此选取50%乙醇为洗脱剂.

图3 上样液流速对莲子心总黄酮吸附量的影响Fig.3 Influence of sample flow rate on adsorption

图4 洗脱剂含量对莲子心总黄酮解析率的影响Fig.4 Influence of eluent concentration on resin resolving
2.2.2 洗脱剂流速对树脂动态解析的影响 由图5可见,洗脱剂在不同的流速下,1-4 BV洗脱剂中的莲子心总黄酮含量较高.合并莲子心总黄酮含量较高的洗脱剂,则不同流速的回收率不同.流速为2、3、4 BV·h-1时,回收率分别为 88.6%、83.6%、69.5%,流速越快,回收率越低.因此确定洗脱剂流速为2 BV·h-1.
2.2.3 莲子心总黄酮纯度的确定 采用最佳的工艺条件对莲子心总黄酮进行初步纯化,获得纯莲子心总黄酮,冷冻干燥后获得粉末状莲子心总黄酮,测定其纯度为50%.

图5 洗脱剂流速对莲子心总黄酮解析量的影响Fig.5 Influence of eluent flow rate on resin resolving
2.3 莲子心总黄酮抑菌活性测定方法的确定
分别采用滤纸片法和杯碟法测定莲子心总黄酮(4 mg·mL-1)的抑菌活性,结果如表1所示.

表1 不同方法测定的莲子心总黄酮抑菌直径Table 1 The antibacterial diameter of flavonoids from lotus plumule by using different measuring methods mm
表1显示,杯碟法和滤纸片法测定的结果表现一致,抑菌活性强弱程度为:沙门氏菌>金黄色葡萄球菌>枯草芽孢杆菌>假单胞杆菌>大肠杆菌.杯碟法的测定结果较滤纸片法明显,因此选用杯碟法测定莲子心总黄酮的抑菌活性.
2.4 莲子心总黄酮的抑菌活性
配制相同含量(4 mg·mL-1)的芦丁和莲子心总黄酮,采用杯碟法测定其抑菌活性,用无菌生理盐水做空白对照,结果如表2所示.

表2 莲子心总黄酮的抑菌直径1)Table 2 The bacteriostasis diameter of flavonoids from lotus plumule mm
表2显示,莲子心总黄酮和芦丁对青霉、根霉均无明显的抑菌作用,而对细菌有明显的抑菌作用,莲子心总黄酮的抑菌活性与芦丁相近.
2.5 莲子心总黄酮的最低抑菌浓度
配制7个不同含量的莲子心总黄酮,观察其对供试细菌的最低抑菌浓度,结果如表3所示.

表3 莲子心总黄酮最低抑菌浓度的测定结果1)Table 3 The lowest bacteriostasis consistence of flavonoids from lotus plumule
表3显示,莲子心总黄酮对沙门氏菌、金黄色葡萄球菌、假单胞杆菌、大肠杆菌、枯草芽孢杆菌的最低抑菌浓度分别为 0.5、1、2、4、4 mg·mL-1.
3 结论
大孔吸附树脂是由聚合单体和交联剂、致孔剂、分散剂等添加剂经聚合反应制备而成的一类有机高聚物吸附剂[14],具有吸附效果好、再生简便、使用寿命长等优点.本试验采用X-5型大孔吸附树脂对莲子心总黄酮进行纯化的最佳工艺为:上样液含量为5 mg·mL-1,上样液pH为6,上样量为2 BV,洗脱剂为4 BV 50%乙醇,洗脱剂流速为2 BV·h-1.经验证,纯化后莲子心总黄酮的纯度可达50%,且条件易满足、成本低、效果明显,可应用于工业生产.
采用杯碟法测定莲子心总黄酮抑菌活性的结果表明,莲子心总黄酮对青霉、根霉两种真菌无明显的抑菌作用,对沙门氏菌、金黄色葡萄球菌、假单胞杆菌、大肠杆菌、枯草芽孢杆菌的最低抑菌浓度分别为0.5、1、2、4、4 mg·mL-1.莲子心总黄酮的抑菌活性与芦丁相近,揭示了其具有一定的生理活性和功能性开发的价值.
[1]孙志国,欧世红.莲子心的研究进展[J].中国现代实用医学杂志,2007,6(3):44-46.
[2]曾建伟,吴锦忠,张书娟.莲子心药学研究进展[J].福建中医学院学报,2005,15(增刊):40-42.
[3]LIN J Y,LAI Y S,LIU C J,et al.Effects of lotus plumule supplementation before and following systemic administration of lipopolysaccharide on the splenocyte responses of BALB/c mice[J].Food and Chemical Toxicology,2007,45(3):486 -493.
[4]王嘉陵,农艺,江明性,等.莲心碱对大鼠血流动力学及兔心房特性的影响[J].药学学报,1992,27(12):881-885.
[5]李晨,姜子涛,李荣.樱桃叶黄酮的微波提取及抗氧化性质的研究[J].中国添加剂,2012(4):103-108.
[6]GIOVANNI A,ELISA A,SUSANNA P,et al.Flavonoids as antioxidants in plants:Location and functional significance[J].Plant Science,2012,196:67 -76.
[7]ZHANG Y,LI S F,WU X W,et al.Macroporous resin adsorption for purification of flavonoids in Houttuynia cordata Thunb.[J].Chiness Journal Chemical Engineering,2007,15(6):872 -876.
[8]LIU Y F,LIN J X,CHEN X F,et al.Preparative separation and purification of lycopene from tomato skins extracts by macroporous absorption resins[J].Food Chemistry,2010,123(4):1027 -1034.
[9]林志钦,彭彬,曾绍校,等.响应面优化酶法提取莲子心中黄酮类化合物[J].中国食品学报,2012,12(3):45-51.
[10]姜国芳,王小东,朱霞萍,等.南瓜茎黄酮及多糖的微波辅助联合提取工艺[J].食品与发酵工业,2009,35(7):171-173.
[11]付艳丽,宋红,童志平,等.大孔吸附树脂分离杭白菊中总黄酮的工艺优选[J].中国实验方剂学杂志,2012,18(17):53-55.
[12]周玮婧,侣国涵,孙智达,等.荔枝皮总黄酮提取及其体外抗菌活性研究[J].天然产物研究与开发,2011,23(2):332-336.
[13]李谷才,魏文亭,高堂杰,等.当归总黄酮提取及其体外抑菌活性研究[J].时珍国医国药,2011,22(2):310-311.
[14]陈丛瑾.大孔吸附树脂分离纯化黄酮类化合物的研究进展[J].化学与生物工程,2010,27(11):1-4.
