三氧化二砷对人肾癌细胞786-O增殖及其PI3K-Akt转导途径的影响
2013-09-21张会清张英杰
朱 峰,张 艳,何 岩,张会清,张英杰
(1.新乡医学院第一附属医院泌尿外科,河南新乡453100;2.新乡医学院基础医学院生理学教研室,河南新乡453001)
肾癌是肿瘤始发于泌尿小管上皮,逐渐进入肾盂、肾盏,甚至输尿管,且主要以血尿、腰痛和腹部肿块等“肾癌三联征”为主要临床特征的一类疾病。肾癌约是成人最常见的肾脏肿瘤。男女比例约为2∶1,可见于各个年龄段,高发年龄50~70岁。三氧化二砷可伤害神经系统、影响毛细血管通透性,对皮肤和黏膜有刺激作用,被认为是最古老的毒物之一。然而该化合物的药用价值最开始被张亭栋揭示出后,科研人员才开始关注它。如今三氧化二砷已经被制成水剂,通过静脉注射给急性早幼粒细胞白血病患者,总缓解率达到90%。且大量研究证实,三氧化二砷可抑制肝癌细胞、食管癌细胞、宫颈癌Hela和人口腔鳞状癌细胞的增殖,对泌尿生殖系统和淋巴系统恶性肿瘤可能有一定抑制作用[1-4]。为了探讨三氧化二砷是否在肾癌中发挥抗癌的效果,本研究选择了人肾癌细胞786-O作为研究模型,从细胞水平初步探讨三氧化二砷对人肾癌细胞786-O增殖的影响,并深入研究其相关信号转导途径,现报道如下。
1 材料与方法
1.1 细胞培养 肾透明细胞癌细胞系786-O从中国科学院典型培养物保藏委员会细胞库购买,目录号TCHu186。将购买的细胞接种于RPMI-1640培养基(10%胎牛血清和50μg/mL青链霉素),5%CO2,培养箱湿度为90%,37℃培养3d。每培养3d传代1次,取对数生长期的细胞进行实验。
1.2 实验分组和设计 将对数生长期的细胞分别接种于96孔板中,并在5%CO2条件下培养。当96孔底部的60%面积贴满细胞后,吸去培养基并更换新的RPMI-1640培养基。5%CO2,37℃继续培养24h。最后将90孔细胞分成对照组和实验组,每组45个孔。加入药物(0.5μM 或1.0μM三氧化二砷)和生理盐水之后分别于0、12、24h取出15个孔细胞,使用BrdU实验检测每孔细胞DNA合成量,使用荧光定量聚合酶链反应(PCR)检测磷酸肌醇3激酶(PI3K)和蛋白激酶B(Akt)相对mRNA表达量,使用免疫印迹法(western blot)检测细胞内PI3K和Akt的相对表达量。
1.3 BrdU掺入实验 参考文献[5]介绍的方法,在收集待测孔细胞进行检测前4h时向每个孔中加入一定量BrdU母液至BrdU终浓度为100mM,5%CO237℃培养。培养结束后,胰酶消化细胞,用磷酸盐缓冲液(PBS)洗脱,1 700r/min离心5min,去上清液,加入10mL 70%EtOH重悬。用洗涤缓冲液(PBS+0.5%IFS)洗涤。离心去上清液,以0.5mL 2M HCl+0.5%IFS,室温孵育20min。加入1mL洗涤缓冲液洗涤细胞。离心去上清液,以0.1M的四硼酸钠(Na2B4O7)重悬细胞,室温孵育2min。用1mL洗涤缓冲液洗涤细胞2次。用50μL洗涤缓冲液重悬细胞,加入anti-BrdU抗体,4℃孵育20min。加入1.5mL洗涤缓冲液洗1次。用50μL洗涤缓冲液重悬细胞,加入用于FITC结合Fc段的抗体,4℃孵育20 min。加入1.5mL洗涤缓冲液洗涤1次。在450nm的波长处读取吸光值,用于定量每个孔内DNA合成量。
1.4 荧光定量聚合酶链反应(RT-PCR) 取出不同时间(0、12、24h)对照组和观察组3个孔的细胞,胰酶消化细胞,用PBS洗脱,1 700r/min离心5min,去上清液,收集细胞。使用TRIzol Reagent试剂盒抽提细胞的总mRNA,并用DEPC水定量至5μg/μL。使用PrimeScript One Step RT-PCR Kit将总mRNA拟转录成cDNA,并定量。特异性引物为GAPDH-F:5′-TGG TGA AGG TCG GTG TGA AC-3′;GAPDH-R:5′-GCT CCT GGA AGA TGG TGA TGG-3′;PI3K-F:5′-TTT CTC ATG GCT GTC CTT CAG-3′,PI3K-R:5′-CAG GAG AAT CTA ACG GAT GC-3′;Akt-F:5′-CAT CAC ATC TGG TTT CCT TGG-3′,Akt-R:5′-AAC TGG AAA TGT AAT TTT GGG-3′,均为上海生工产品。以GAPDH为内参,使用SYBR Green RT-PCR试剂盒和使用伯乐的IQ5PCR系统扩增cDNA中的组织因子基因片段和GAPDH基因片段,反应条件设置为:95℃变性5min,94℃变性30s,57℃退火1min,72℃延伸30s,30个循环,72℃延伸10min。计算每个样品TF和GAPDH的△Ct,并采用△△Ct法计算每个样品中TF的mRNA转录倍数[6]。
1.5 1.5 免疫印迹 取出不同时间(0、12h和24h)对照组和观察组3个孔的细胞,胰酶消化细胞,用PBS洗脱,400×g或1 700r/min离心5min,去上清液,用缓冲溶液[50mmol/L Tris-HCl,pH 7.4,150mmol/L NaCl,1%Nonidet P-40,0.5%去氧胆酸,0.1%十二烷基磺酸钠(SDS),5mmol/L乙二胺四乙酸(EDTA),2mmol/L苯甲基磺酰氟(PMSF),20g/mL抑肽酶,20g/mL亮抑肽酶,10g/mL胃蛋白酶抑制剂 A,150 mmol/L苯甲脒]重悬细胞至5×1010个。抑肽酶破碎后12 000r/min离心20min后取上清液进行电泳。使用5%浓缩胶和15%分离胶进行电泳分离,并使用电转将蛋白转至PVDF膜上。10%牛奶封闭PVDF膜1h,37℃孵育一抗1h,然后PBST清洗3次,每次5min,然后用37°孵育二抗稀释液,并用PBST清洗3次,每次5min。最后用ECL+plusTM免疫印迹系统试剂盒(Amersham,USA)配置显光液,然后使用3490 Photo凝胶成像系统(Epson,Japan)拍照并记录,并用Image Pro PLUS软件分析每个蛋白与GAPDH的相对量。
1.6 统计学处理 采用SPSS19.0软件进行统计学分析。所有连续资料均采用t检验,结果以±s表示。所有离散资料均采用卡方检验,统计结果以χ2表示。以P<0.05为差异有统计学意义。
2 结 果
2.1 三氧化二砷对人肾癌细胞786-O增殖的影响 使用BrdU掺入实验来检测786-O在三氧化二砷(观察组)和PBS(对照组)刺激下DNA合成量,用以评价三氧化二砷对人肾癌细胞786-O增殖的影响。从表1和图1可知,0.5μM和1μM三氧化二砷刺激24h后,观察组DNA合成量显著低于0h时的DNA合成量,差异有统计学意义(P<0.05),从表2和图2可知,0.5μM三氧化二砷刺激24h后且均显著低于0h和12h的对照组DNA合成量,差异有统计学意义(P<0.05)。结果表明0.5μM三氧化二砷刺激24h有效地抑制人肾癌细胞786-O增殖。
表1 不同浓度As2O3对人肾癌细胞786-O增殖的影响(±s)

表1 不同浓度As2O3对人肾癌细胞786-O增殖的影响(±s)
组别 0μM 0.5μM 1μM 1.615±0.275 2.713±0.314 3.014±0.252观察组对照组1.543±0.243 0.824±0.273 0.513±0.214
表2 不同时间As2O3对人肾癌细胞786-O增殖的影响(±s)

表2 不同时间As2O3对人肾癌细胞786-O增殖的影响(±s)
组别0h 12h 24h对照组1.235±0.125 2.463±0.214 3.952±0.418观察组1.275±0.243 0.946±0.153 0.642±0.114

图1 不同浓度As2O3对人肾癌细胞786-O增殖的影响
2.2 三氧化二砷对人肾癌细胞786-O增殖中PI3K和Akt mRNA相对表达量的影响 使用RT-PCR来检测不同时间点(0、12和24h)观察组和对照组细胞内PI3K和Akt mRNA相对的表达量(表3、表4和图3)。结果显示,在0、12和24h时观察组细胞内PI3K和Akt mRNA相对的表达量差异无统计学意义(P>0.05),而对照组细胞内PI3K和Akt mRNA相对的表达量随着细胞增殖加快逐渐升高。说明0.5μM三氧化二砷有效地抑制人肾癌细胞786-O增殖内PI3K和Akt的转录水平。
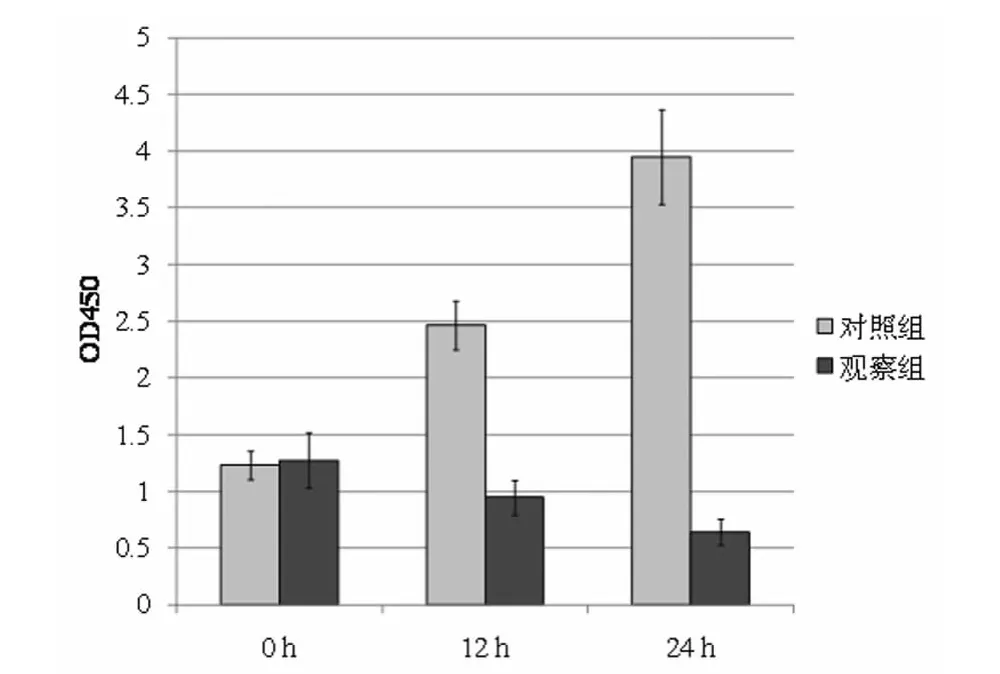
图2 不同时间As2O3对人肾癌细胞786-O增殖的影响

表3 PI3KmRNA的相对GAPDH mRNA的辉度结果

表4 Akt mRNA的相对GAPDH mRNA的辉度结果

图3 As2O3对人肾癌细胞786-O增殖中PI3K和Akt表达的影响

图4 As2O3对人肾癌细胞786-O增殖中PI3K和Akt蛋白表达的影响
2.3 三氧化二砷对人肾癌细胞786-O增殖中PI3K和Akt蛋白表达的影响 使用免疫印迹法来检测不同时间点(0、12和24h)观察组和对照组细胞内PI3K和Akt蛋白的表达量(表5,表6和图4)。在0、12和24h时观察组细胞内PI3K和Akt蛋白的表达量差异无统计学意义(P>0.05),而对照组细胞内PI3K和Akt mRNA相对的表达量随着细胞增殖加快逐渐升高。说明1μM三氧化二砷有效地抑制人肾癌细胞786-O增殖内PI3K和Akt的转录水平。说明0.5μM三氧化二砷有效地抑制人肾癌细胞786-O增殖内PI3K和Akt的蛋白的表达量。

表5 PI3K蛋白表达的辉度结果

表6 Akt蛋白表达的辉度结果
3 讨 论
大量研究均表明了三氧化二砷抑制肿瘤细胞增殖、促进细胞凋亡以及具有显著临床疗效。研究发现三氧化二砷可以抑制诱导宫颈癌细胞凋亡、并通过与cytokeratin 18结合以及下调hTERT mRNA的表达而发挥其作用[7-8]。同样,三氧化二砷可抑制人淋巴细胞系T2的增殖,研究发现它可能通过调控SHP-1启动子以及CpG岛的功能,来干扰正常细胞或肿瘤细胞的增殖[9]。另外三氧化二砷还可抑制肝癌细胞以及早幼粒白血病细胞的增殖,其中,研究最深入的是其在抑制早幼粒白血病细胞增殖、凋亡和死亡的研究[10-11]。而且有很多报道发现了该分子在治疗白血病的临床疗效,例如张德芳等[12]采用全反式视黄酸(ATRA)与三氧化二砷和化疗药物联合方案治疗初诊急性早幼粒细胞白血病,总有效率达到96.9%,且无严重不良反应发生。另外,根据哈尔滨医学院的临床实践,瑞金医院血液科针对早幼粒白血病采用三氧化二砷治疗,并进行了一系列的研究,在国际上首先证实了三氧化二砷的应用可以特异诱导APL细胞凋亡。使得复发难治白血病得了突破,CR率可达到80%~90%,部分患者得以长期生存。从而开启了三氧化二砷用于白血病以及其他肿瘤的基础和临床研究。
虽然如此,但三氧化二砷作为一种剧毒分子,对泌尿系统具有严重的毒性作用,因此,有关三氧化二砷与肾癌的相关研究较少[13]。目前已经清楚的是,0.5~2μM的三氧化二砷可用于治疗早幼粒细胞白血病,且通过静脉注射注入人体后对机体其他器官和系统的损伤较小。因此,本研究选择研究不同剂量三氧化二砷作用不同时间对肾癌细胞的影响,以探讨在最低有效浓度下三氧化二砷治疗肾癌的潜在临床价值。结果表明0.5μM三氧化二砷刺激24h可显著抑制了人肾癌细胞786-O增殖。为了进一步探讨0.5μM三氧化二砷抑制人肾癌细胞786-O增殖的作用机制,本研究选择研究该药物对PI3K-Akt细胞增殖信号转导途径的影响。PI3K-Akt信号转导途径是调控肿瘤细胞增殖的主要信号途径,由于抑制基因PTEN的低表达从而诱导了PI3K的表达,进而促进了Akt分子的表达和磷酸化,从而开启了细胞内蛋白合成和DNA合成途径,以促进肿瘤细胞大量增殖。同样人肾癌细胞786-O的增殖同样受PI3K-Akt信号途径调控。本课题组研究发现0.5μM三氧化二砷在抑制人肾癌细胞786-O细胞增殖的同时,也抑制PI3K的mRNA和蛋白的表达,进而阻碍了Akt的表达。因此,可以得出,PI3K-Akt信号途径参与了三氧化二砷抑制人肾癌细胞增殖的过程,且更明确表明了三氧化二砷在治疗肾癌中的潜在临床价值。
另外,三氧化二砷虽然可通过抑制PI3K-Akt信号途径来发挥抑制人肾癌细胞增殖,但本研究仅在细胞水平进行了研究。有关三氧化二砷对肾癌的临床疗效,还需要通过动物实验进行进一步证实,并要比较不同浓度下三氧化二砷的效果以及对动物泌尿系统的毒性作用。
[1] 苏镇军,郭莉莉,刘晓霞,等.宝藿苷-Ⅰ联合三氧化二砷对食管癌Eca-109细胞增殖的影响[J].现代中西医结合杂志,2012,21(6):593-595.
[2] 吴文娟,邹英华,南月敏,等.三氧化二砷碘油栓塞对兔VX2肝癌凋亡、增殖及肝功能的影响[J].实用放射学杂志,2006,22(1):1-4.
[3] 李红,邵海波,徐克.经导管肝动脉三氧化二砷治疗兔VX2移植性肝肿瘤[J].中国医学影像技术,2009,25(5):878-880.
[4] 耿晓星,全丽娜,马荣,等.三氧化二砷和全反式维甲酸对人宫颈癌 HeLa细胞生长的影响[J].中华肿瘤杂志,2011,33(1):8-12.
[5] Xia H,Diebold D,Nho R,et al.Pathological integrin signaling enhances proliferation of primary lung fibroblasts from patients with idiopathic pulmonary fibrosis[J].J Exp Med,2008,205(7):1659-1672.
[6] Meijerink J,Mandigers C,de Locht LV,et al.A novel method to compensate for different amplification efficiencies between patient DNA samples in quantitative realtime PCR[J].J Mol Diagn,2001,3(2):55-61.
[7] Yu J,Qian H,Li Y,et al.Therapeutic effect of arsenic trioxide(As2O3)on cervical cancer in vitro and in vivo through apoptosis induction[J].Cancer Biol Ther,2007,6(4):580-586.
[8] Zhou C,Boggess JF,Bae-Jump V,et al.Induction of apoptosis and inhibition of telomerase activity by arsenic trioxide As2O3in endometrial carcinoma cells[J].Gynecol Oncol,2007,105(1):218-222.
[9] Yang L,Luo JM,Li Y,et al.As2O3induces demethylation and up-regulates transcription of SHP-1gene in human lymphoma cell line T2cells[J].Zhonghua Zhong Liu Za Zhi,2009,31(6):423-427.
[10]Liu XM,Xiong XF,Song Y,et al.Possible roles of a tumor suppressor gene PIG11in hepatocarcinogenesis and As2O3-induced apoptosis in liver cancer cells[J].J Gastroenterol,2009,44(5):460-469.
[11]Noh EK,Kim H,Park MJ,et al.Gefitinib enhances arsenic trioxide(As2O3)-induced differentiation of acute promyelocytic leukemia cell line[J].Leuk Res,2010,34(11):1501-1505.
[12]张德芳,赵洪国.ATRA与三氧化二砷合并化疗药物治疗急性早幼粒细胞白血病患者的效果[J].齐鲁医学杂志,2010,25(1):18-20,23.
[13]王德林,米粲,陈在贤,等.三氧化二砷抑制人肾癌786-0细胞血管生成及浸润转移机制的初步研究[J].重庆医科大学学报,2007,32(2):134-137.
