非洲马瘟病毒实时荧光定量RT-PCR 检测方法的建立
2013-09-21赵文华杨仕标李富祥
赵文华,杨仕标,李富祥
(云南省畜牧兽医科学院 国家外来动物疫病诊断实验室 云南省热带亚热带动物病毒病重点实验室,云南昆明650224)
非洲马瘟(African horse sickness,AHS)是由呼肠病毒科(Reoviridae)环状病毒属(Orbivirus)的非洲马瘟病毒(AHSV)引起的感染所有马科动物的一种非接触性病毒性传染病。本病以呼吸系统和循环系统的病理变化为特征,目前发现至少有2种库蠓属昆虫可传播该病,至少存在9个血清型。AHS在非洲的撒哈拉地区呈地方性流行,也曾在非洲北部、中东、欧洲发生,该病的发生呈季节性。易感动物感染后的病死率最高可达95%,一旦暴发会给养马业造成巨大的经济损失,因此世界动物卫生组织(OIE)将其列为必须通报的动物疫病,我国将其列为一类动物疫病[1-2]。
鉴于该病的严重性和对养马业的毁灭性打击,在国家及国际间流动的马匹必须要进行严格的动物检疫,尤其是在地方流行区及无该疫病区域之间流动的马匹更应该进行该病的检疫。国际赛马活动的普及以及马胚质资源的流动,边境地区非法走私马匹活动的存在,全球气候变暖引发生态系统改变进而使病原微生物生态变化等,种种因素皆可能造成AHS在非地方流行区域的暴发流行[3]。我国目前虽为AHS无疫区,但随时面临该外来病被引入的风险,因此有必要对该类外来动物疫病进行相应检测、监测技术的贮备。本研究在已建立AHSV群、型特异 RT-PCR 检 测 方 法 的 基 础 上[4-5],选 择 保 守 的VP7蛋白基因S7区段设计一对特异性引物,用实时荧光定量RT-PCR方法对AHSV的快速定性和定量检测。
1 材料与方法
1.1 材料
1.1.1 血清及病毒 AHSV 9个血清型的灭活冻干疫苗均由 Onderstepoort(South Africa)引进,详细情况如表1所示。蓝舌病病毒(Bluetongue virus,BTV)为本实验室保存,鹿流行性出血症病毒(Epizootic hemorrhagic disease virus of deer,EHDV)RNA为云南省出入境检验检疫局提供,冻存的正常马淋巴组织为哈尔滨畜牧兽医科学研究所馈赠。
1.1.2 试剂、耗材及仪器 TaKaRa MiniBest Viral RNA/DNA Extraction kit用于病毒RNA的抽提,One step SYBR Primescript RT-PCR kit 用 于SYBR荧光定量RT-PCR,Goldview核酸染色剂均为宝生物工程(大连)有限公司产品;荧光定量PCR反应管及ABI 7500Fast荧光定量PCR仪为ABI公司产品;Blowest Agarose为上海生工生物工程技术服务有限公司产品;氯仿、异丙醇、无水乙醇等其他试剂均为分析纯试剂。
表1 所引进AHSV 9个血清型情况表Table 1 The status of 9serotypes of AHSV
1.2 方法
1.2.1 引物 根据GenBank及作者所测序列,设计特异性引物对。引物情况如下表2所示,引物由宝生物工程(大连)有限公司合成,为HPLC级别。将合成的引物干粉用无RNase酶的PCR级水进行溶解,引物贮存浓度为100pmol/μL,工作浓度为20.0pmol/μL。

表2 SYBR GreenⅠ荧光定量RT-PCR引物Table 2 The primers for SYBR Green I real-time RT-PCR
1.2.2 病毒基因组RNA提取 按照RNA提取试剂盒说明书操作,简述如下:先用灭菌水按要求溶解非洲马瘟灭活疫苗冻干粉,然后取200μL待用。取200μL已制备好的样本,加入1.5mL离心管中,然后加入200μL的Solution A,剧烈振荡混匀后,室温放置5min,再加入75μL的Solution B,混合均匀后,12 000r/min离心5min。将上清液转移到新的2mL收集管中,加入250μL含10mL/L冰乙酸的异丙醇,上下颠倒混匀,然后将上清液转移至安置在另一新的2mL收集管中的吸附柱中,12 000 r/min离心1min,弃滤液。将500μL的Rinse A加入至上述吸附柱中,室温静置1min,12 000 r/min离心1min,弃滤液。再将800μL的Rinse B加入至上述吸附柱中,1 200r/min离心1min,弃滤液,再次进行12 000r/min离心1min。最后将吸附柱安置于一新的1.5mL的离心管上,在吸附柱膜的中央处加入50μL的含20mL/L的RNase Inhibitor的Elution buffer,室温静置3min~5min,然后12 000r/min离心2min洗脱RNA。弃吸附柱,将收集有RNA液体的离心管,贮存于-70℃备用。
1.2.3 荧光定量RT-PCR反应液的配制及反应条件的设置 分别采用未预变性法及预变性法。未预变性法反应液各组分的配制为:2×One step SYBR buffer 10.0μL,Enzyme mix 2 0.8μL,Primer SYBR-2F/2R各0.2μL,RoxⅡ0.4μL,RNA 2.0 μL,H2O 6.4μL。预变性法变性部分反应液配制为:Primer SYBR-2F/2R各0.2μL,RNA 2.0μL,H2O 5.6μL;变性后需再加入的反应成分为:2×One step SYBR buffer 10.0μL,Enzyme mix2 0.8 μL,RoxⅡ0.4μL,H2O 0.8μL。质粒标准品反应液配制为:2×One step SYBR buffer 10.0μL,Enzyme mix 2 0.8μL,Primer SYBR-2F/2R各0.2 μL,RoxⅡ0.4μL,plasmid DNA 1.0μL,H2O 7.4 μL。
未预变性法反应程序为:42℃10min,95℃2 min,然后采用二步法荧光定量PCR反应或者三步法反应,即40×(95℃5s,60℃30s)或者40×(95℃5s,57℃45s,81℃30s),二步法在60℃反应步骤收集荧光信号,三步法在81℃反应步骤收集荧光信号,二者均在60℃~95℃之间做熔解曲线。预变性法反应程序为:先将预变性部分97℃变性6min,立即冰浴3min,然后再加入其他组分按照未预变性法反应程序进行反应。质粒标准品反应按未预变性法进行。
1.2.4 实时荧光定量RT-PCR特异性试验 除对9个血清型的AHSV RNA进行荧光定量检测外,还对同属的BTV、EDHV及正常马组织进行鉴别检测,以验证SYBR Green引物对对AHSV的特异性。
1.2.5 标准曲线的建立及敏感性、重复性试验 10倍系列稀释本实验室已构建好的AHSV 9型pMD-18T-VP7质粒,进行SYBR-2F/2R引物对质粒标准品标准曲线的构建及检测敏感性确定。选取107、106、105、104、103拷贝/μL 的质粒标准品分别重复扩增3次,进行重复性试验。
2 结 果
2.1 普通电泳对RT-PCR扩增结果的检测
RT-PCR结束后,用20g/L琼脂糖凝胶电泳检测扩增情况(图1)。从普通电泳结果可看出引物SYBR-2F/2R仅对9个血清型的AHSV RNA有特异性扩增,扩增片段与预期的184bp片段相符,而对BTV、EDHV、正常马淋巴组织及阴性对照均无扩增。
2.2 荧光定量特异性扩增及熔解曲线分析
经条件优化后,引物对SYBR-2F/2R仅对9个血清型的AHSV RNA有特异曲线出现,而对BTV、EDHV、正常马组织及阴性对照均无荧光信号检出。经反应后做熔解曲线分析,每型AHSV均有单一特异性峰出现,而未检出荧光信号的BTV、EDHV、正常马淋巴组织及阴性对照熔解曲线均为多峰,且较阳性样品Tm值低(图2和图3)。

图1 样本普通PCR扩增电泳图Fig.1 The electrophoresis of routine RT-PCR for samples

图2 样本实时荧光定量RT-PCR特异性荧光扩增Fig.2 Amplification plot of SYBR Green Ⅰ real-time RT-PCR for samples
2.3 SYBR Green I RT-PCR最优反应条件
经多次摸索,最后确定引物对SYBR-2F/2R对AHSV的最佳反应条件为:预变性加三步PCR法,即按方法1.2.3配制好预变性液,97℃6min,后立即将反应管置冰浴中3min,然后再加入按方法1.2.3配制好的其他反应液成分,进行RT-PCR反应。最佳SYBR Green I荧光定量RT-PCR反应条件为:42℃10min,95℃2min,40个循环;95℃5s,57℃45s,81℃30s;最后进行熔解曲线的特异性分析。依据多次反应熔解曲线的结果确定81℃进行荧光信号的收集,而非常规的60℃。这样可有效消除引物二聚体对检测结果的干扰。
2.4 标准曲线的建立及敏感性、重复性试验
以本实验室已经构建好的AHSV血清9型pMD18-T-VP7质粒为标准品,制备108拷贝/μL至101拷贝/μL的10倍系列稀释品,用SYBR-2F/2R引物对标准品按照最优反应条件进行扩增,根据扩增曲线构建标准曲线。反应后熔解曲线显示不同稀释度的标准品均有单一特异峰(图4),熔解温度为82.05℃±0.15℃;待样品浓度降低至接近零时,出现熔解温度低于样品峰的引物二聚体峰。扩增曲线结果显示在107拷贝/μL至103拷贝/μL浓度之间标准品质粒浓度的对数与Ct值之间存在良好的线性关系,标准曲线的方程式为:Y=-3.254 493X+37.112 000,R2=0.994 392,其中 Y为Ct值,X为拷贝数的对数(Log copy number),R2为相关系数,扩增效率可达102.89%(图5)。
敏感性试验结果显示,SYBR-2F/2R引物对样本的检测敏感性为102拷贝/μL(图6);而用引物进行普通PCR检测时检测敏感度仅为103拷贝/μL(图7),实时荧光定量RT-PCR法要较之敏感10倍。选取107、106、105、104、103copies/μL的标准模板以优化的反应条件分别连续扩增3次,结果显示每个梯度的样本重复性很好。检测结果的统计学分析表明,组内重复性试验变异系数均小于2.5%,说明该方法具有较好的重复性与稳定性(表3)。

图3 样本荧光定量RT-PCR熔解曲线Fig.3 Melting curves of SYBR real-time RT-PCR for samples

图4 标准品熔解曲线Fig.4 Melting curves of the standard plasmids

图5 SYBR GreenⅠ 实时荧光定量RT-PCR标准曲线Fig.5 Standard curve of the SYBR GreenⅠreal-time PCR
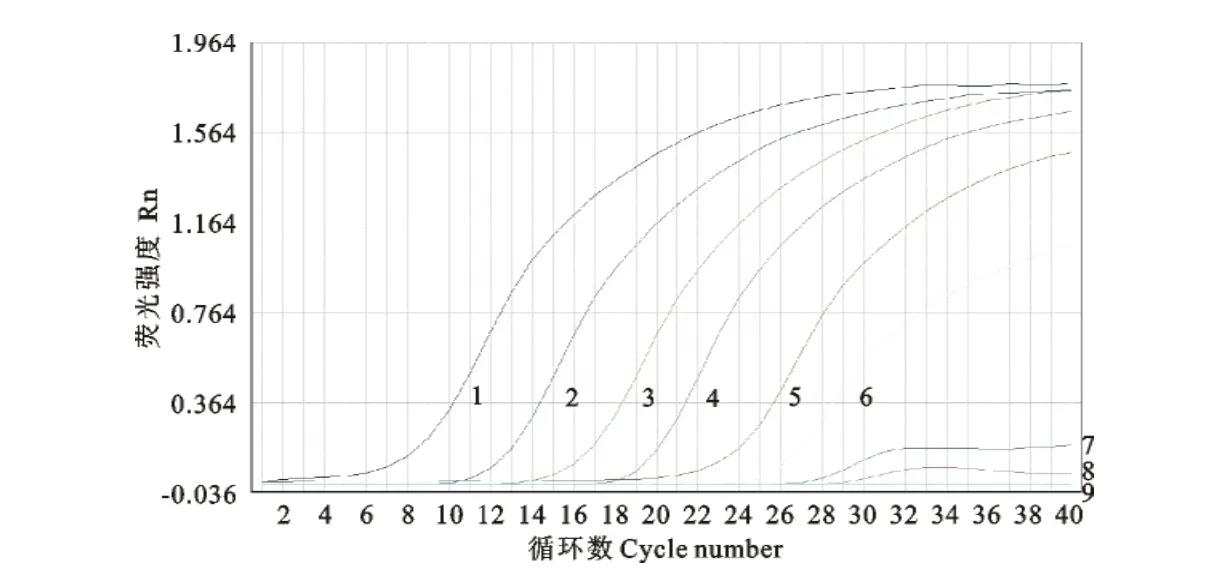
图6 SYBR GreenⅠ 实时荧光定量RT-PCR敏感性扩增曲线Fig.6 Sensitive test of the SYBR real-time PCR
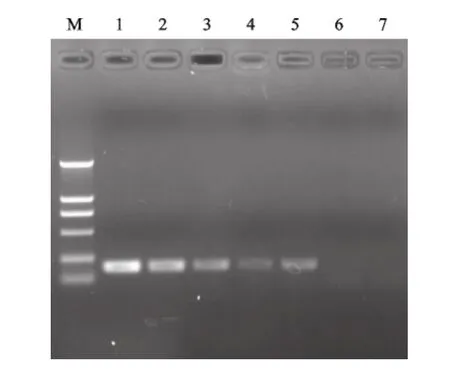
图7 普通PCR敏感性试验Fig.7 Sensitive test of the routine PCR
3 讨 论
目前,AHSV感染主要通过血清学和病毒分离的方式进行诊断、鉴定[6]。血清学在鉴定是否以前存在感染的流行病学方面是很有用的,常用的试验方法有琼脂扩散试验(Agar Gel Immunodiffusion,AGID)、竞争 ELISA(c-ELISA)等。病毒分离和病毒中和试验可最终确定AHSV感染[7]。但上述方法均需花费很长时间,不适于AHSV的快速确诊。而分子生物学诊断技术RT-PCR方法可实现对RNA病毒的快速检测,实时荧光定量RT-PCR(Real-time RT-PCR)则是在常规 RT-PCR方法的基础上发展起来的一种更为敏感、快速的检测方法。本试验是基于AHSV基因组S7片段设计一对特异引物,建立AHSV染料法(SYBR GreenⅠ)实时荧光定量RT-PCR快速检测方法。本研究所建立的方法可对引进的AHSV 9个血清型的灭活疫苗毒RNA进行很好地检测,但尚需大量的临床样本进行验证。鉴于我国目前尚无非洲马瘟的发生,从生物安全方面考虑,不能引进AHSV的病料,若有可能应该前往AHSV地方流行国家和地区进行临床验证。但本研究所建立的方法却不失为应对AHSV外来病挑战的一种有用的技术贮备。
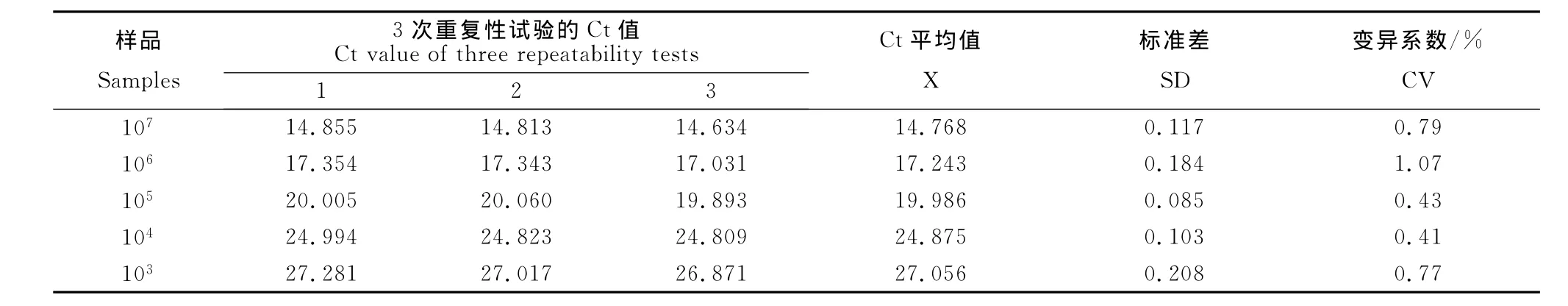
表3 SYBR GreenⅠ 实时荧光定量PCR的重复性试验Table 3 Repeatability test of SYBR Green Ⅰ real-time PCR
SYBR GreenⅠ是一种双链DNA结合染料,能特异性地结合到DNA双链的小沟中。游离的SYBR greenⅠ基本没有荧光信号,但结合双链DNA后,它的荧光信号可成百倍的增加。用SYBR greenⅠ进行实时荧光定量RT-PCR时,只要有合适的引物和模板,即可实现任何目的基因的实时定量。另外,SYBR greenⅠ的价格比较便宜,所以SYBR greenⅠ实时定量RT-PCR是十分值得推荐的技术。但是,SYBR greenⅠ对双链DNA的结合是非特异性的,RT-PCR中的非特异性扩增产物,特别是引物二聚体(Primer-dimers,PDs),也会产生荧光信号并严重干扰对目的基因的测定[8]。
一般情况下,进行荧光PCR反应时,均采用两步法,但就SYBR GreenⅠ而言,因其“特异”性检测荧光信号的缺陷,采用两步法很容易因引物二聚体的干扰而产生假阳性的结果[9]。而根据对反应产物熔解曲线的分析,设定另一高于引物二聚体Tm值而低于特异扩增产物Tm值的温度,进行荧光信号的收集则可有效的消除引物二聚体对正常特异扩增结果的干扰。本试验即采用此方法,通过前期条件的摸索及熔解曲线的分析,最终确定适合所设计引物的“三步法”SYBR GreenⅠ实时定量PCR方法。当然通过三步法,在较高温度进行荧光信号收集时,使引物二聚体解链,可排除非特异干扰,但对正常特异荧光也会有部分的损失。因此,在最开始SYBR引物的设计中,就应该特别注意所设计引物的Tm值,应该尽可能的增大引物二聚体与特异扩增产物之间的Tm值,以利于“三步法”的实施。
[1] OIE.Manual of diagnostic tests and vaccines for terrestrial animals(mammals,birds and bees)[Z].2008:823-838.
[2] Alexander K A,Kat P W,House J,et al.African horse sickness and African carnivores[J].Vet Microbiol,1995,47:133-140.
[3] Sonja M,Janusz T.Preparation of recombinant African horse sickness virus VP7antigen via a simple method and validation of a VP7-based indirect ELISA for the detection of group-specific IgG antibodies in horse sera[J].J Virol Meth,2005,125:55-65.
[4] 赵文华,杨仕标,王金萍,等.非洲马瘟病毒群特异性RT-PCR检测方法的研究[J].生物技术通报,2011(4):204-207.
[5] 赵文华,杨仕标,王金萍,等.非洲马瘟病毒分型RT-PCR检测方法的研究[J].中国农学通报,2012,28(2):43-47.
[6] Rodriguez M,Hooghuis H,Castano M.Current status of the diagnosis and control of African horse sickness[J].Vet Res,1993,24:189-197.
[7] Imadeldin E A.PCR detection of African horse sickness virus serogroup based on genome segment three sequence analysis[J].J Virol Meth,2009,159:1-5.
[8] Bustin S A.Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays[J].J Mol Endocrinol,2000,25(2):169-193.
[9] Vandesompele J,De P A,Speleman F.Elimination of primer dimer artifacts and genomic coamplification using a two-step SYBR green I real-time RT-PCR[J].Anal Biochem,2002,303(1):95-98.
