H7N9亚型AIV双重实时荧光定量RT-PCR 检测方法的建立
2013-09-21罗思思谢芝勋刘加波陈敏玫杨进业
罗思思,谢芝勋*,刘加波,陈敏玫,杨进业,
邓显文1,谢志勤1,庞耀珊1,谢丽基1,范 晴1
(1.广西壮族自治区兽医研究所,广西畜禽疫苗新技术重点实验室,广西南宁530001;2.广西壮族自治区疾病控制中心,广西南宁530028)
禽流感病毒(Avian influenza virus,AIV)属于正黏病毒科A型流感病毒属,根据表面糖蛋白血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)的抗原性差异,AIV可进一步分为不同的亚型,目前已鉴别出16种HA(H1~H16)和9种NA(N1~N9)[1]。AIV 是一种有囊膜、单股负链、分节段的RNA病毒,基因组分为8个节段,分别编码 HA、NA、NP、NS、MP、PA、PB1和PB2蛋白[2]。
由于禽流感病毒基因组分节段的特征,AIV较易发生变异,主要有抗原漂移和抗原转换两种方式。前者由于聚合酶保真性较低,在病毒复制过程中,HA和NA基因有可能逐步发生核苷酸点突变,不断积累可使表面抗原发生显著的变化,产生新的变异株;抗原转换是当两种以上不同亚型的AIV共同感染同一细胞时,不同毒株的8个基因片段通过基因重排,产生新的毒株。变异后的毒株致病性是未知的,有可能突破种间屏障,直接传染给人类,造成的后果无法估量。2009年,甲型H1N1流感的暴发,该H1N1毒株的基因组就是由猪源、人源和禽源等不同来源的片段构成[3]。
自2013年2月以来,上海市、安徽省、江苏省和浙江省等地先后发生不明原因重症肺炎病例。国家卫生和计划生育委员会3月31日通报,上海、安徽发生3人感染H7N9禽流感确诊病例,2例上海患者已死亡。自2002年以来,全球报道的人感染H7亚型AIV病例超过100人,临床表现由结膜炎至轻微的上呼吸道疾病甚至是肺炎[4]。H7N9亚型AIV以往仅在禽间发现,在荷兰、日本及美国等地曾暴发过禽间疫情,但从未发现过人的感染情况。此次人感染H7N9亚型AIV,是全球首次发现的新亚型流感病毒。截至2013年5月29日,全国已确诊H7N9亚型AIV感染131人,其中37人死亡,76人痊愈。
针对以上现状和目前的情势,急需建立H7N9亚型AIV的快速检测方法,多重实时荧光定量PCR已用于多种病原体的鉴别检测[5-6]。本研究设计了专门针对H7N9亚型AIV的引物和探针,建立双重实时荧光定量RT-PCR(Real-time RT-PCR)进行检测,既可确定H7N9亚型AIV感染,也可同时确定是否为单个H7、N9亚型AIV感染。
1 材料与方法
1.1 材料
1.1.1 主要试剂 MiniBEST Viral RNA/DNA Extraction试剂盒、反转录试剂和荧光PCR Premix ExTaq酶为宝生物工程(大连)有限公司产品;胶回收试剂盒为Axygen公司产品;pGEM-T Easy载体为Promaga公司产品。
1.1.2 毒株 AIV(H2N3、H4N5、H5N1、H7N2、H8N4和 H10N3)[6]RNA 由香港大学惠赠;AIV(H1N7和H11N9)由美国宾夕法尼亚大学惠赠;H7N9亚型AIV的阳性RNA由广西壮族自治区疫病控制中心惠赠;AIV(H3N2、H6N6、H9N2)[7-9]、新城疫病毒(NDV)、传染性支气管炎病毒(IBV)和传染性喉气管炎病毒(ILTV)由广西壮族自治区兽医研究所分离保存。
1.2 方法
1.2.1 引物和TaqMan探针的设计 根据Gen-Bank中H7N9亚型AIV HA基因和NA基因的保守序列,参考2013年3月分离的H7N9亚型AIV杭州株A/Hangzhou/1/2013(H7N9)的 HA和 NA序列,分别设计了能检测H7亚型、N9亚型AIV的2对特异性引物和2条TaqMan探针,通过NCBI BLAST验证,保证引物扩增出对应的靶基因,不与其他亚型AIV发生交叉。引物由Invitrogen公司合成(表1)。
1.2.2 RNA的抽提和反转录 按照 MiniBEST Viral RNA/DNA Extraction试剂盒说明书,抽提病毒的RNA,以RNA为模板进行反转录,反应体系如下:5×reverse transcriptase buffer 10μL,50pmol random primer(9mer)1μL,10mmol/L dNTP mixture 2μL,40Uribonuclease inhibitor 0.6μL,5 U/μL AMV reverse transcriptase 1μL,模板 RNA 1pg~1μg,DEPC水补足至50μL,将其反转录成cDNA。

表1 引物信息Table 1 Primer information
1.2.3 双重实时荧光定量PCR反应条件的优化20μL PCR反应体系:2×premixExTaq酶10μL,正、反引物和探针终浓度在 0.1μmol/L~0.8 μmol/L之间调整,cDNA 2μL,以无RNA酶的超纯水补足20μL。双重实时荧光定量PCR各循环参数和引物浓度等进行优化,确定最佳的双重实时荧光定量RT-PCR模式。
1.2.4 双重实时荧光定量PCR特异性试验 将AIV (H7N2、H11N9、H7N9、H1N7、H2N3、H3N2、H4N5、H5N3、H6N6、H8N4、H9N2和 H10N3)、NDV、IBV和ILTV的cDNA/DNA分别加入到双重实时荧光定量RT-PCR反应体系中进行扩增,检测其特异性。
1.2.5 质粒标准品的制备 以H7N9亚型AIV HA基因和NA基因全长引物分别与对应的cDNA模板进行PCR扩增,阳性产物经胶回收纯化后,连接到pGEM-T Easy载体,提取阳性克隆质粒AIVH7和AIV-N9,送至宝生物工程(大连)有限公司进行测序。根据分子质量及浓度计算各质粒的拷贝数。
1.2.6 双重实时荧光定量PCR敏感性试验 把AIV-H7和AIV-N9的质粒,10倍为梯度倍比稀释,同时加入到最佳的PCR反应体系中进行扩增,检验其敏感性。
1.2.7 双重实时荧光定量PCR重复性试验 按照上述反应体系和反应条件进行双重实时荧光定量PCR,模板是H7N9亚型AIV的cDNA阳性样品。分为3个标本同时检测。通过计算Ct值的标准差和变异系数来验证实时荧光定量PCR的批内重复性。在第4天、第7天后重复检测保存于-20℃的模板,来验证模板的稳定性及实时荧光定量PCR的批间重复性。
1.2.8 双重实时荧光定量PCR干扰性试验 将AIV H7和AIV N9质粒标准品按不同的拷贝数进行组合,分别用双重实时荧光定量PCR和单项荧光PCR检测,确定模板浓度相差较大时二者的检测是否存在干扰。
2 结果
2.1 双重实时荧光定量PCR条件的优化
对PCR引物浓度、反应温度、时间及循环次数等进行优化,最后确定双重实时荧光定量RT-PCR中 H7-1、H7-2、N9-1和 N9-2引物对的最佳工作终浓度为0.2μmol/L,H7-3和 N9-3探针最佳工作终浓度分别为0.4μmol/L和0.2μmol/L,PCR的最佳反应模式为,94℃30s,94℃5s,60℃20s,40个循环;最后于40℃结束反应。
2.2 特异性试验结果
应用最佳反应条件,对AIV、NDV、IBV和ILTV核酸进行双重实时荧光定量PCR检测。结果显示(图1),H7N2AIV在FAM荧光通道(530nm激发光下)出现扩增曲线,在ROX荧光通道(610 nm激发光下)为直线,H11N9AIV在FAM荧光通道为直线,而在ROX荧光通道出现扩增曲线,H7N9亚型AIV在FAM和ROX荧光通道均产生扩增曲线,而其他亚型AIV和其他常见呼吸道禽病的病毒在FAM和ROX荧光通道检测均为直线,与试验设计相符。

图1 Real-time RT-PCR特异性试验结果Fig.1 The specificity assay of Real-time RT-PCR
2.3 敏感性试验结果
用所建立的双重实时荧光定量PCR分别检测AIV H7HA质粒和N9NA质粒,结果显示(图2和图3),H7亚型AIV的检测下限为1×101copies/μL,N9亚型AIV的检测下限为1×102copies/μL,因此,H7N9亚型AIV的检测限为1×102copies/μL。

图2 Real-time RT-PCR敏感性试验(FAM 通道)Fig.2 The sensitivity assay of Real-time RT-PCR(FAM channel)
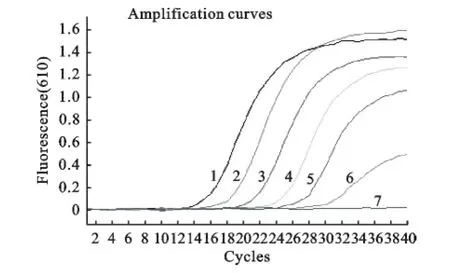
图3 Real-time RT-PCR敏感性试验(ROX通道)Fig.3 The sensitivity assay of Real-time RT-PCR(ROX channel)
2.4 重复性试验结果
在批内重复性试验中,对H7N9亚型AIV cDNA模板进行3次平行双重实时荧光定量PCR,3个平行反应在相应的荧光通道下均获得扩增曲线,H7亚型AIV通道Ct值变异系数为0.8%,N9亚型AIV通道Ct值变异系数为1.0%,对上述模板,以相同反应条件3d和7d后进行批间重复试验,Ct值变异系数均小于3%。结果表明,本研究建立的双重实时荧光定量PCR检测方法的重复性良好,可以满足临床检测的要求(图4)。
2.5 干扰性试验结果
将AIV H7和AIV N9质粒标准品模板按不同浓度进行组合时发现,当一个模板浓度高而另一个模板浓度低时,仍可在不同的荧光通道下分别检测到2个模板,并与单重荧光PCR检测结果无显著差异。

图4 Real-time RT-PCR重复性试验结果Fig.4 The repeatability assay of Real-time RT-PCR
3 讨论
H7N9亚型禽流感是一种新型禽流感,于2013年3月底在上海和安徽两地率先发现,接着陆续在浙江、江苏、河南、北京、台湾、山东、福建等地发现该病毒引起的病例,引起世界的广泛关注。H7N9亚型AIV的发病特征为典型的病毒性肺炎,发病急,病程早期均有高热(38℃以上)、咳嗽等呼吸道感染症状。发病5d~7d出现呼吸困难,重症肺炎并进行性加重,部分病例可迅速发展为急性呼吸窘迫综合征并死亡,至今没有证据确认新型H7N9禽流感病毒能在人与人之间传播[10]。
此次发现的新型H7N9禽流感病毒是由不同亚型AIV通过抗原转换的方式发生基因重排产生的,在8个基因片段中,H7片段来源于浙江鸭群中分离的AIV,并可追溯至东亚地区野鸟中分离的相似病毒;N9片段与东亚地区野鸟中分离的AIV同源;其余6个基因片段(PB2、PB1、PA、NP、M、NS)来源于H9N2AIV,病毒基因组比对和亲缘性分析显示H9N2AIV来源于中国上海、浙江、江苏等地的鸡群[11-12]。
本研究针对H7N9亚型AIV的HA基因和NA基因保守序列,通过Primer Express 3.0软件,设计了多套探针和引物,通过分析其特异性和引物之间的二聚体,筛选出了2套荧光TaqMan探针和引物,构成专门针对H7N9亚型AIV的引物组和探针组。在常规PCR引物的基础上添加了一条标记2个荧光染料基团的核苷酸探针,在双重实时荧光定量PCR反应的退火过程中,探针被水解,报告荧光信号得以释放出来而被仪器检测到,从而达到实时检测的目的。通过优化引物和探针的浓度,得到最佳的反应条件,建立了H7N9亚型AIV双重实时荧光定量RT-PCR检测方法,一管检测既可确定H7N9亚型AIV感染,也可鉴别单个H7亚型或N9亚型AIV感染,且相互间没有干扰,进一步提高了检测的敏感性和特异性。
本研究建立的H7N9亚型AIV双重实时荧光定量RT-PCR检测方法,具有特异性强、敏感性高(是常规PCR的100倍以上)、稳定性好、操作简单和污染环境的机会少(不需要EB染色)等优点,而且整个反应可在30min左右完成,在同一反应体系中,加入2对引物和2条探针,同时检测2个目的基因,一管多检,省时省力。此外,扩增过程可以直接通过电脑实时观察,反应结束便可根据扩增曲线判定结果,结果判定更简便、直观和实用,从而实现对H7N9亚型AIV的快速检测,同时还可确定H7亚型AIV、N9亚型 AIV感染,应用前景广阔,对H7N9禽流感的早期诊断和有效防控具有重要意义。
[1] 庞耀珊,谢芝勋,谢丽基,等.H5N1亚型AIV HA抗原表位的高效表达及其抗原活性分析[J].基因组学与应用生物学,2012,31(2):109-116.
[2] 彭 宜,谢芝勋,郭 捷,等.利用RT-LAMP可视化检测技术检测H1亚型禽流感病毒及N1、N2亚型的分型[J].病毒学报,2013,29(3):154-161.
[3] 顾 敏,赵 国,宋庆庆,等.1株H6N5亚型禽流感病毒A/duck/Yangzhou/013/2008的全基因测序及遗传进化分析[J].畜牧兽医学报,2011,41(4):441-448.
[4] 朱闻斐,高荣保,王大燕,等.H7亚型禽流感病毒概述[J].病毒学报,2013,29(3):245-249.
[5] Xie Z,Xie L,Fan Q,et al.A duplex quantitative real-time PCR assay for the detection of Haplosporidium and Perkinsus species in Shellfish[J].Parasitol Res,2013,112(4):1597-1606.
[6] Xie Z,Pang Y S,Liu J,et al.A multiplex RT-PCR for detection of type a influenza virus and differentiation of avian H5,H7and H9hemagglutinin subtypes[J].Mol Cell Probes,2006,20(3-4):245-249.
[7] Peng Y,Xie Z,Liu J,et al.Visual detection of H3subtybe avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virol J,2011,8:337.
[8] 周辰瑜,谢芝勋,宋 杨,等.H6亚型禽流感病毒RT-LAMP检测方法的建立[J].微生物学通报,2011,38(12):1855-1861.
[9] 谢芝勋,董建宝,唐小飞,等.3株H9N2亚型禽流感病毒广西分离株全基因组序列的测定与分析[J].中国人兽共患病学报,2007,23(9):916-926.
[10] Nishiura H,Mizumoto K,Ejima K.How to interpret the transmissibility of novel influenza A(H7N9):an analysis of initial epidemiological data of human cases from China[J].2013,10:30.
[11] 毛 青.科学认识H7N9,有效防控人感染禽流感病毒[J].第三军医大学学报,2013,35(8):693-695.
[12] Liu D,Shi W,Shi Y,et al.Origin and diversity of novel avian influenza A H7N9viruses causing human infection:phylogenetic,structural,and coalescent analyses[J].Lancet,2013,381(9881):1926-1932.
