猪传染性胃肠炎病毒、猪流行性腹泻病毒和猪博卡病毒多重PCR 检测方法的建立
2013-09-21王凯民张常印雷治海唐泰山
焦 洋,姜 焱,王凯民,张常印,雷治海,唐泰山
(1.南京农业大学动物医学院,江苏南京210095;2.江苏出入境检验检疫局,江苏南京210001)
猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)、猪流行性腹泻病毒(Porcine epidemic diarrhea,PEDV)和猪博卡病毒(Porcine bocavirus,PBoV)都是与猪腹泻相关的肠道病毒。其中由PEDV和TGEV引起的高度接触性腹泻性疾病,其临床症状、病理变化和流行病学极为相似,在临床和组织病理学上很难区分[1]。二者流行病学和病理剖检也极其相似,但两种病原没有共同的抗原性,不能交互免疫,但又能混合感染。
PBoV属于细小病毒科博卡病毒属,为单股线状无囊膜 DNA 病毒,基因组约5 200bp[2]。目前已经证实,多种博卡病毒,包括 HBoV、BPV、CnMV、GBoV能够感染并且导致宿主发生急性腹泻[3-7]。2010 年,Shan T L 等[8]在无临床症 状的猪粪便样品中检测到PBoV的广泛存在,阳性率为63.2%,说明PBoV可以在猪肠道中定殖并散毒。2012年胡军勇等[9]在临床腹泻样品中检测到了PBoV,阳性率高达69.35%,说明PBoV在腹泻猪肠道内广泛存在。目前的数据可以说明,PBoV与猪的腹泻疫情有一定的相关性,但是不能证明PBoV是原发性病原或者对其他猪腹泻病毒的暴发起到协同作用。
由于TGEV、PEDV这两种病毒临床上呈现出相似的症状,经常会发生混合感染,而PBoV又与腹泻疫情相关,为了评估PBoV与TGEV以及PEDV的流行是否有混合感染的现象,对这3种病毒进行了检测。由于临床诊断非常困难,因此必须依靠实验室检测技术进行鉴别诊断。以往的血清学诊断准确率低,病毒分离诊断方法虽然准确,但操作复杂,费时、费力。PCR方法因其具有快速、特异、灵敏、准确等优点,现己经广泛应用于畜禽传染病的快速诊断,目前已有很多文献报道使用单一PCR方法对腹泻病毒进行检测[10-11]。多重PCR技术是在同一PCR体系中加入多对引物,对多个目的基因同时进行扩增的分子生物学诊断方法,具有快速、敏感、特异、易于操作的优点,可用一个样品同时检测多种病原体,达到对多种疾病的同步诊断,缩短检测时间,减少试剂消耗。因此,本文开展了多重PCR检测TGEV、PEDV、PBoV的方法研究,旨在建立同时快速鉴别诊断这3种病毒的方法,并应用于临床实践中。
1 材料与方法
1.1 材料
1.1.1 病毒与病料 TGEV、PEDV细胞毒,大肠埃希菌DH5α,由江苏检验检疫局动检实验室保存。猪博卡病毒阳性病料、猪伪狂犬病病毒(PRV)、猪蓝耳病病毒 (PRRSV)、猪A群轮状病毒(GAR)、猪圆环病毒(PCV),由南京农业大学传染病实验室提供。60份腹泻猪的肠道粪便及组织黏液分别采自江苏省常州、扬州等地的不同规模化猪场。
1.1.2 主要试剂 琼脂糖、胰蛋白胨、酵母提取物、溴化乙锭(EB)、无水乙醇(分析纯)等试剂均购自南京生物工程有限公司;Trizol试剂,PCR试剂(包括反转录酶,核糖核酸酶抑制剂,5×RT buffer,10×PCR buffer,25mmol/L MgCl2、10mmol/L dNTPs和r Taq酶)、DNA标准DL 2 000,pMD18-T载体,限制性内切酶EcoRⅠ、HindⅢ,质粒提取试剂盒,基因组DNA提取试剂盒,购自宝生物工程 (大连)有限公司。
1.1.3 主要仪器 PCR仪5331型,Eppendorf公司产品;核酸电泳仪,BIO-RAD公司产品;全自动凝胶成像系统,英国Syngene公司产品;高速离心机,Thermo公司产品;电子分析天平BP211型,Sartorius公司产品;分光光度计NoNoDROP1000型,Thermo公司产品。
1.2 方法
1.2.1 引物设计与合成 根据GenBank上发表TGEV、PEDV、PBoV基因序列,针对TGEV的S基因、PEDV M基因保守区及PBoV的NP1基因的5′端保守区,各设计一对引物,引物序列为TGEVS1:5′-GTGGTTTTGGTCGTAATGC-3′;TGEVS2:5′-ACACTGTGGCACCCTTACCT-3′,PEDVM1:5′-GTCTAACGGTTCTATTCCC-3′,PEDVM2:5′-TTATAGCCCTCTACAAGC-3′,PBoV -NP1:5′-GCAAGGACATCTCCGAAAC-3′,PBoV -NP2:5′-TGAATGCCAGTGAAACCC-3′。可 特 异扩增出目的条带大小分别为1 060、462、258bp,引物由宝生物工程 (大连)有限公司合成。
1.2.2 病料的处理 用10mmol/L的PBS缓冲液将粪样稀释10倍,在涡旋仪上震荡混匀后,于-70℃反复冻融3次。12 000r/min离心5min,取上清液备用。
1.2.3 RNA与DNA的提取
1.2.3.1 RNA 的提取 取 200μL 样 品 加 入800μL Trizol,剧烈震荡后,室温静置5min;加入200μL氯仿,剧烈震荡,室温静置10min,于4℃12 000r/min离心15min;取上清500μL加入等量异丙醇,混合均匀,室温静置20min,12 000r/min离心15min;弃上清,加入1mL 750mL/L的乙醇,清洗沉淀,12 000r/min离心8min;弃上清,室温干燥2min~5min,加入25μL RNase-free水溶解沉淀,即为所需RNA模板,于-70℃保存备用。
1.2.3.2 DNA的提取 DNA的提取按Takara基因组DNA提取试剂盒说明书提取。
1.2.3.3 反转录合成cDNA 所提取模板RNA 8μL,加入特异下游引物 1μL、dNTP Mixture(10mmol/L each)1μL,混匀后65℃保温5min后迅速在冰上急冷2min。在上述反应液中加入5×PrimeScript buffer 4 μL,RNase Inhibitor(40U/μL)0.5 μL,PrimeScript Reverse Transcriptase 0.5μL,无RNase水5μL,共20μL反应体系。反转录42℃50min。
1.2.4 多重PCR扩增条件的优化 以TGEV、PEDV的cDNA以及PBoV的DNA的混合物作为模板,建立PCR反应体系。采用25μL反应体系:10×PCR buffer 2.5μL,dNTPs 2μL,MgCl22μL,r Taq酶0.5μL,TGEV-S1和 TGEV-S2各0.2μL,PEDV-M1和PEDV-M2各0.3μL,PBoV -NP1和PBoV-NP2各0.3μL,TGEV模板2μL,PEDV模板2μL,PBoV模板2μL,灭菌ddH2O 10.3μL。反应程序为:94℃5min;94℃1min,55℃1min,72℃1min,30个循环;72℃10min。PCR产物经14g/L琼脂糖凝胶电泳检测。
为了摸索不同条件对PCR反应的影响,分别将聚合酶浓度设置在0.02、0.06、0.1、0.14、0.18U 共5个梯度,将dNTPs浓度设置在0.05、0.1、0.2、0.3、0.4mmol/L共5个梯度,MgCl2浓度设置在0.5、1、2、3、4mmol/L共5个梯度进行 PCR 反应,选择最佳反应浓度。退火温度在42℃~62.6℃范围内设置11个梯度。PCR产物经14g/L琼脂糖凝胶电泳检测。
1.2.5 多重PCR方法的特异性试验 以优化的多重PCR 方法对 PEDV、TGEV、GAR、PRRSV 的cDNA模板,PCV、PRV、PBoV 的 DNA 模板及H2O空白进行PCR扩增,检查该方法的特异性。
1.2.6 多重PCR方法的敏感性试验 将TGEV、PEDV的cDNA和PBoV的DNA进行10倍倍比稀释,检测其敏感性。
1.2.7 多重PCR方法的初步应用 采用建立的多重PCR方法对60份来自江苏的送检样品进行检测。
2 结果
2.1 多重PCR聚合酶浓度的确定
在25μL体系中,多重PCR扩增时可使用酶的浓度范围为0.02U~0.18U,最佳浓度为0.1U(图1)。

图1 PEDV、TGEV和PBoV多重PCR最佳酶浓度的确定Fig.1 Determination of optimal DNA enzyme concentrations in PEDV,TGEV and PBoV multiplex PCR
2.2 多重PCR dNTPs浓度的确定
在25μL体系中,多重PCR扩增时dNTPs可使用浓度范围为0.05~0.3mmol/L,最佳浓度为0.2mmol/L(图2)。

图2 PEDV、TGEV和PBoV多重PCR最佳dNTPs的确定Fig.2 Determination of optimal dNTP concentrations in PEDV,TGEV and PBoV multiplex PCR
2.3 多重PCR MgCl2浓度的确定
在25μL体系中,多重PCR扩增时MgCl2浓度在1mmol/L~4mmol/L范围内可扩增出特性条带,但扩增的最佳浓度为2mmol/L(图3)。

图3 PEDV、TGEV和PBoV多重PCR最佳MgCl2浓度的确定Fig.3 Determination of optimal MgCl2concentrations in PEDV,TGEV and PBoV multiplex PCR
2.4 多重PCR退火温度的优化
在42、42.2、43.3、45.2、47.4、50.0、52.8、55.5、58.0、60.1、61.7、62.6℃的退火温度条件下进行多重PCR扩增,结果表明,多重PCR反应退火温度在42℃~62.6℃的范围内都可扩增出特异性条带,而52.8℃时扩增效果最好(图4)。产物扩增片段与预期片段大小相符。
2.5 多重PCR的特异性
采用优化的PCR反应条件,分别对PEDV、TGEV、GAR、PRRSV 的cDNA 模 板,PCV、PRV、PPV、PBoV的DNA模板以及阴性对照进行PCR扩增。结果显示,只有用PEDV、TGEV、PBoV、PEDV、TGEV和PBoV的模板扩增得到特异性扩增产物,而GAR、PRRSV、PCV、PRV及阴性对照未见扩增产物(图5),证明该方法具有良好的特异性。
2.6 多重PCR的敏感性
在优化的PCR反应条件下,TGEV的最高敏感度为35pg,PEDV的最高敏感度为20pg,PBoV的最高敏感度为10pg(图6)。
2.7 多重PCR方法的初步应用
采用建立的多重PCR方法与常规PCR方法对60份临床病料样品进行检测,结果表明,1份TEGV阳性,阳性率为1.6%;4份PEDV阳性,阳性率为6.7%;13份PBoV阳性,阳性率为21.7%(图7)。
3 讨论
本研究建立的TGEV、PEDV、PBoV多重PCR检测方法,特异性强,敏感性高,节省时间,使原本需要3d以上的检测时间缩短为1d,而且节约成本,可以在同一体系中同时检测3种病毒,大大降低了检测成本,为感染的调查研究提供了简便、快速、准确的检测方法,显示出其重要的实际应用价值。试验基于TGEV、PEDV、PBoV的保守基因合成了3对引物,并在同一体系中应用多重PCR技术可以成功扩增出1 060、462、258bp的特异性片段。该多重PCR方法具有良好的特异性、敏感性和重复性。并且试验选择的TGEV的S基因、PEDV的M基因以及PBoV的NP1基因都是各自病毒的保守基因,扩增到这些基因片段能代表被检样品中存在该病毒。
建立多重PCR检测方法的关键是实验条件的优化,即不仅要考虑引物设计和反应条件[12],同时还要注意各个扩增片段的大小,本试验中目的片段均间隔100bp以上,扩增结果显示目的条带在琼脂糖凝胶电泳后易于区分,且无非特异性扩增产物出现。应用本研究建立的方法对60份临床病料进行了检测,检出1份样品为TEGV阳性,阳性率为1.6%;4份为PEDV 阳性,阳性率为6.7%;13份为PBoV阳性,阳性率为21.7%。由于PBoV的阳性率较高,将8份阳性样品的PCR产物送至宝生物工程(大连)有限公司进行测序,利用NCBI中Blast软件对所测序列进行了比对,结果显示,8份样品的PBoV的NP1基因序列与参考毒株(HQ223038.1)的同源性达98%~99%。测序结果进一步证明建立的多重PCR检测方法具有良好的特异性,可用于临床样品检测。这60份临床样品的检测结果还没有发现混合感染的现象,可能PBoV不会加剧TGEV以及PEDV的流行。但是由于目前检测样品数量的限制,还不能确切说明问题,还要进一步进行临床样品的收集与检测。

图4 多重PCR最佳退火温度的确定Fig.4 Determination of optimal Annealing temperature in multiplex PCR

图5 多重PCR特异性试验Fig.5 Specificity assay of multiplex PCR
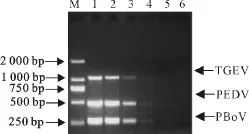
图6 多重PCR敏感性试验Fig.6 Sensitivitity assay of multiplex PCR

图7 部分样品的多重PCR扩增结果Fig7 The multiplex PCR result of clinical sample
[1] Chaec,Kimo,Choc,et al.Prevalence of porcine epidemic diarrhoea virus and transmissible gastroenteritis virus in Korea pigs[J].J Vet Res,2000,147:606-608.
[2] Blomstrõma A L,Belák S,Fossumc C,et al.Detection of a novel porcine boca-like virus in the background of porcine circovirus type 2induced postweaning multisystemic wasting syndrome[J].Virus Res,2009,146(1-2):125-129.
[3] Arthur J L,Higgins G D,Davidson G Pet al.A novel bocavirus associated with acute gastroenteritis in Australian children[J].PLoS Pathog,2009,5(4):e1000391.
[4] Blomstrom A L,Bel K S,Fossum C,et al.Studies of porcine circovirus type 2,porcine boca-like virus and torque teno virus indicate the presence of multiple viral infections in postweaning multisystemic wasting syndrome pigs[J].Virus Res,2010,152(1-2):59-64.
[5] LÜHuang,Zhai Shao-Lun,Cheung A K,et al.Detection of a novel porcine parvovirus,PPV4,in Chinese swine herds[J].Virol J,2010,7:333-338.
[6] Madec F,Rose N,Grasland B,et al.Post-weaning multisystemic wasting syndrome and other PCV2-related problems in pigs:a 12-year experience[J].Transbound Emerg Dis,2008,55(7):273-283.
[7] Meng X J.Emerging and re-emerging swine viruses[J].Transbound Emerg Dis,2012,9(10):1865-1682.
[8] Shan Tong-ling,Lan Dao-liang,Li Lin-lin,et al.Genomic characterization and high prevalence of bocaviruses in swine[J].PLoS One,2011,6(4):e17292.
[9] 胡军勇,张 倩,王丹丹,等.猪博卡病毒PCR检测方法的建立及其初步流行病学调查[J].中国预防兽医学报,2012,34(8):632-636.
[10] 吴 凌,李一经,川志军,等.应用RT-n est ed PCR检测猪流行性腹泻病毒的研究[J].中国兽医科技,2003,33(3):27-29.
[11] 倪艳秀,林继煌,陆承平,等.逆转录聚合酶链反应(RT-PCR)检测轮状病毒[J].中国兽医学报,1998,18(5):437-440.
[12] 宋 宏,粱国栋.多重聚合酶链式反应技术及其应用[J].中华实验和临床病毒学杂志,2003,17(4):380-384.
