热应激对奶山羊瘤胃发酵指标的影响及有机铬对其的调控作用
2013-09-20刘君地齐智利
许 啸 刘君地 李 燕 王 超 余 婕 齐智利
(华中农业大学动物科技学院动物医学院,武汉 430070)
热应激导致畜禽生理机能受损,对生产性能造成巨大影响,因此深入研究热应激的影响机制和如何减少热应激的影响已成为当今畜牧业的研究热点。瘤胃是反刍动物消化的主要场所,其内环境是一个复杂的生态系统,许多报道称热应激可对瘤胃健康产生严重的不利影响[1-3]。研究表明铬是葡萄糖耐受因子(GTF)的组成成分,作为GTF活性成分发挥作用[4],并且有机铬的生物学功效远大于无机铬[5],能有效缓解动物热应激[6-7],特别是吡啶羧酸铬,其结构与GTF类似,可以促进铬的吸收[8]。热应激对奶山羊影响的报道很少,以及吡啶羧酸铬对瘤胃内环境的调控机理尚未明确,为此,本试验旨在研究热应激对奶山羊瘤胃发酵指标的影响以及吡啶羧酸铬对其的调控作用。
1 材料与方法
1.1 试验动物及饲粮
选用4只体重相近[(20.75±1.88)kg]的健康波尔奶山羊,安装永久性瘤胃瘘管。试验饲粮参照NRC(1981)[9]奶山羊饲养标准,并结合我国奶山羊饲养标准(1989)[10]配制,基础饲粮组成及营养水平见表1。
1.2 试验设计及饲养管理
采用自身对照试验设计,分3期试验,分别为对照组、热应激组和加铬组:对照组山羊在空调房中饲喂,处于非热应激状态;热应激组和加铬组山羊在室温动物房中饲喂,处在热应激状态。加铬组饲粮为基础饲粮中添加吡啶羧酸铬(铬含量为0.2 mg/kg饲粮)。每期试验14 d,每天08:00、10:00、12:00、14:00、16:00、18:00 和 20:00 利用温湿度计测定环境温湿指数(THI),THI计算公式如下:THI=0.72(Td+Tw)+40.6,式中:Td表示干球温度,Tw表示湿球温度。试验动物采用单笼饲养,先喂精料后喂粗料,日喂2次(08:00和18:00),自由饮水。

表1 基础饲粮组成及营养水平(风干基础)Table1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.3 样品采集与分析测定
在试验第 13 天的 08:00、10:00、12:00、14:00、16:00、18:00和20:00采集瘤胃液,立即测定瘤胃液pH[PB-10型,赛多利斯科学仪器(北京)有限公司生产]。每次采集20 mL瘤胃液,用4层乳酪纱布过滤。滤液经3 500 r/min离心10 min,取0.5 mL上清液用于测定氨态氮(NH3-N)浓度,方法参照冯宗慈等[11]的方法;另取5 mL上清液移入10 mL试管内,再加入25%的偏磷酸1 mL混匀,放入-20℃冰柜中保存待分析挥发性脂肪酸(volatile fatty acid,VFA)浓度。VFA浓度采用CP-3800气相色谱仪(美国Varian公司生产)测定(检测器:FID;色谱柱:柱长30 m、内径0.32 mm、膜厚0.25 μm的毛细管色谱柱;测定条件:进样口温度250℃,检测器温度300℃,氢气流速40 mL/min,空气流速300 mL/min,尾吹气流速30 mL/min,柱流量1.8 mL/min,进样量1 μL)。
1.4 数据处理
试验数据用平均值±标准差表示,采用SAS 9.1.3统计软件中的ANOVA过程进行Duncan氏法多重比较检验,P<0.05为差异显著。
2 结果与分析
2.1 各试验组THI变化规律
由图1可知,各时间点对照组的THI均在70以下,处于非热应激状态;热应激组和加铬组的THI均达79以上,处于热应激状态。热应激组和加铬组的THI要显著高于对照组(P<0.05),并且热应激组和加铬组的THI无显著差异(P>0.05),说明这2组动物的热应激水平相似。
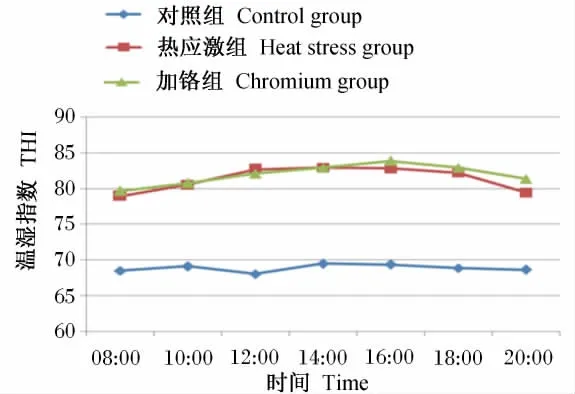
图1 各试验组THI变化规律Fig.1 The THI variation of experimental groups
2.2 各试验组山羊瘤胃pH的变化规律
由表2可知,在试验期08:00各组的瘤胃pH无显著差异(P>0.05),热应激组和加铬组在10:00、12:00、14:00、16:00、18:00、20:00 和全天平均的瘤胃pH均显著低于对照组(P<0.05),而这2组间差异不显著(P>0.05)。2组均显示,瘤胃pH在采食之后下降,在采食4~6 h达到最低,然后再上升,在采食的时候达到最高值。

表2 各试验组山羊瘤胃pHTable2 The rumen pH levels of goats of all experimental groups
2.3 各试验组山羊瘤胃NH3-N浓度变化规律
由表3可知,热应激组和加铬组的全天平均瘤胃NH3-N浓度与对照组相比显著升高(P<0.05),而热应激组与加铬组差异不显著(P>0.05)。在各时间点3组的瘤胃NH3-N浓度差异不显著(P>0.05)。3组数据均显示,瘤胃NH3-N浓度随采食时间呈现先下降再上升的趋势,在采食4~8 h达到最低值。

表3 各试验组山羊瘤胃NH3-N浓度Table3 The rumen NH3-N concentration of goats of all experimental groups 10-2mg/mL
2.4 各试验组山羊瘤胃VFA变化规律
由表4可知,热应激组瘤胃乙酸浓度在10:00和全天平均值显著高于对照组(P<0.05);加铬组瘤胃乙酸浓度在08:00和全天平均值均显著高于对照组和热应激组(P<0.05),在10:00和18:00显著高于对照组(P<0.05);在12:00、14:00、16:00和20:00 3组差异不显著(P>0.05)。热应激组丙酸浓度在 08:00、10:00、14:00、16:00、18:00和全天平均值显著高于对照组(P<0.05);加铬组丙酸浓度在08:00和18:00显著高于对照组(P<0.05),全天平均值显著高于对照组(P<0.05)且显著低于热应激组(P<0.05);3组在12:00和20:00无显著差异(P>0.05)。热应激组瘤胃丁酸浓度在各时间点与对照组均差异不显著(P>0.05);加铬组丁酸浓度在10:00、16:00和全天平均值显著高于其他2组(P<0.05),在08:00显著高于对照组(P<0.05),在18:00和20:00显著高于热应激组(P<0.05);3组在12:00和14:00差异不显著(P>0.05)。热应激组在08:00、10:00和全天平均瘤胃总挥发性脂肪酸(TVFA)浓度显著高于对照组(P<0.05);加铬组在08:00、10:00、18:00和全天平均瘤胃 TVFA浓度显著高于对照组(P<0.05),在08:00的TVFA浓度显著高于其他2组(P<0.05)。热应激组瘤胃乙酸/丙酸(A/P)在16:00、18:00和全天平均值显著低于对照组(P<0.05);加铬组A/P在18:00和全天平均值显著高于热应激组(P<0.05),与对照组差异不显著(P>0.05);3组在08:00、10:00、12:00、14:00 和 20:00 无显著差异(P >0.05)。
3 讨论
3.1 热应激对奶山羊瘤胃pH的影响及吡啶羧酸铬对其的调控作用
瘤胃内pH是食糜中VFA与唾液中缓冲盐相互作用,以及瘤胃上皮对VFA吸收及随食糜流出等因素综合作用的结果。瘤胃内pH作为目前研究瘤胃发酵的主要内环境指标之一,基本上可以反映瘤胃内部的环境状况及饲料在瘤胃内的发酵程度和模式[12]。本试验显示热应激使奶山羊瘤胃pH除08:00外各时间点和全天平均值均显著降低(P <0.05),这与前人的研究[13]相一致,也有研究结果与此结果不尽相同,如有研究报道热应激使奶牛瘤胃液pH较非热应激有所升高(P>0.05)[14]。本试验结果产生的原因可能是奶山羊热应激时,呼吸频率增加,唾液流出增多,导致唾液流入瘤胃量减少,由于唾液中含有缓冲离子HC,所以使瘤胃中HC量不足,导致瘤胃内pH降低,影响瘤胃内环境。本试验显示加入吡啶羧酸铬后对瘤胃pH影响不显著(P>0.05),可能是因为吡啶羧酸铬对缓解唾液的流出作用不显著,或者不能够刺激提高唾液的分泌量。
3.2 热应激对奶山羊瘤胃NH3-N浓度的影响及吡啶羧酸铬对其的调控作用
NH3-N是瘤胃微生物可利用的主要氮源。瘤胃中约有50%的细菌能利用NH3-N作为唯一氮源就可生长[15]。瘤胃NH3-N浓度反映的是饲粮蛋白质的降解程度[16],瘤胃液中 NH3-N浓度过高、过低或释放不均匀都会对瘤胃微生物产生不利影响。据报道,瘤胃最佳NH3-N浓度范围是每100 mL 0.35 ~29.00 mg[17]。本试验显示,3 个试验组奶山羊瘤胃NH3-N浓度范围在每100 mL 4.83~17.68 mg,处于文献报道的最佳浓度范围之内。热应激组和加铬组的全天平均NH3-N浓度显著高于对照组(P<0.05),前人有研究证实热应激可以提高瘤胃内 NH3-N 浓度 (P < 0.05)[3,13],也有与此不同的报道,如温雅俪等[14]研究发现热应激奶牛瘤胃NH3-N浓度极显著降低(P<0.01),可能的原因是热应激导致瘤胃壁对NH3-N的吸收效率降低,但是尚未见有关热应激影响瘤胃NH3-N浓度机制的报道,有待进一步研究。
3.3 热应激对奶山羊瘤胃VFA的影响及吡啶羧酸铬对其的调控作用
本试验表明,热应激可以使奶山羊瘤胃乙酸、丙酸和TVFA浓度显著升高(P<0.05),A/P显著降低(P <0.05),与前人研究结果[18]相一致,也有不同的研究报道,如温雅俪等[14]研究发现热应激使奶牛瘤胃TVFA极显著降低(P<0.01),A/P极显著升高(P<0.01)。可能的原因是热应激使唾液流出量增多,导致进入瘤胃内的唾液减少,由于唾液中含有缓冲离子HCO-3,所以中和VFA的缓冲剂量不足,导致VFA在瘤胃内过量积累,这与本试验结果瘤胃pH显著降低(P<0.05)相一致。本试验表明,吡啶羧酸铬可以显著提高热应激奶山羊瘤胃乙酸、丁酸浓度和A/P(P<0.05),显著降低丙酸浓度(P<0.05),但是对TVFA浓度影响不显著(P>0.05)。也有研究表明,吡啶羧酸铬可以显著提高瘤胃乙酸、丁酸浓度(P <0.05)[19],这说明吡啶羧酸铬可以通过调节瘤胃内微生物菌群,来改变瘤胃内丙酮酸的代谢途径,TVFA浓度差异不显著说明产生的丙酮酸量未发生改变,只是发酵类型改变,但是吡啶羧酸铬影响发酵类型的原理比较复杂,尚未见相关研究报道,有待进一步研究。
4 结论
①热应激可以显著降低瘤胃内pH,显著提高瘤胃内NH3-N、TVFA、乙酸、丙酸浓度,显著降低A/P,影响瘤胃发酵环境。
②饲粮中添加吡啶羧酸铬对热应激奶山羊瘤胃发酵指标有一定的影响,可以显著提高其瘤胃乙酸、丁酸浓度和A/P,显著降低瘤胃丙酸浓度,调节瘤胃发酵类型,对热应激带来的影响具有一定的调节作用。
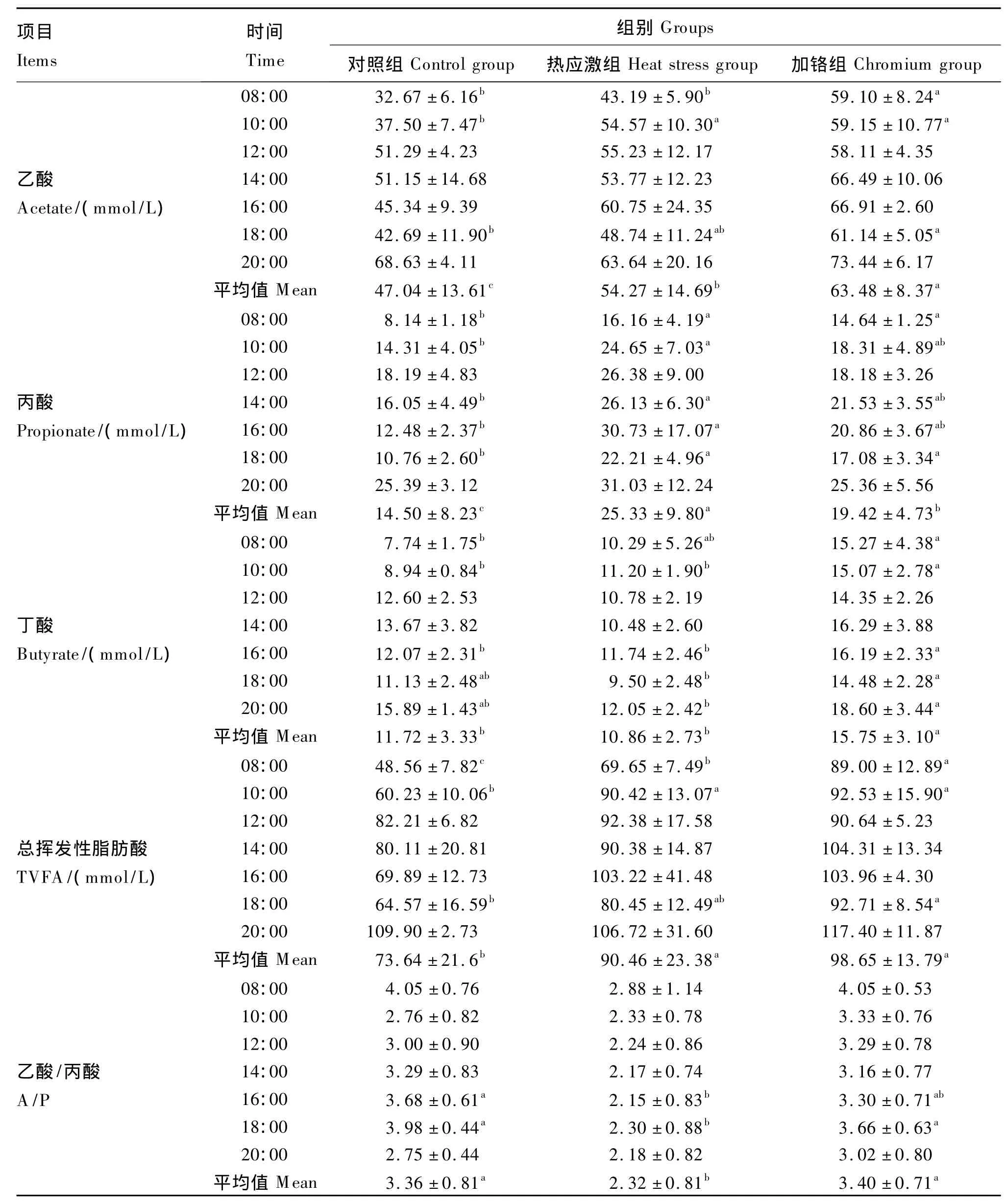
表4 各试验组山羊瘤胃VFA浓度Table4 The rumen VFA concentration of goats of all experimental groups
[1]高民,杜瑞平,温雅俪.热应激对奶牛生产的影响及应对策略[C]//农业部科技教育司,中国农学会,农业部环境保护科研监测所.发展低碳农业应对气候变化——低碳农业研讨会论文集.北京:中国农业出版社,2010:127-132.
[2]廖晓霞,叶均安.泌乳奶牛热应激研究进展[J].中国饲料,2005(19):21-23.
[3]王建平,王加启,卜登攀,等.高温条件下高产和中产奶牛产奶性能及瘤胃发酵的研究[J].动物营养学报,2010,22(1):51-56.
[4]MERTZ W,TEPHER E V,ROGINSID E E,et al.Present knowledge of the role of chromium[J].Federation Proceedings,1974,33:2275-2280.
[5]BAHIJRI S M A,MUFTI A M B.Beneficial effects of chromium in people with type 2 diabetes,and urinary chromium response to glucose load as a possible indicator of status[J].Biological Trace Element Research,2002,85(2):97-109.
[6]张敏红,张卫红.补铬对高温环境下猪的铬代谢、生理生化反应和生产性能的影响[J].畜牧兽医学报,2000,31(1):1-8.
[7]李绍钰,魏凤仙.有机铬改善高温季节下奶牛生产性能的研究[J].中国奶牛,2000(5):18-19.
[8]EVANS G W.The effect of chromium picolinate on insulin controlled parameters in humans[J].International Journal of Biosocial and Medicine Research,1989,11:163-175.
[9]NRC.Nutrient requirements of goats:angora,dairy and meat goats in temperate and tropical countries[S].Washington,D.C.:National Academy Press,1981.
[10]金公亮.奶山羊饲养标准[J].畜牧兽医杂志,1989(2):7-12.
[11]冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].畜牧与饲料科学,2010,31(6/7):37.
[12]谭支良,卢德勋,胡明,等.绵羊日粮中不同碳水化合物比例对瘤胃内环境参数的影响[J].动物营养学报,2000,12(1):42-47.
[13]MISHRA M,MARTZ F A,STANLEY R W,et al.Effect of diet and ambient temperature-humidity on ruminal pH,oxidation reduction potential,ammonia and lactic acid in lactating cow[J].Journal of Animal Science,1970,30(6):1023-1028.
[14]温雅俪,高民,何钦,等.热应激对不同泌乳阶段奶牛瘤胃内环境发酵指标的影响[J].中国畜牧杂志,2011,47(19):69-73.
[15]丰伟悦,钱琴芳,丁文军,等.用同位素示踪技术研究大鼠体内铬的赋存状态[J].核化学与放射化学,1999,21(3):147-152.
[16]鲁琳,许曾曾,赵凤茹,等.不同蛋白质饲料原料对瘤胃发酵参数和营养物质降解率的影响[J].中国奶牛,2007(5):10-13.
[17]OWENS F N,BERGEN W G.Nitrogen metabolism of ruminant animals:historical perspective,current understanding and future implications[J].Journal of Animal Science,1983,57:498-518.
[18]COLLIER R J,BEEDE D K,THATCHER W W,et al.Influences of environments and its modification on dairy animal health and production[J].Journal of Dairy Science,1982,65:2213-2227.
[19]黎智峰.有机铬和苦丁茶提取物对热应激山羊的影响[D].硕士学位论文.郑州:河南农业大学,2008:23-30.
