黄瓜矮化突变体膨胀素Cs-EXPA1蛋白的表达及活性分析
2013-09-20胡宝忠黄莎莎李凤兰王多佳
胡宝忠,黄莎莎,李凤兰,王多佳
(东北农业大学生命科学学院,哈尔滨 150030)
McQueen-Mason等首次在黄瓜下胚轴细胞壁中鉴定出相对分子质量为29和30 ku的两种蛋白质,其为在植物细胞生长期间释放且能使细胞壁软化、伸展的蛋白[1]。此后在许多植物中都发现了膨胀素。植物生长会受到细胞壁限制,因此膨胀素对细胞生长具有重要作用。通过近年对膨胀素的研究发现,膨胀素并不能直接水解纤维素分子的糖苷键,而是把细胞壁中的纤维素链间的氢键打断,有效破坏纤维素结构,使其从结晶状态转化为非结晶状态,有效降低纤维素强度[2-3],从而有效提高纤维素酶对纤维素的水解程度。
纤维素是由D-葡萄糖以β-1,4-糖苷键相联结而成,直链状大分子纤维素折叠起来,形成具有高结晶的基本构成单位,由这种基本构成单位集中起来构成微小的结构单位,再由很多微小单位构成千差万别、不同长度的纤维素[4]。它不但是地球表面天然起源的重要有机物质之一,而其降解还是自然界碳素循环的中心环节。利用植物类纤维这一可再生资源生产燃料酒精的研究已在世界各地逐步展开[5]。纤维素也是自然界中分布最广、含量最多的一种多糖,但由于纤维素的高结晶度导致将其水解成可利用的葡萄糖难度很大。大大浪费纤维素中储存的能量,甚至还有可能造成环境污染。因此,膨胀素的发现对于提高纤维素的水解效率具有重要意义。
膨胀因子在细胞分泌物中含量很少,仅靠分离纯化以满足工业应用的需要[6]。目前通过真核表达系统表达膨胀素蛋白已有大量研究,因此本文利用巴氏德毕赤酵母表达矮化黄瓜突变体Cs-EXPA1基因,并研究重组蛋白与纤维素酶协同降解纤维素的最适反应条件。为提高纤维素的水解效率提供理论依据,对有效利用纤维素资源解决食品、能源等缺乏问题具有重要的理论和现实意义。
1 材料与方法
1.1 材料
黄瓜矮化突变体“D0462”,由东北农业大学园艺学院黄瓜课题组提供;大肠杆菌感受态DH5α购自哈尔滨海基生物公司;。巴氏德毕赤酵母菌株(P.pastorisGS115)和表达载体pGAPHαM由黑龙江省酶制剂工程研究中心提供;pMD18-T载体购自大连宝生物工程有限公司。
1.2 方法
1.2.1 膨胀素基因的分离
在花盆中播种矮化突变体黄瓜种子,待其长到4~6 cm高时,取100 mg材料用Trizol法(Invitrigen公司)提取RNA,采用TaKaRa公司PrimeScriptTMRT-PCR Kit反转录试剂盒说明书合成cDNA第一链,根据GenBank中Cs-EXPA1登录号U30382.1设计合成一对引物,上游C1:5'GAATT CGACTACGGTGGCTGGCAGAG 3',下游C2:5'GC GGCCGCTTAGAATTGAGGGCCTTCATAGG 3'。下划线为EcoRⅠ和NotⅠ酶切位点。
以第1链cDNA为模板进行扩增,反应条件为94℃ 5 min一个循环;94℃ 10 s;55℃ 10 s;72℃30 s;共30个循环,最后72℃延伸5 min。反应产物从1%琼脂糖凝胶上回收后,克隆入pMD-18T载体(TaKaRa),转化大肠杆菌DH5α,提取质粒鉴定后由南京博仕公司测序。
1.2.2 表达载体的构建及重组毕赤酵母的筛选
RT-PCR特异性扩增产物与表达质粒pGAPHαM连接,得到重组质粒。采用电击法进行重组质粒在毕赤酵母中的转化,在MD平板上进行筛选。采用CTAB法提取重组菌株总DNA[7],并通过PCR扩增以及扩增产物的测序来鉴定重组子。
1.2.3 Cs-EXPA1基因在毕赤酵母中的表达
挑取GS115/pGAPHαM-EXPA1单菌落接种至25 mL YPD培养基,30℃,220 r·min-1震荡培养。收集上清。SDS-PAGE分析重组毕赤酵母培养液。所使用凝胶浓度为12%,上样量为80 μL。检测是否有目的蛋白的表达。
1.2.4 膨胀素蛋白协同活性的测定
取3个1 cm×6 cm的新华定量滤纸分别浸入盛有1.5 mL 0.05 mol·L-1的柠檬酸缓冲液(pH 4.5)试管中,再分别将无菌水、GS115发酵上清液、GS115-EXPA1发酵上清液各1.5 mL与0.5 mL纤维素酶液分别混合加入各试管中,25℃水浴反应4 h后各加入0.5 mL按一定比例配置商品化纤维素酶液,50℃水浴中反应30 min,加入1.5 mL DNS溶液终止反应,在沸水浴煮沸5 min。流水冷却后,加入蒸馏水至25 mL,混匀[8]。540 nm下测定吸光值,根据葡萄糖标准曲线计算酶反应过程所释放的还原糖量。
2 结果与分析
2.1 Cs-EXPA1基因的分离
Trizol法提取苗期黄瓜D0462总RNA(见图1)。取1 μL总RNA作为反转录的模板,合成cDNA第一链。再取其2 μL作模板,以C1、C2为引物扩增得到约680 bp的Cs-EXPA1基因,1%琼脂糖凝胶电泳(见图2)。经测序结果图3表明,分离的Cs-EXPA1基因与GenBank上发布的该序列的mat_peptide区相似性达到99%。
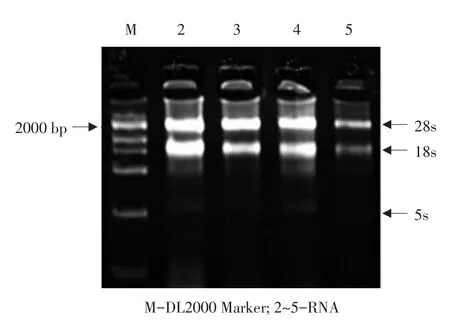
图1 D0462矮化黄瓜总RNA的电泳检测Fig.1 Electrophoresis analysis of total RNA of D0462 dwarf cucumber

图2 Cs-EXPA1基因PCR扩增结果Fig.2 PCR amplification results of of Cs-EXPA1 gene

图3 Cs-EXPA1基因测序结果Fig.3 Sequence result of Cs-EXPA1
2.2 表达载体的构建
将含有pMD18T-EXPA1的正确的转化子于含有氨苄青霉素的LB液体培养基37℃,200 r·min-1,振荡培养过夜,提取质粒DNA,EcoRⅠ和NotⅠ双酶切,回收约680 bp的目的片段,与相同酶消化的pGAPHαM载体,构建组成型表达载体pGAPHαMEXPA1。转化大肠杆菌DH5α,得到的转化子经EcoRⅠ和NotⅠ双酶切(见图4),得到大约7.0 kb和680 bp两条带。
2.3 表达载体pGAPHαM-EXPA1的转化与鉴定
将鉴定正确的pGAPHαM-EXPA1质粒以BglⅡ线性化,得到7.0和2.4 kb两条带(见图5),回收较大条带,制备毕赤酵母GS115菌株的感受态,通过电击将回收的线性化片段转入毕赤酵母中,在MD固体培养基上培养(见图6)。用牙签蘸取少量菌体作为模板,进行菌落PCR检测(见图7)。再用CTAB法提取基因组DNA进行PCR鉴定(见图8),得到与目的基因680 bp大小相符的片段,经测序结果图9表明Cs-EXPA1基因已通过同源重组整合进入毕赤酵母基因组,保存菌株,以备后续试验。
2.4 Cs-EXPA1基因在毕赤酵母中的表达
离心收集发酵液上清液进行SDS-PAGE分析,目标蛋白在29 ku处有表达,但略微偏大(见图10)。可能由于该蛋白中存在葡萄糖基化、磷酸化和多种修饰位点,糖基化和其他修饰等因素共同作用可改变该蛋白的表观分子质量[4]。

图4 pGAPHαM-EXPA1载体的酶切鉴定Fig.4 Enzymes digestion of vector pGAPHα-EXPA1

图5 pGAPHαM-EXPA1载体BglII线性化Fig.5 Linearization of vector pGAPHαM-EXPA1 by BglII
图6 pGAPHαM-EXPA1载体电击转化毕赤酵母Fig.6 Vector pGAPHαM-EXPA1I transformation into Pichia pastoris by electrotransformation
2.5 发酵液中膨胀素蛋白的生物活性
试验测定了膨胀素蛋白与纤维素酶协同水解滤纸的活性。比较纤维素酶、GS115上清和纤维素酶混合物、GS115-EXPA1上清和纤维素酶混合物对滤纸的作用。结果如图11所示,在显微镜下(10×)观察经处理的滤纸的崩解情况。可看出经有膨胀素蛋白上清处理后的滤纸边缘崩解明显,纤维更加稀松,崩解效果明显高于纤维素酶单独作用的滤纸。
2.6 重组蛋白与纤维素酶协同作用条件的研究
2.6.1 反应时间对重组蛋白与纤维素酶协同作用的影响
如图12所示,各重组蛋白与纤维素酶协同作用所产生的还原糖量随时间的延长整体呈上升趋势,反应1 h时,便有还原糖产生,随反应时间的延长,产生的还原糖量增多。
2.6.2 重组蛋白与纤维素酶协同作用的pH优化
不同pH反应环境对协同作用的影响较大见图13。

图7 GS115/pGAPHαM-EXPA1转化子PCR鉴定Fig.7 Identification of GS115/pGAPHαM-EXPA1 transformants by PCR
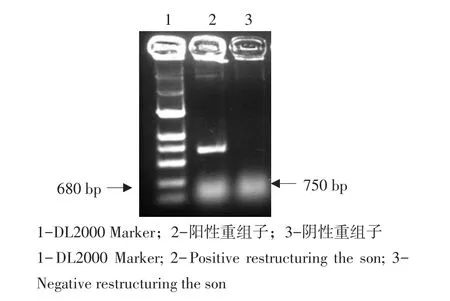
图8 GS115/pGAPHαM-EXPA1转化子基因组DNA PCR鉴定Fig.8 Identification of GS115/pGAPHαM-EXPA1 transformants genomic DNA by PCR
如图13所示,pH 4和pH 5时,产生还原糖量较高,说明在该pH范围内,比较适合重组蛋白与纤维素酶的协同反应。在该范围外的pH不利于协同反应的进行,尤其是在pH 3和pH 7时,协同作用产生的还原糖量较少,说明过酸不利于协同反应的进行。
2.6.3 重组蛋白与纤维素酶协同作用的温度优化
温度对酶的反应有较大影响。结果如图14所示,30~50℃时,产生还原糖量呈上升趋势,50℃还原糖含量最高;随着温度升高,水解活性有所下降,当反应温度为70℃时,分解滤纸产生的还原糖量显著下降。这可能由于温度过高使纤维素酶热变性所致。

图10 重组酵母表达产物的SDS-PAGE检测Fig.10 SDS-PAGE analysis of Pichia pastoris express product

图11 滤纸的崩解情况Fig.11 Filter paper disintegrated

图12 反应时间对协同作用的影响Fig.12 Effect of reaction time on synergism

图13 反应pH对协同作用的影响Fig.13 Effect of reaction pH on synergism

图14 反应温度对协同作用的影响Fig.14 Effect of reaction tempreture on synergism
3 讨论
如何将自然界中丰富的纤维素材料以较高效率转化成可直接利用的酒精燃料等能源物质,是当前国内外开发生物能源的焦点之一[6]。在发现膨胀素蛋白之后,对其蛋白功能、作用机理、理化性质、抑制及促进因素等方面进行大量研究工作。近年大量试验证明,膨胀素蛋白单独使用并不能水解纤维素,但在纤维素酶水解纤维素的过程中表现出明显的协同作用[9],这对高效分解纤维素具有重大意义。有关膨胀素蛋白能够破坏细胞壁木质纤维素微纤维间和细胞壁多糖单链间的氢键,从而促进纤维素酶水解效率的文章已有报道。黄萍等通过用含有膨胀素的重组菌株培养上清液与里氏木霉纤维素酶的混合溶液一起降解纤维素,结果证实膨胀素能够协助纤维素酶水解纤维素,能使纤维素酶的滤纸酶活力得到有效提高[10]。膨胀素这种性质可降低各种纤维素材料转化为可直接利用的能源物质,具有良好应用前景[11]。本文通过电击转化方式将膨胀素蛋白基因成功转入毕赤酵母,并在酵母中成功进行Cs-EXPA1蛋白的表达。通过滤纸水解试验证明该蛋白具有破坏纤维素高级结构,协同纤维素酶水解纤维素的特点。为使膨胀素在协同反应过程中尽可能发挥作用,本试验对协同反应外在条件进行初步研究。协同作用在反应1 h时便有还原糖产生,36h时明显增多,若反应时间再延长,纤维素酶减少,活性下降,对滤纸水解效率不会有所帮助。由于蛋白质受pH影响,因此协同反应活性也受pH影响,pH 4.0和pH 5.0时,DNS法测得滤纸被分解后产生还原糖量较高,pH 5.0时协同活性最高,而过酸和碱性条件都不利于协同反应,也不利于还原糖产生。30~50℃时,产生还原糖量明显增多,50℃时还原糖含量最高,当协同反应温度达70℃时测得的还原糖含量显著下降。可能由于反应温度过高使纤维素酶发生热变性,失去水解纤维素的作用。目前对膨胀素协同纤维素酶的条件研究较少,除外因的影响还可能存在内在因素的作用,但具体的影响机制还有待进一步研究。
4 结论
本研究以黄瓜D0462为基因供体,成功克隆膨胀素基因Cs-EXPA1并构建毕赤酵母组成型表达载体pGAPHαM-EXPA1,电击转入毕赤酵母中获得工程菌,成功诱导膨胀素蛋白表达,通过对膨胀素协同作用的研究初步确定协同反应各外界因素的最佳值,膨胀素蛋白与纤维素酶协同反应36 h时产生的还原糖含量最多,膨胀素蛋白与纤维素酶协同反应最适pH 4.0~5.0;最适温度50℃。本文利用葡萄糖标准曲线计算酶反应过程所释放的还原糖量,初步确定纤维素酶和膨胀素蛋白协同反应的最适条件,可为高效水解纤维素材料提供理论参考。
[1]McQueen-Mason S,Durachko D M,Cosgrove D J.Endogenous proteins that induce cell-wall extension in plants[J].Plant Cell,1992,4(11):1425-1433.
[2]McQueen-Mason S,Cosgrove D J.Expansin mode of action on cell walls:Analysis of wall hydrolysis stress relaxation and binding[J].Plant Physiology,1995,107:87-100.
[3]Whitney S,Gidley M J,McQueen-Mason S.Probing expansin action using cellulose/hemicellulose composites[J].Plant Journal,2000,22(4):327-334.
[4]高洁.纤维素科学[M].北京:科学出版社,1996.
[5]靳振江.纤维素酶降解纤维素的研究进展[J].广西农业科学,2007,38(2):127-130.
[6]王美花,蔡谨,黄磊,等.重组里氏木霉膨胀素的生物特性研究[J].中国科技论文在线,2010,5(3):236-239.
[7]吴志虹,汪天虹,黄卫,等.简便易行的丝状真菌染色体DNA提取法[J].菌物系统,2001,20(4):575-577.
[8]蒋静.EGIII基因、SWOI基因和OsEXP2基因在毕赤酵母中的表达[D].哈尔滨:东北农业大学,2009.
[9]尤程,顾季琼.膨胀素—一个引人注目的细胞壁松弛酶候选者[J].植物生理学通讯,1997,33(3):208-212.
[10]黄萍,刘刚.黄瓜膨胀素的重组表达及活性分析[J].生物技术,2006,16(2):23-26.
[11]徐天鹏.里氏木霉纤维素酶基因的克隆及其在毕赤酵母中表达[D].哈尔滨:东北农业大学,2007.
