辛酸钠对小鼠乳腺上皮细胞甘油三酯合成的影响
2013-09-20刘莉莉李庆章
刘莉莉,白 云,李庆章
(1.黑龙江中医药大学,哈尔滨 150040;2.东北农业大学乳品科学教育部重点实验室,哈尔滨 150030)
乳腺是哺乳动物分泌乳汁器官,泌乳阶段乳汁中糖、脂肪和蛋白质含量受母体、环境、食物等多种因素影响,其中营养是个主要调控因素[1]。乳脂肪是主要的能量物质,在乳腺合成和分泌乳脂的过程中,乳腺上皮细胞生脂基因的表达受相关营养素的调节[2-4]。
脂肪酸是重要营养物质,在生命活动中发挥重要作用,是生物体的能量来源和细胞的结构成分,还可通过细胞膜受体信号途径、转录因子活化途径等独立、间接或直接地调控基因表达[5-7]。有研究报道长链脂肪酸(LCFA)能改变小鼠乳腺脂肪酸从头合成基因、甘油三酯合成基因、转录调控因子基因及其他生脂基因表达[8-9]。国内外关于中、短链脂肪酸对小鼠乳脂合成相关基因表达研究很少。辛酸钠是八碳饱和脂肪酸(C8:0),属于典型的中链脂肪酸,本研究以小鼠乳腺上皮细胞为模型,检测添加不同浓度的辛酸钠对细胞活力、增殖能力及甘油三酯合成能力影响;检测辛酸钠对甘油三酯合成关键酶甘油-3-磷酸脂酰转移酶(GPAM)、乙酰甘油磷酸脂酰转移酶6(AGPAT6)、二酰甘油脂酰转移酶1(DGAT1)及对乳脂合成转录调节因子固醇调节元件结合蛋白1(SREBP1)及过氧化物酶体增殖物激活受体γ(PPARγ)基因表达的影响,旨在为深入研究脂肪酸对小鼠乳脂合成的分子调控机制奠定理论基础。
1 材料与方法
1.1 材料
小鼠乳腺上皮细胞,胎牛血清(Gibco),DMEM/F12培养基(Gibco),辛酸钠(Sigma),胰蛋白酶(Sigma),去除脂肪酸的牛血清白蛋白(Sigma),甘油三酯定量试剂盒(均购自普利莱基因技术有限公司);CASY®ton缓冲液(购自德国Scharfe公司);GPAMAntibody(sc-161674),AGPAT6 Antibody(sc-68594),DGAT1 Antibody(sc-32861),SREBP1 Anti⁃body(sc-365513),PPARγ Antibody(ab19481)。
1.2 小鼠乳腺上皮细胞培养
采用生长培养基(DMEM/F12+10%FBS)于37℃,质量分数为5%的CO2条件下培养小鼠乳腺上皮细胞,每隔24 h更换培养基。
1.3 小鼠乳腺上皮细胞活力和增殖能力检测
收集对数生长期小鼠乳腺上皮细胞等密度接种于24孔板中,待细胞融合度达到70%~80%时,将细胞转入无脂无血清培养基(DMEM/F12+1 g·L-1BSA)培养24 h,更换新鲜无脂无血清培养基并添加不同浓度辛酸钠,辛酸钠终浓度分别为0、0.25、0.50、1.00、2.00、4.00、8.00 mmol· L-1,每组3个平行,培养48 h。消化不同处理组的小鼠乳腺上皮细胞制成单细胞悬液,取100 μL细胞悬液加入装有10 mL CASY®ton缓冲液的CASY®杯(对细胞悬液进行100倍稀释),颠倒CASY®杯使细胞混匀,利用CASY细胞活力分析仪检测细胞活力和增殖能力。
1.4 小鼠乳腺上皮细胞培养基中甘油三酯浓度的检测
取对数生长期乳腺上皮细胞等密度接种于6孔板中,待细胞融合度达70%~80%时,将细胞转入无脂无血清培养基培养24 h,更换新鲜无脂无血清培养基,并添加不同浓度的辛酸钠继续培养48 h,其中辛酸钠的添加浓度根据细胞活力和增殖能力的试验结果,选择使细胞生长增殖不受抑制的辛酸钠浓度,采用甘油三酯定量试剂盒测定培养基中甘油三酯的浓度。
1.5 小鼠乳腺上皮细胞总蛋白提取
小鼠乳腺上皮细胞的处理及辛酸钠的添加浓度同1.4。4℃预冷的D-HankS洗涤细胞2次;每孔中加100 μL 2×SDS Sample Buffer,用枪头轻轻刮下细胞,转移到0.5 mL的EP管中;100℃煮沸10 min使蛋白变性;超声波破碎,15 s 3次,分装,-20℃冻存备用。
1.6 Western Blotting检测
配制浓缩胶和分离胶进行SDS-PAGE分析。电泳结束后将凝胶上的蛋白转印到硝酸纤维素膜上。室温用脱脂牛奶封闭2 h,一抗4℃孵育过夜,取出后TBST洗3次,每次5 min,二抗37℃摇床孵育1 h,TBST洗3次,发光液显色,在暗室中曝光、显影。采用Band Scan 5.0软件对Western blotting图谱进行灰度扫描,X光胶片上蛋白条带经扫描读取密度值后,与由同一转移膜所测得的βactin蛋白比较得出蛋白的相对含量。
1.7 数据处理
应用SAS 9.1统计学软件进行单因素方差分析,试验数据以平均数±标准差()表示,P<0.05表示差异显著。
2 结果与分析
2.1 辛酸钠对小鼠乳腺上皮细胞活力和增殖能力的影响
图1为不同浓度的辛酸钠对小鼠乳腺上皮细胞活力和增殖能力的影响。由图1可见,小鼠乳腺上皮细胞添加浓度为0.25~1.00 mmol·L-1辛酸钠时,各处理组与对照组相比细胞活力和增殖能力无显著性差异(P>0.05);而添加2.00~8.00 mmol· L-1辛酸钠,细胞活力和增殖能力与对照组相比显著降低(P<0.05)。结果表明,较高剂量2.00、4.00、8.00 mmol·L-1辛酸钠显著抑制细胞活力和增殖能力。
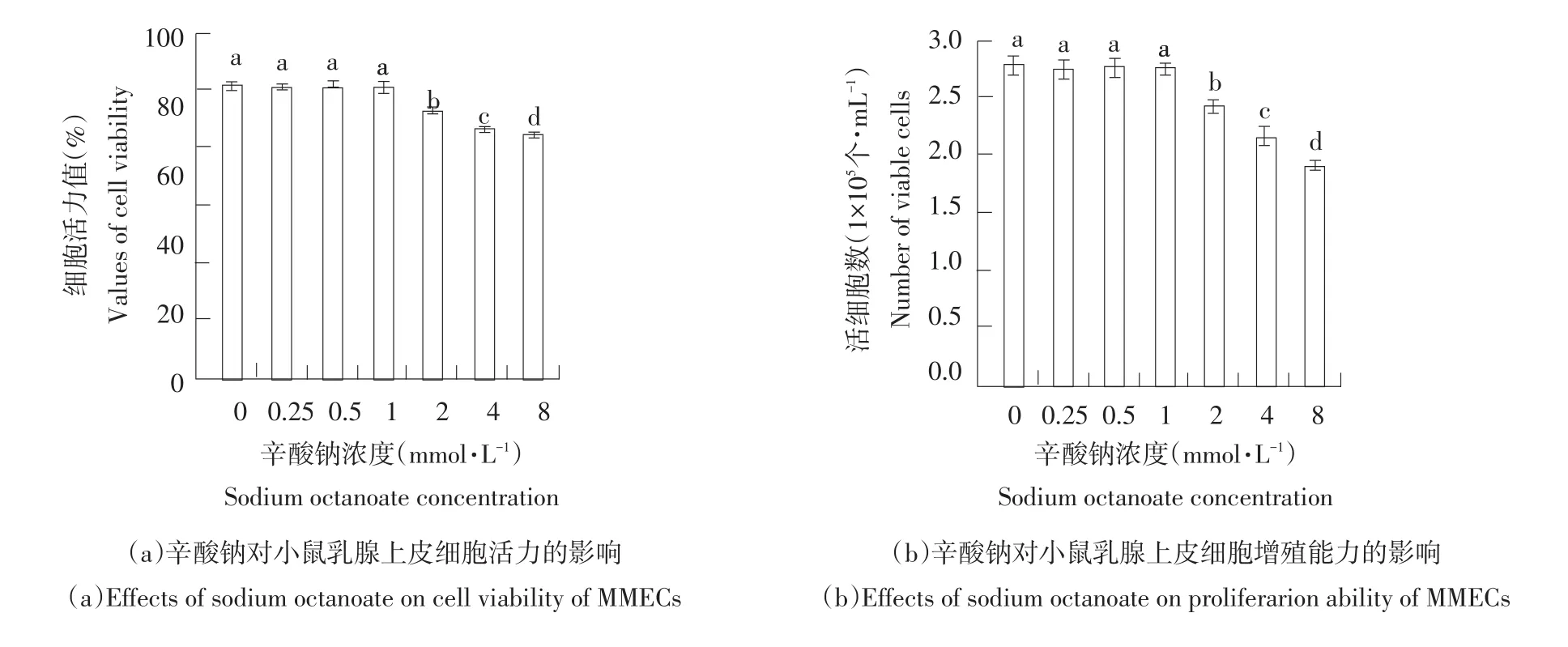
图1 辛酸钠对小鼠乳腺上皮细胞活力和增殖能力的影响Fig.1 Effects of sodium octanoate on cell viability and proliferarion ability of MMECs
根据不同浓度的辛酸钠处理后各组细胞活力和增殖能力的试验结果,本研究选择添加对细胞生长增殖不受抑制即对细胞无毒性的辛酸钠浓度(0~1.00 mmol·L-1的辛酸钠),研究辛酸钠对细胞甘油三酯合成能力和对乳脂合成关键酶以及转录调控因子蛋白表达影响。
2.2 辛酸钠对小鼠乳腺上皮细胞合成甘油三酯能力的影响
根据检测细胞活力和增殖能力试验结果,选择0.25~1.00 mmol·L-1辛酸钠处理小鼠乳腺上皮细胞,采用甘油三酯测试盒测定培养基中TAG的浓度。结果如图2所示,与未添加辛酸钠的乳腺上皮细胞相比,0.25~1.00 mmol·L-1辛酸钠以浓度依赖的方式显著降低细胞培养基中TAG浓度(P<0.05)。
2.3 辛酸钠对小鼠乳腺上皮细胞乳脂合成相关蛋白表达的影响
采用Western blotting检测不同浓度辛酸钠处理小鼠乳腺上皮细胞后,甘油三酯合成关键酶GPAM、AGPAT6、DGAT1和转录调控因子SREBP1、PPARγ各蛋白的表达情况,结果如图3所示。
2.3.1 辛酸钠对小鼠乳腺上皮细胞甘油三酯合成关键酶表达的影响
如图4所示,与未添加辛酸钠的乳腺上皮细胞相比,0.25~1.00 mmol·L-1辛酸钠以浓度依赖的方式降低或显著降低(P<0.05)细胞GPAM、AGPAT6和DGAT1的蛋白表达。
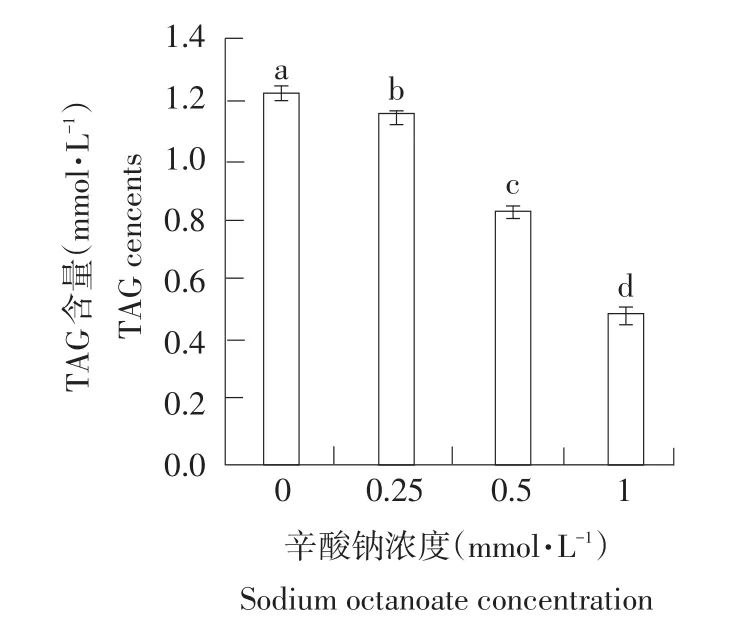
图2 辛酸钠对小鼠乳腺上皮细胞合成TAG能力的影响Fig.2 Effects of sodium octanoate on triacylglycerol synthesis of MMECs
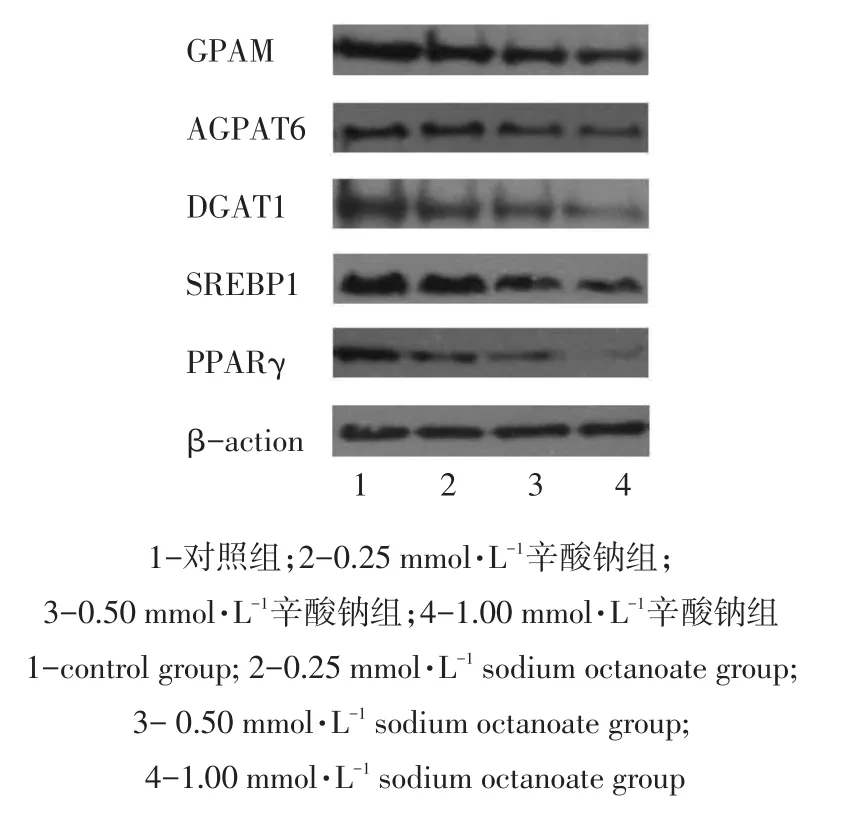
图3 辛酸钠处理小鼠乳腺上皮细胞乳脂合成相关蛋白表达的Western blotting结果Fig.3 Western blotting result about effects of sodium octanoate on related protein expression in milk fat synthesis of MMECs
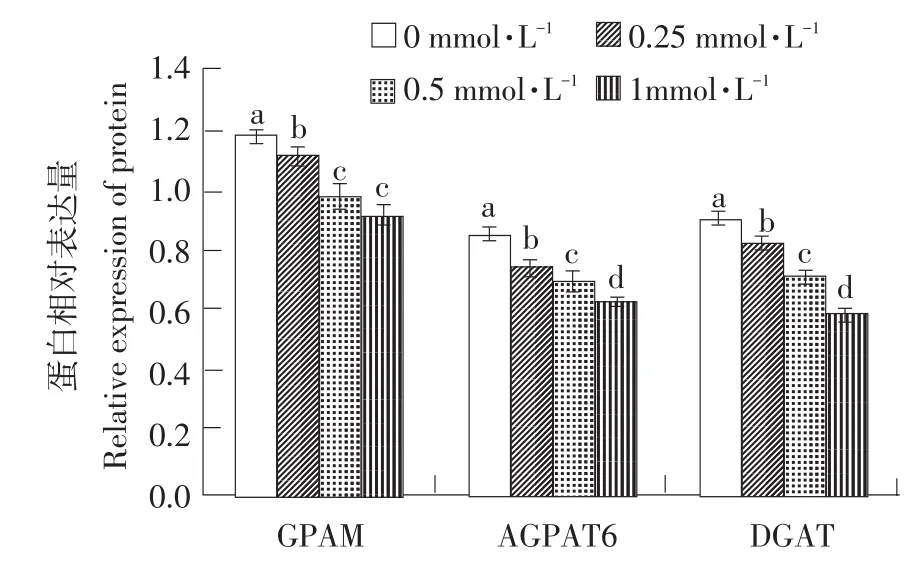
图4 辛酸钠对小鼠乳腺上皮细胞甘油三酯合成关键酶表达的影响Fig.4 Effects of sodium octanoate on key enzymes of triacylglycerol synthesis of MMECs
2.3.2 辛酸钠对小鼠乳腺上皮细胞乳脂合成转录调控因子表达的影响
如图5所示,与对照组乳腺上皮细胞相比,0.25~1.00 mmol·L-1辛酸钠以浓度依赖的方式显著降低细胞SREBP1和PPARγ的蛋白表达(P<0.05)。
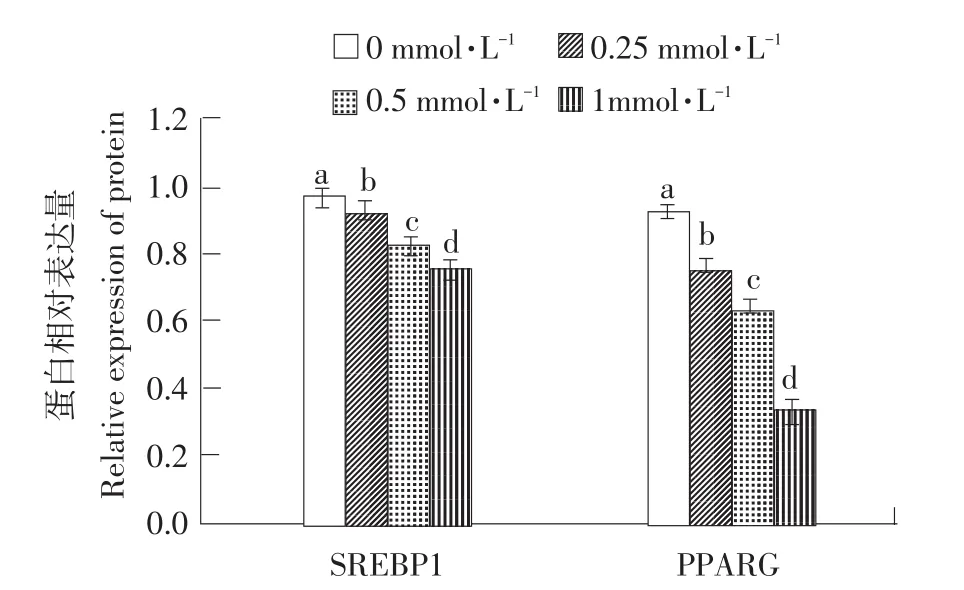
图5 辛酸钠对小鼠乳腺上皮细胞乳脂合成转录调节因子表达的影响Fig.5 Effects of sodium octanoate on transcriptional regulatory factors of milk fat synthesis of MMECs
3 讨论与结论
脂肪酸是哺乳动物乳腺摄取的重要营养物,对乳腺上皮细胞的生长增殖具有一定作用。齐利枝等研究发现低浓度的乙酸可提高奶牛乳腺上皮细胞活性,高浓度乙酸则抑制细胞活性[10]。崔瑞莲等证实较高浓度(200 μmol· L-1和400 μmol·L-1)的硬脂酸、油酸、亚油酸和亚麻酸能抑制奶牛乳腺上皮细胞的增殖[11]。本研究发现较高剂量(即2.00、4.00和8.00 mmol· L-1)辛酸钠对小鼠乳腺上皮细胞的活力和增殖能力具有抑制作用。但辛酸钠对其细胞活力和增殖能力影响的具体机理有待深入研究。本试验通过CASY细胞活力分析仪检测不同浓度的辛酸钠对小鼠乳腺上皮细胞活力的影响,确定辛酸钠对小鼠乳腺上皮细胞无毒添加剂量作为后续试验浓度添加范围,即0~1.00 mmol·L-1辛酸钠。
哺乳动物乳腺上皮细胞是乳脂合成场所,合成乳脂约95%为甘油三酯[12]。乳腺中GPAM、AG⁃PAT6和DGAT1酶主要参与催化甘油三酯合成。其中GPAM酶催化甘油三酯合成的第1步即脂酰辅酶A结合到3-磷酸甘油的sn-1位,AGPAT6酶催化第2个脂酰辅酶A结合到3-磷酸甘油的sn-2位,第3个脂酰辅酶A通过DGAT1酶的催化酯化到甘油骨架的sn-3位合成甘油三酯[13-14]。Bionaz等提出转录调控因子SREBP1和PPARγ在奶牛乳脂合成和分泌的基因网络中具主导作用,其可调控多数乳脂合成相关基因表达[14]。Anderson等研究表明SREBP1对调节鼠乳脂合成起枢纽作用[15];Wan等发现PPARγ敲除的小鼠减少TAG合成[16]。研究报道辛酸盐能抑制脂肪细胞甘油三酯合成,抑制PPARγ、SREBP-1及其他生脂基因的表达[17-19]。研究表明,辛酸盐能参与脂肪细胞的脂肪合成,并调节相关生脂基因表达。辛酸盐对小鼠乳腺上皮细胞甘油三酯合成及对甘油三酯合成关键酶和转录调节因子PPARγ和SREBP1的影响却不清楚。
本研究发现,外源添加0.25~1.00 mmol·L-1辛酸钠以浓度依赖的方式显著降低细胞培养基中甘油三酯的含量,说明辛酸钠能抑制小鼠乳腺上皮细胞乳脂合成。同时发现辛酸钠也能以浓度依赖的方式降低或者显著降低GPAM、AGPAT6、DGAT1及SREBP1、PPARγ蛋白表达,推测辛酸钠可通过降低小鼠乳脂合成转录调节因子SREBP1和PPARγ的表达,抑制其下游靶基因GPAM、AG⁃PAT6和DGAT1表达.本研究检测到小鼠乳腺上皮细胞中SREBP1和PPARγ的其他靶基因表达也显著降低(材料未发表)。推测小鼠乳腺上皮细胞中辛酸钠通过降低SREBP1和PPARγ的表达进而抑制甘油三酯合成。这与前人用辛酸盐对其他细胞脂肪合成影响研究[17-19]基本一致。
[1]Coleman R A,Lewin T M,Muoio D M.Physiological and nutritional regulation of enzymes of triacylglycerol synthesis[J].Annual Review of Nutrition,2000,20,77-103.
[2]胡菡,王加启,李发弟等.游离亚麻酸对奶牛乳腺上皮细胞脂肪酸代谢相关基因mRNA转录的影响[J].动物营养学报,2010,22(5):1342-1349.
[3]王红芳.外源反-10、顺-12共轭亚油酸对牛乳腺上皮细胞脂肪合成的影响及其分子机制[D].泰安:山东农业大学,2011.
[4]Peterson D G,Matitashvili E A,Bauman D E.The inhibitory ef⁃fect of trans-10,cis-12 CLA on lipid synthesis in bovine mam⁃mary epithelial cells involves reduced proteolytic activation of the transcription factor SREBP-1[J].J Nutr,2004,134(10):2523-2527.
[5]Georgiadi A,Kersten S.mechanisms of gene regulation by fatty acids[J].Adv Nutr,2012,3(2):127-134.
[6]Duplus E,Glorian M,Forest C.Fatty acid regulation of gene tran⁃scription[J].J Biol Chem,2000,275(40):30749-30752.
[7]Sampath H,Ntambi J M.Polyunsaturated fatty acid regulation of genes of lipid metabolism[J].Annu Rev Nutr,2005,25:317-340.
[8]Lin X,Loor J J,Herbein J H.Trans10,cis12-18:2 is a more po⁃tent inhibitor of de novo fatty acid synthesis and desaturation than cis9,trans11-18:2 in the mammary gland of lactating mice[J].J Nutr,2004,134(6):1362-1368.
[9]韩立强.共轭亚油酸抑制乳腺脂肪合成相关基因的表达研究[D].郑州:河南农业大学,2010.
[10]齐利枝,闫素梅,生冉等.乙酸对奶牛乳腺上皮细胞活力及CD36和FABP3基因表达的影响[J].饲料工业,2013,34(11):49-52.
[11]崔瑞莲.十八碳脂肪酸对泌乳奶牛乳腺上皮细胞甘油三酯合成的影响及机理研究[D].北京:中国农业科学院,2012.
[12]Chilliard Y,Ferlay A,Mansbridge R M,et al.Ruminant milk fat plasticity:Nutritional control of saturated,polyunsaturated,trans and conjugated fatty acids[J].Annales de Zootechnie,2000,49(3):181-205.
[13]Coleman R A,Lee D P.Enzymes of triacylglycerol synthesis and their regulation[J].Prog Lipid Res,2004,43:134-176.
[14]Bionaz M and Loor JJ.Gene networks driving bovine milk fat syn⁃thesis during the lactation cycle[J].BMC Genomics,2008(9):366-387.
[15]Anderson S M,Rudolph M C,McManaman J L,et al.Key stages in mammary gland development.Secretory activation in the mam⁃mary gland:it's not just about milk protein synthesis[J].Breast Cancer Res,2007,9(1):204.
[16]Wan Y,Saghatelian A,Chong LW,et al.Maternal PPAR gamma protects nursing neonates by suppressing the production of inflam⁃matory milk[J].Genes Dev,2007,21(15):1895-1908.
[17]Guo W,Lei T,Wang T,et al.Octanoate inhibits triglyceride syn⁃thesis in 3T3-L1 and human adipocytes[J].J Nutr,2003,133(8):2512-2518.
[18]Guo W,Xie W,Han J.Modulation of adipocyte lipogenesis by octanoate:Involvement of reactive oxygen species[J].Nutr Metab(Lond),2006,3:30.
[19]Han J,Farmer S R,Kirkland J L,et al.Octanoate attenuates adi⁃pogenesis in 3T3-L1 preadipocytes[J].J Nutr,2002,132(5):904-910.
