尖吻蝮蛇毒PCA在急性心肌梗死诊断中的应用
2013-09-20张根葆皇甫政彤
王 斐,张根葆,2,黄 璐,徐 平,皇甫政彤,吴 娟
(皖南医学院 1.病理生理学教研室;2.蛇毒研究所,安徽 芜湖 241002)
急性心肌梗死(acute myocardial infarction,AMI)是冠状动脉血供急剧减少或中断,相应的心肌急性缺血导致心肌坏死[1]。急性心肌梗死诊断主要依据临床表现、病史、心肌的生化指标以及心电图改变等[2]。近年来,蛋白C系统在AMI发生发展中的研究越来越受到科研人员关注,蛋白C活性降低与AMI的发生发展有密切关系,对蛋白C活性的动态监测将反映AMI的严重程度[3]。蛋白C是一种维生素K依赖的糖蛋白,在肝脏中合成,生理条件下以无活性的酶原形式存在于血浆,在凝血酶与血栓调节蛋白复合物(凝血酶-TM)的作用下催化为活化蛋白C(APC),从而发挥抗凝活性[4]。内皮细胞蛋白C受体(EPCR)与蛋白C结合可使蛋白C活化程度极度增强,从而更显著地发挥抗凝活性。相关报道指出,在天然蛇毒提取物中发现了多种能特异性激活蛋白C的激活剂,部分激活剂已用于基础研究及临床诊断。本室从尖吻蝮蛇粗毒中分离纯化出的蛋白C激活剂[5],根据蛋白C活性检测原理,研制出PC活性检测试剂,前期实验[6]表明能有效激活血浆蛋白C,并与进口蛋白C检测试剂生物学活性相似、结果稳定等。因此,本研究将通过建立大鼠急性心肌梗死模型,通过本室研究的蛋白C激活剂,运用发色底物法检测AMI大鼠血浆蛋白C活性变化,探讨蛋白C活性检测试剂在AMI诊断的应用,为进一步将PC活性检测试剂应用于基础研究及临床诊断提供理论及技术支持。
1 材料与方法
1.1 材料
1.1.1 动物 SD雄性大鼠,体质量(200±30)g,由苏州市工业园区爱尔麦特科技有限公司提供,许可证编号:SCXK(苏)2009-0001。
1.1.2 药品与试剂 蛋白C激活剂(PCA)由皖南医学院蛇毒研究所提供;血管内皮细胞蛋白C受体(EPCR)试剂盒购自美国Assay公司;活化部分凝血活酶时间(APPT)检测试剂盒购于上海太阳生物技术有限公司。
1.1.3 仪器 Model-680酶标仪(美国伯乐公司);FA1604N电子天平(上海民桥精密科技仪器有限公司);HX-300S型动物呼吸机(成都泰盟科技有限公司);Medlab/8C生物信号采集处理系统(南京美易科技有限公司);MC-2000双通道凝血仪(美国伯乐公司);低温高速离心机(北京医用离心厂)等。
1.2 方法
1.2.1 动物分组 30只雄性SD大鼠随机分为3组(n=10),即对照组(C组)、假手术组(S组)、急性心肌梗死模型组(AMI组)。
1.2.2 模型复制 心肌梗死模型组雄性SD大鼠,称重后腹腔注射3%戊巴比妥钠(0.1/100 g)麻醉,仰卧位固定于大鼠台,链接MedLab信号处理系统监测心电变化。颈部手术,分离左右颈总动脉及行气管切开术,气管插管后接动物呼吸机辅助呼吸。心电变化平稳5 min后,以大鼠左胸第4、5肋间为手术切口,依次切开各层,暴露肋骨,破胸膜,撕开心包膜,轻压腹腔及胸廓挤出心脏,用6-0号手术线于动脉圆锥与左心耳交界稍下1~2 mm处迅速结扎左冠状动脉前降支,迅速将心脏放回胸腔,于心脏表面滴2~3滴利多卡因,MedLab信号处理系统监测S-T段弓背向上明显抬高,表明心肌梗死模型制备成功,关闭切口,缝合各层皮肤;S组SD大鼠模型复制仅开胸不进行心脏结扎。
1.2.3 标本采集及指标检测 分别在模型制造后0.5 h、1 h、2 h、4 h 颈总动脉取血,用 3.8% 枸橼酸钠(1∶9)抗凝,离心15 min(3 000 r/min)收集血浆在4 h内检测活化的部分凝血活酶时间(APTT)指标。离心30 min(3 000 r/min),收集血浆冰冻保存,用于其他指标检测。
1.3 统计学处理 使用SPSS 17.0统计软件处理,实验数据以均数±标准差(¯x±s)表示,多组均数比较用单因素方差分析,两两比较用SNK-q法,以P<0.05表示具有显著性差异的标准。
2 结果
2.1 心肌梗死模型复制 图1B显示:S组心率增快;图1C显示:AMI组S-T段弓背向上抬高,QRS波群形态改变,T波增高。图2C显示:镜下观察心肌组织部分细胞排列絮乱,细胞核固缩。
2.2 SD心梗大鼠血浆蛋白C活性变化 从图3可见,AMI组在模型制作成功1 h时,血浆PC活性(66.67 ±5.25)%较蛋白 S 组(73.8 ±5.3)%、C 组(74.2 ±3.8)%下降(P <0.05),4 h 时 AMI组血浆蛋白 C 活性为(57.4±1.89)%、S组(72.7±2.9)%、C 组(73.2 ±3.48)%,AMI组血浆 PC 活性较S组、C组下降更加显著(P<0.01),表明心肌梗死发生时,蛋白C系统受到影响,并且进一步表明血浆PC活性下降的程度与AMI的发生相关。
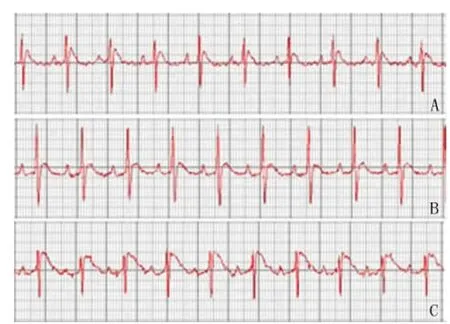
图1 Medlab生物信号采集系统检测SD大鼠心电变化A:C组心电图正常;B:S组心电图显示心率增快;C:AMI组心电图显示S-T段弓背向上抬高,QRS波群形态改变,T波抬高Fig 1 ECG movement in SD rats detected by Medlab bio-signal operating systemA:Normal ECG for the control group;B:Increased heart rate in the sham operation group;C:Arched elevation of S-T segment in AMI group.QRS waves are changed,and T waves are elevated
2.3 SD大鼠活化的部分凝血活酶时间(APTT)指标变化 从表1可见,AMI组与 C组、S组比较,APTT在AMI发生2 h时开始缩短,4 h明显缩短,差异具有统计学意义(P<0.05)。
2.4 SD大鼠血管内皮蛋白C抗体(EPCR)含量变化 从表2可见,AMI组大鼠血浆EPCR含量与S组、C组比较,在心肌梗死后2 h开始升高,差异具有统计学意义(P<0.05),4 h时大鼠血浆EPCR含量显著升高,差异具有显著统计学意义(P<0.01)。
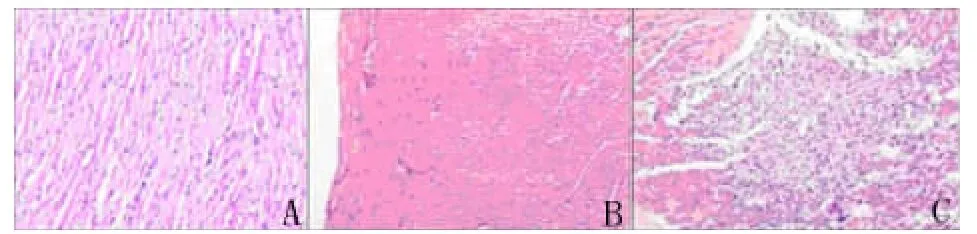
图2 SD大鼠心肌病理切片(HE染色,×40)A:C组心肌组织正常;B:S组心肌组织正常;C:AMI组心肌组织,显示部分细胞排列絮乱,细胞核固缩Fig 2 Myocardial pathological section for SD rats(HE,×40)A:Normal myocardial tissue from the control group;B:Normal myocardial tissue from sham operation group;C:AMI group shows that pathological cardiac muscle cells are arranged in disorder,with fractured myofilaments and cell nucleus pyknosis
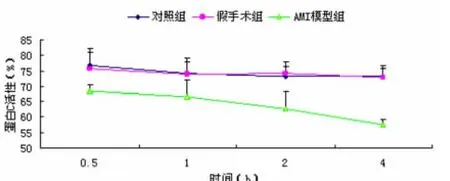
图3 大鼠血浆蛋白C活性变化的组间比较(¯x±s,n=10)Fig 3 Comparison of the plasma protein C activity changes in SD rats(¯x±s,n=10)

表1 SD大鼠活化的部分凝血活酶时间(APTT)指标变化(¯x±s,n=10)Tab 1 Comparison of APTT indicators among AMI model group,Sham operation group and Control group(¯x±s,n=10)
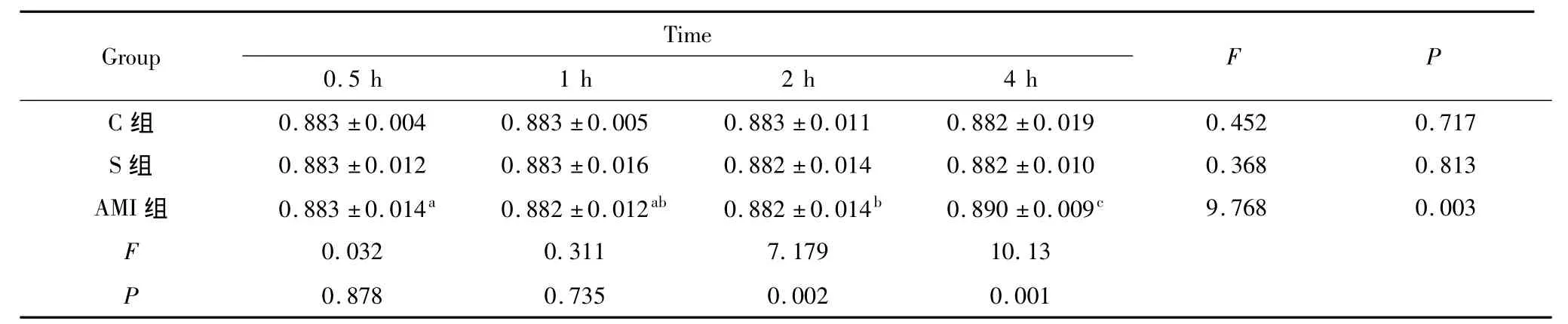
表2 AMI模型组血浆EPCR含量与对照组比较(¯x±s,n=10)Tab 2 Comparison of the plasma EPCR levels among AMI model group,Sham operation group and Control group(¯x±s,n=10)
3 讨论
急性心肌梗死绝大多数与冠状动脉粥样硬化病变有关,血栓形成是大多数急性心肌梗死的病理生理基础[7]。如何早期诊断,特别是早期预测AMI的发生与发展,并结合有效的治疗是改善预后降低病死率的重要手段[8]。近年来,愈来愈多的研究报道,蛋白C的缺失或下降与血栓性疾病的发生发展密切相关[9],但目前关于蛋白C活性在AMI中的连续变化的研究报道较少,可能与蛋白C活性检测试剂的商品化产品很少[10],国外进口价格昂贵有一定的关系。
本研究发现,AMI组心电显示S-T段弓背向上抬高,QRS波群形态改变,T波增高;病理切片心肌组织镜下观察显示细胞排列絮乱,细胞核固缩,确认了AMI模型制造成功。实验中发现,AMI组在模型制作成功1 h时,血浆 PC活性(66.67±5.25)%较蛋白 S组(73.8 ±5.3)%、C 组(74.2 ±3.8)%下降(P<0.05),4 h时 AMI组血浆蛋白 C活性为(57.4±1.89)%、S 组 (72.7 ± 2.9)%、C 组(73.2±3.48)%,AMI组血浆 PC 活性较 S组、C 组下降更加显著(P<0.01);APTT在AMI发生2 h时开始缩短,4 h明显缩短,提示蛋白C活性参与AMI的发生发展,其异常变化比凝血指标出现得更早、更敏感。与此同时,内皮细胞蛋白C受体(EPCR)于AMI发生2 h时开始升高,4 h显著升高,提示AMI发生早期可能由于冠状动脉阻塞导致相应心肌缺血缺氧,凝血系统被激活,同时启动抗凝系统,血浆中无活性蛋白C被激活为活化蛋白C,血浆蛋白C被大量消耗;在这个过程中缺血区相应部位血管内皮受损,释放大量EPCR进入血液,与血液中无活性蛋白C结合,增快蛋白C的消耗,进一步提示蛋白C下降程度与AMI的严重程度具有密切联系。因此,监测血浆蛋白C活性及动态变化对AMI的早期诊断及预后具有重要的临床应用价值。
目前PC的检测方法主要有发色底物法(CSA)、抗原测定法及活化部分凝血活酶(APTT)法[11]。CSA与其他方法比较,更灵敏,可重复强,专一性高,是首选方法[12]。本室从尖吻蝮蛇粗毒中分离纯化出的蛋白C激活物,可特异性激活血浆蛋白C[13],在体外快速反应血浆中蛋白C的活性变化。因此,以尖吻蝮蛇毒PCA制备的血浆蛋白C活性检测试剂应用CSA可较灵敏地反映心肌梗死大鼠血浆蛋白C活性的变化。
[1] 陆姣苑.肌红蛋白和肌钙蛋白联合检测对急性心肌梗死诊断价值的文献评价[J].广西中药学报,2009,12(4):114 -116.
[2] 黄新次,甄燕.肌钙蛋白I、肌红蛋白及心肌酶的检测在急性心肌梗死中的临床诊断价值[J].第四军医大学学报,2009,30(3):133.
[3] ZORIO E,S.NAVARRO,P.MEDI NA,et al.Circulating activated protein Cis reduced in young survivors of myocardial infarction and inversely correlates with the severity of coronary lesions[J].Journal of Thrombosis and Haemostasis,2006,4:1530 -1536.
[4] ESMON CT.The protein c pathway[J].Chest,2003,124:26S-32S.
[5] 张根葆,陈冬云,周志泳,等.蝮蛇毒蛋白C激活物的纯化与抗m 小板活性[J].皖南医学院学报,2005,24(1):8 -10.
[6] 张世,张根葆,包丽丽,等.皖南蝮蛇毒PCA活性血浆蛋白C的特征研究[J].皖南医学院学报,2011,30(2):98 -99.
[7] 彭黎明,邓承祺.现代血栓与止学的实验室检测及其应用[J].血栓与止血学,2007,13(1):29 -33.
[8] 马逸,尚士芹,杨瑞峰.急性心肌梗死心肌肌钙蛋白I定量检测的临床意义[J].中国实验诊断学,2008,12(4):513 -514.
[9] ALTINISIK J,ATES O,ULUTIN T,et al.Factor V Leiden,prothrombin G202IOA,and protein C mutation frequency in Turkish vencus thrombosis patients[J].Clin Appl Thromb Hemost,2008,14(4):415-420.
[10] ORTHNER CL,BHATTCHARYA P,STRICKLAND DK.Characterization of a protion Cactivator from the venom of Agkistrodon contortrix contorix[J].Biochemistry,1988,27(7):2558 - 64.
[11]王宗奎,林方昭,肖小璞,等.蛋白C、蛋白S的研究与应用[J].中国输血杂志,2010,23(14):322 -325.
[12]刘景河,孙晖.蛋白C缺陷与其检测方法[J].生命的化学,2004,24(3):249 -252.
[13]李曙,张根葆,李伟.蝮蛇毒PCA抗血栓形成的实验研究[J].皖南医学院学报,2011,30(6):440 -443.
