树鼩IL-2全长编码序列的克隆及分子特征分析
2013-09-20黄晓燕李明利高跃东王文广殷安国李晓飞孙晓梅夏雪山代解杰
黄晓燕,李明利,徐 娟,高跃东,王文广,殷安国,李晓飞,孙晓梅,夏雪山,代解杰,*
1. 中国医学科学院/北京协和医学院 医学生物学研究所 树鼩种质资源中心 云南省重大传染病疫苗研发重点实验室,云南 昆明650118;
2. 中国科学院昆明动物研究所 动物模型与人类疾病机理重点实验室:免疫生物学实验室,云南 昆明 650223;
3. 中国科学院昆明生物多样性大型仪器区域中心,云南 昆明 650223;
4. 中国科学院昆明动物研究所 遗传资源与进化国家重点实验室,云南 昆明 650223;
5. 昆明理工大学 生命科学与技术学院,云南 昆明 650500
白细胞介素-2 (Interleukin-2,IL-2)为主要由激活淋巴细胞所产生的Th1型细胞因子,能促进T细胞、NK细胞及B细胞的分化成熟并激活其生物活性,诱导淋巴因子激活杀伤细胞 (LAK),并通过淋巴因子和天然杀伤细胞破坏肿瘤细胞,以及促进诸多淋巴因子如干扰素及肿瘤坏死因子等的合成、释放及抗体生成,增强机体免疫功能,在抗肿瘤、抗毒素、免疫调节及感染性疾病的治疗等中具有重要作用 (Lenardo, 1991)。IL-2 还可作为免疫佐剂用于某些淋巴组织增生性疾病及癌症的治疗,其拮抗剂可用于抑制器官移植排斥反应 (Theze, 1996;Church, 2003)。人IL-2由位于第4号染色体长臂上的单一非等位基因编码,由153个氨基酸组成,包括20个信号肽 (Gillis et al, 1979)。IL-2与受体结合后发挥作用,其受体由三种肽链α、β和γ参与构成 (Shanafelt, 2000)。IL-2Rα为低亲和力受体,单独与IL-2结合后不参与信号转导。T细胞表面表达由 α、β、γ三聚体构成的高亲和力受体参与,NK细胞表面表达由 β、γ二聚体构成的中亲和力受体参与 (Voss, 1991),只有当IL-2和IL-2Rβ及IL-2Rγ结合后,才能通过其胞浆区的异源二聚体和信号旁路的一系列激酶活化发挥有效的信号转导作用。该因子于1976年由Morgan et al报道,并由Taniguchi et al于1983年首次克隆成功。在人类医学方面,重组IL-2在提高免疫抗病机能、抗感染和治疗癌症等方面获得了广泛应用 (Zelus et al,2000)。
树鼩 (Tupaia belangeri, tree shrew)是生活在热带和亚热带地区的哺乳纲攀鼩类小型动物,形态酷似松鼠(Cao et al, 2003),是灵长类动物的近亲(Novacek ,1992; Nie ,2008)。由于树鼩体型小、易驯养、繁殖能力强且饲养管理成本低,作为某些人类重大疾病研究的动物模型, 在医学实验中已被广泛应用。早在1997年,Wang et al就发现树鼩可感染人HCV。Zhao et al (2005)用HCV感染树鼩原代培养肝细胞,结果在细胞培养上清液检出HCV RNA,说明树鼩肝外可支持HCV复制。Amako et al (2010)用HCV患者血清和HCV全长cDNA重组的病毒颗粒感染树鼩,经过长达3 a的观察发现,HCV在树鼩体内可导致慢性肝炎、肝脂肪变性、肝纤维化、肝硬化结节及肿瘤发生等,表明树鼩可作为模型动物用于研究丙型肝炎发病机制、预防治疗及新药研发。有研究表明,在慢性及重型丙型肝炎感染者血清中IL-2水平明显上升,且其上升幅度与病情轻重和病程长短密切相关 (Bozkaya,2000; Fukuda, 1996;Napoli,1996)。但目前对树鼩IL-2的研究尚属空白,致使缺乏对树鼩动物模型免疫细胞因子方面的评价指标,因此,阐明树鼩IL-2分子结构和功能的关系,是研究IL-2在丙型肝炎等疾病感染过程中免疫功能的前提。为此,本研究以确定树鼩IL-2完整编码序列为目的,对其进行分子特征分析,为今后制备树鼩 IL-2单克隆抗体及研究白细胞介素在丙型肝炎中的免疫调节机理奠定基础。
1 材料和方法
1.1 实验动物
自繁 F1代树鼩由中国医学科学院医学生物学研究所树鼩种质资源中心提供,按实验动物使用的3R原则给予实验动物人道主义关怀。
1.2树鼩IL-2 cDNA的分子克隆
由于树鼩IL-2基因分子序列未见报道,我们首先根据取自NCBI数据库树鼩2倍覆盖率基因组预测序列 (BioProject Accession: PRJNA13971)结合人IL-2编码区设计上、下游引物(上游引物:5'-ATGCACAAAATGCAACTCTTGTCTTG-3',下游引物:5'-TCAACTCAGTGTTGAAATGATGCTTTG-3')。
无菌采集树鼩外周血2 mL,用Ficoll-PaqueTM PREMIUM (购自GE Healthcare)分离外周血淋巴细胞,经 1640完全培养基培养及 ConA诱导 (1640液、胎牛血清购自TaKaRa) 后,收集淋巴细胞,提取细胞总RNA (试剂盒购自Thermo)。将其反转录为cDNA (Revert Aid H Minus First strand cDNA synthesis Kit 购自 Thermo),利用上述引物进行梯度PCR (Dream Taq Green PCR Master Mix 购自Thermo),循环参数为:95 ℃ 3 min; 95 ℃ 30 s, 61℃ 30 s, 72 ℃ 45 s, 35个循环;72 ℃ 10 min。以树鼩管家基因GAPDH(Glyceraldehyde-3-phos-phate dehydrogenase)作为阳性对照,其引物为5′-CCATCACCATCTTCCAGGAGCGAG-3′和 5′-C AAAGGTGGAGGAGTGGGTGTCG-3′,退火温度为52 ℃。将胶回收后的PCR产物 (胶回收试剂盒购自TIANGEN) 经TA克隆插入pMD-19T载体,转化大肠杆菌DH5a感受态细胞,提取质粒经BamHⅠ和Hind Ⅲ 双酶切鉴定后,由invitrogen公司进行双向测序。
1.3 分子特征分析
本文用于参比的核酸序列均来源于 GenBank数据库,分别采用DNA MAN 6.0分析核酸序列、Clustal W 2.0分析氨基酸序列和MEGA 5.0分析树鼩与其他哺乳动物IL-2之间的亲缘关系,蛋白质三维结构的模建和分析则通过 Discovery Studio 和PyMOL 完成,信号肽和糖基化位点等则采用在线软件预测 (http://www.cbs.dk/services)。
2 结果
2.1 树鼩IL-2全长编码序列扩增
以经 ConA诱导培养的树鼩淋巴细胞总 RNA为材料,反转录后由梯度PCR克隆出长度465 bp的核酸片段。将树鼩IL-2 PCR产物经T/A克隆并双向测序,得到树鼩IL-2全长编码序列(GenBank登录号:KC170305),开放阅读框长度为465 bp,编码154个氨基酸(图1)。

图1 树鼩IL-2核苷酸序列及对应氨基酸Figure 1 Nucleotide sequences and corresponding amino acids of tree shrew IL-2
2.2 树鼩IL-2氨基酸序列分析
2.2.1 树鼩IL-2整体结构与亲缘关系分析
树鼩IL-2分子由154个氨基酸组成,属于分泌蛋白,具有一个潜在的N-糖基化位点(NVT),有2个与二硫键形成有关的半胱氨酸,整体结构与人IL-2相似 (图 2)。通过对树鼩与其他哺乳动物的IL-2核苷酸序列对比发现,其与人及恒河猴的同源性较高 (分别为 91%和 93%)。我们利用 BlastP 及Clustal W 2.0对树鼩与人 (NM_00586.3)、恒河猴(NM_001047130.3)、小鼠(NM_008366.3)、大鼠(NM_053836.1)、牛(NM_180997.1)及绵羊(NM_001009806.1)等哺乳动物的IL-2氨基酸序列进行比较分析 (图3),同样发现树鼩IL-2氨基酸序列与人及恒河猴同源性较高 (分别为80%及79%),而与大鼠、小鼠的同源性较低 (分别为61%及53%)。同时,我们利用MEGA5.0软件对树鼩和上述哺乳动物的IL-2进行亲缘关系分析并构建进化树,结果发现,树鼩与人及恒河猴处于同一分支,而与大鼠、小鼠距离较远,说明树鼩在进化关系上更接近于人和恒河猴 (图 3)。

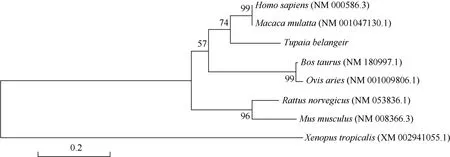
图3 树鼩和其他哺乳动物IL-2之间的亲缘关系 (bootstrap:10 000 replicates; method: Neighbour-Joining)Figure 3 Phylogenetic relationships of IL-2 chains from tree shrews and other mammals
2.2.2 树鼩IL-2蛋白三维建模及表面电荷分布分析人IL-2主要由五个α螺旋结构构成,存在一对二硫键,分别形成于Cys57和Cys105(Suzuki,2010)。通过Discovery Studio, 我们发现树鼩IL-2整体结构与人相似,在其结构域中,能找到相对应的二硫键(图4B)。同时,人IL-2分子中保守氨基酸残基Phe42和Tyr45能形成疏水域,也是与IL-2Rα相结合的区域,Asn88和Asp20之间可形成分子内氢键,也是与IL-2Rβ相结合的区域。其中,人IL-2分子中Asn88发生突变,会导致IL-2从IL-2-IL-2Rβ复合物上脱落, 而Ser127和Ser130残基形成的区域是其与IL-2R ɣ相结合的区域 (图4A),在我们所获得的树鼩IL-2结构域中的相应位置也可找到同样的区域 (图4B),推测其具有相对应的功能。
但是,在人IL-2结构中未发现N-糖基化位点,而树鼩 IL-2结构中有一个N-糖基化位点。同一参数下的三维结构比较显示,人IL-2结构中有5个α螺旋,而树鼩IL-2结构中有6个,且某一区域的不规则卷曲也存在差异 (图4C,D)。此外,我们对人与树鼩IL-2表面绝对电荷分布的分析表明,两者所带电荷基本相似,正、负电荷基本均等,但在某些区域,树鼩表面正电荷较少 (图4E,F)。树鼩IL-2分子中的 N-糖基化位点和表面电荷上与人 IL-2的差异可能影响其与其他蛋白分子的结合,这可能也解释了我们实验室使用鼠抗人 IL-2抗体不能与树鼩IL-2发生交叉反应的原因。

图4 人 (A、C、E) 和树鼩 (B、D、F) IL-2蛋白三维结构建模和表面绝对电荷比较Figure 4 Modeling of three-dimensional structures and surface charges of the domain of human (A,C,E) and tree shrew (B,D,F) IL-2 chains
3 讨论
本研究确定了树鼩IL-2基因全长编码序列,并对其蛋白的同源关系与结构域进行了分析。研究表明,树鼩IL-2 cDNA序列和相应的蛋白质结构与其它哺乳动物相近,其Phe42和Tyr45残基可形成疏水域,Asn88和Asp20之间可形成分子内氢键,根据已报道的人IL-2结构与功能文献 (Wang et al, 2005),推测这两个区域分别是与 IL-2Rα及 IL-2Rβ相结合的部位,而Gln127、Ser128和 Ser131残基形成的区域是与IL-2Rɣ相结合的区域,其中,Gln127与IL-2R ɣGln127及 Asn128之间可形成分子内氢键。另外,推测树鼩IL-2分子中 的Cys57和Cys106残基可形成二硫链,这对维持其蛋白结构及实现蛋白功能至关重要。但树鼩IL-2分子中具有一个人IL-2分子中所不具备的N-糖基化位点,结合糖基化在维持蛋白质与蛋白质之间结合中的作用 (Lis & Sharon,1993),推测树鼩 IL-2与其受体及抗体的结合能力更强。另外,α螺旋数目和表面电荷分布的明显差异仍有待对树鼩 IL-2结构与功能特点开展进一步分析。
Amako Y, Tsukiyama-Kohara K, Katsume A, Hirata Y, Sekiquchi S, Tobita Y, Hayashi Y, Hishima T, Funata N, Yonekawa M. 2010. Pathogenesis of hepatitis C virus infection in Tupaia belangeri. Journal of Virology, 84(1):303-311.
Bozkaya H, Bozdayi AM, Aslan N, Türkay C, Sarioglu M, Çetinkaya H,Akdogan M, Cinar K, Erden E, Kose K, Senturk H, Akkiz H, Karayalcin S,Yurdaydin C, Uzunalimoglu O. 2000. Circulating IL-2 and IL-10 in chronic active hepatitis C with respect to the response to IFN treatment. Infection,28(5): 309-313.
Cao J, Yang EB, Su JJ, Li Y, Chow P. 2003. The tree shrews: Adjuncts and alternatives to primates as models for biomedical research. Journal of Medical Primatology, 32(3): 123-130.
Church A C. 2003. Clinical advances in therapies targeting the interleukin-2 receptor. QJM: An International Journal of Medicine, 96(2): 91-102.
Fukuda R, Ishimura N, Ishara S, Chowdhury A, Morlyama N, Nogami C,Miyake T, Niigaki M, Tokuda A, Satoh S, Sakai S, Akagi S, Watanabe M,Fukumoto S. 1996. Intrahepatic expression of pro-inflammatory cytotine mRNA and interferon efficacy in chronic hepatitis C. Liver, 16: 390-399.
Gillis S, Union NA, Baker PE, Smith KA. 1979. The in vitro generation and sustained culture of nude mouse cytolytic T-lymphocytes. The Journal of Experimental Medicine, 149(6): 1460-1476.
Lenardo M J. 1991. Interleukin-2 programs mouse alpha beta T lymphocytes for apoptosis. Nature, 353(6347): 858-861.
Lis H, Sharon N. 1993. Protein glycosylation. Structural and functional aspects. European Journal of Biochemistry, 218(1): 1-27.
Morgan DA, Ruscetti FW, Gallo R. 1976. Selective in vitro growth of T lymphocytes from normal human bone marrows. Science, 193(4257):1007-1008.
Napoli J, Bishop GA, McGuinness PH, Painter DM, McCaughan GW. 1996.Progressive liver injury in chronic hepatitis C infection correlates with increased intrahepatic expression of Th1-associated cytokines. Hepatology,24(4): 759-765.
Novacek MJ. 1992. Mammalian phylogeny: shaking the tree. Nature,356(6365): 121-125.
Nie W, Fu B, O'Brien PC, Wang J, Su W, Tanomtong A, Volobouev V,Ferguson-Smith MA, Yang F. 2008. Flying lemurs—the‘flying tree shrews’?Molecular cytogenetic evidence for a Scandentia-Dermoptera sister clade.BMC biology, 6:18.
Shanafelt AB, Lin Y, Shanafelt MC, Forte CP, Dubois-Stringfellow N,Carter C, Gibbons JA, Cheng SL, Delaria KA, Fleischer R, Greve JM,Gundel R, Harris K, Kelly R, Koh B, Li Y, Lantz L, Mak P, Neyer L, Plym MJ, Roczniak S, Serban D, Thrift J, Tsuchiyama L, Wetzel M, Wong M,Zolotorev A. 2000. A T-cell-selective interleukin-2 mutein exhibits potent antitumor activity and is well tolerated in vivo. Nature Biotechnol, 18(11):1197-1202.
Suzuki S, Konnai S, Okagawa T, Githaka NW, Kariukit E, Gakuyat F,Kanduma E, Shirai T, Ikebuchi R, Ikenaka Y, Ishizuka M, Murata S, Ohashi K. 2012. Molecular cloning and characterization of Th1 and Th2 cytokines of African buffalo(Syncerus Caffer). International Journal of Immunogenetics, 39(2): 170-182.
Taniguchi T, Matsui H, Fujita T, Takaoka C, Kashima N, Yoshimoto R,Hamuro J. 1983. Structure and expression of a cloned cDNA for human interleukin-2. Nature, 302(5906): 305-310.
Theze J, Alzari PM, Bertoglio J. 1996. Interleukin 2 and its receptors: recent advances and new immunological functions. Immunology Today, 17(10):481-486.
Voss SD, Sondel PM, Robb RJ. 1992. Characterization of the interleukin-2 receptors(IL-2R) expressed on human nature killer cells activated in vivo by IL-2: association of the p64 IL-2R gamma chain with the IL-2R beta chain in functional intermediate-affinity IL-2R. The Journal of Experimental Medicine, 176(2): 531-541.
Wang HP, Zhou YX, Yao ZQ, Hong S, Li GY. 1997. The preliminary study of infection of major tupaia with hepatitis C virus. Journal of the Fourth Military Medical University, 18(4): 375-376. [王海平, 周永兴, 姚志强,洪沙, 李光玉. 1997. 成年树鼩实验感染丙型肝炎病毒的初步研究. 第四军医大学学报, 18(4): 375-376]
Wang X, Rickert M, Garcia KC. 2005. Structure of the quaternary complex of interleukin-2 with its α, β and γc receptors. Science, 310(5751):1159-1163.
Zelus D, Robinson-Rechavi M, Delacre M, Auriault C, Laudet V. 2000. Fast evolution of interleukin-2 in mammals and positive in ruminants. Journal of Molecular Evolution, 51(3): 234-244.
Zhao XP, Tian ZF, Chen YC, Yang C, Tian DY, Yang DL, Hao LJ. 2005.Infection of tupaia hepatocytes with hepatitis C virus in vitro. Chinese Journal of Hepatology, 13(11): 805-807. [赵西平, 田展飞, 陈义春, 杨春,田德英, 杨东亮, 郝连杰. 2005. 丙型肝炎病毒体外可感染树鼩肝细胞.中华肝脏病杂志, 13(11): 805-807.
