北平顶猴(Macaca leonina)血液学和血液生化指标参考值的测定与分析
2013-09-20吕龙宝黄东体雷爱华张高红郑永唐
庞 伟 ,吕龙宝 ,王 芸,李 贵,黄东体,雷爱华 , 张高红,郑永唐*
1. 中国科学院和云南省动物模型与人类疾病机理重点实验室,中国科学院昆明动物研究所,云南 昆明 650223
2. 中国科学院昆明灵长类研究中心,中国科学院昆明动物研究所,云南 昆明 650223
3. 中国科学院大学,北京 100049
平顶猴 (pig-tailed macaque, Macaca nemestrina group),又称“豚尾猴”或“猪尾猴”。因头顶平而有一毛旋,尾巴形似猪尾而得名。1992年,美国华盛顿大学国家灵长类研究中心Agy et al (1992) 发现平顶猴可感染HIV-1病毒,是潜在的艾滋病模型动物。目前,平顶猴已和恒河猴 (rhesus macaques,Macaca mulatta)、食蟹猴 (cynomolgus macaques,Macaca fascicularis) 一起,发展成为最常用的非人灵长类艾滋病实验动物 (Hatziioannou & Evans,2012)。在旧大陆猴中,与恒河猴和食蟹猴相比,平顶猴的优点在于能急性感染 HIV-1且对某些SIV/SHIV更易感 (Lei et al, 2013)。而且,平顶猴生殖道组织结构及月经周期与人很相似,全年均可繁殖,非常适合作为性传播疾病模型动物模型 (Patton et al, 2009)。此外,在神经 (Hukkanen et al, 2006)、认知 (Macellini et al, 2010) 和药物代谢 (Weed et al, 2008) 等研究领域,平顶猴也得到了越来越多的应用。
随着平顶猴在生物医学研究中的广泛应用,其分类地位也得到重视。2001年,根据地理隔离造成的种群分离及形态学区别,分类学家将平顶猴 (M.nemestrina group) 原来的3个亚种提升为猕猴属的3个种:明打威猴 (Mentawai macaques, M. pagensis)、巽他平顶猴或南平顶猴 (Sunda pig-tailed macaque or Southern pig-tailed macaque, M. nemestrina) 和北平顶猴 (northern pig-tailed macaque, M. leonina)(Gippoliti et al, 2001; Groves et al, 2001)。明打威猴分布于印尼以及苏门达腊岛南部的明打威群岛,北平顶猴和南平顶猴在东南亚国家和南亚国家广泛分布,以N8°30′为界,以北为北平顶猴,以南为南平顶猴,中间稍有分布重叠 (Malaivijitnond et al,2012),而我国分布的平顶猴为北平顶猴。
目前,缺少对HIV-1易感的动物模型仍然是制约人类对抗HIV/AIDS的一大瓶颈。2007年,我们实验室首次发现北平顶猴不表达限制HIV-1复制的TRIM5α蛋白,而TRIM5α与亲环蛋白A (cyclophilin A ) 形成TRIM5-CypA融合基因,且该融合基因产物不限制HIV-1的复制,阐明了平顶猴对HIV-1易感的分子机制,同时也在细胞水平上也证实了北平顶猴是较理想的艾滋病模型动物 (Cao et al, 2012;Kuang et al, 2009; Liao et al, 2007)。随后, 国际上多个实验室证实了我们的实验结果, 并相继在同属于旧大陆猴的巽他平顶猴、食蟹猴、印度恒河猴和熊猴中也发现存在TRIMCyp融合基因 (Brennan et al,2008; Cao et al, 2011; Newman et al, 2008; Virgen et al, 2008; Wilson et al, 2008)。因此,北平顶猴可能是较理想的HIV感染模型动物。
野生北平顶猴在我国分布较少,主要栖息于云南西南部和西藏东南部,是国家I级重点保护灵长类动物。在国外广泛分布于缅甸、越南、泰国、马来半岛和印度支那等东南亚和南亚地区。我国各实验动物饲养中心也无北平顶猴规模化繁殖饲养种群,从而制约了北平顶猴作为实验动物的使用。2012年,中国科学院昆明动物研究所/中国科学院昆明灵长类研究中心从越南引进了一批北平顶猴。由于至今尚无北平顶猴血液学和血液生化指标参考值的报道,因此,在本研究中,我们对北平顶猴血液学和血液生化指标进行测定,同时分析和比较了在不同年龄阶段下和不同性别间北平顶猴血液学和血液生化指标的差异, 这些数据将为建立北平顶猴实验动物模型提供血液学指标的正常参考值范围。
1 材料与方法
1.1 实验动物
本研究所用北平顶猴引进自越南胡志明市某猴饲养中心。其北平顶猴为人工饲养群。引进中国后,在云南省元江猴场单笼饲养,经检疫无病原微生物及寄生虫感染。渡过检疫期45 d后,运至中国科学院昆明灵长类中心单笼饲养适应环境1个月。实验动物许可证号:SYXK(滇)2008-0001,国家重点保护野生动物驯养繁殖许可证号:滇发驯繁 92-29号。猴群均采用膨化饲料喂养,自由饮水。按文献报道的猴群年龄分类方法 (Dai et al, 2000;Haberthur et al, 2010),将猴群分为青幼年组 (2~4 a)和成年组 (5~10 a)。各年龄组按性别分类统计。
1.2 血样采集和体重称量
在北平顶猴清醒状态下,清晨空腹后肢静脉采取乙二胺乙酸二钾 (EDTA-K2) 抗凝血1 mL,非抗凝血2~3 mL。全血凝结后,2 500 r/mim离心20 min分离血清待用。抗凝血用于检测血液学指标,血清用于检测血液生化指标。采血后,用网兜固定猴体称量体重。
1.3 血液学指标检测方法
应用迈瑞 BC-2800vet全自动动物血液细胞分析仪测定白细胞数 (white blood cell, WBC)、淋巴细胞数 (lymphocyte, Lymph)、单核细胞数(monocytes, Mon)、粒细胞数 (granulocyte, Gran)、淋巴细胞百分比(Lymph%)、单核细胞百分比(Mon%)、粒细胞百分比 (Gran%)、红细胞数 (red blood cell, RBC)、血红蛋白 (hemoglobin, HGB)、红细胞压积 (hematocrit, HCT)、平均红细胞体积(mean corpuscular volume, MCV)、平均血红蛋白含量 (mean corpuscular hemoglobin, MCH)、平均血红蛋白浓度(mean corpuscular hemoglobin concentration, MCHC)、红细胞分布宽度变异系数(red cell distribution width, RDW)、血小板数(Platelet, PLT)、平均血小板体积 (mean platelet volume, MPV)、血小板分布宽度 (platelet distribution width, PDW)和血小板压积(platelet hematocrit, PCT)。
1.4 血液生化指标检测方法
采用罗氏 COMBAS INTEGAR 400 plus 全自动生化仪测定血清中的白蛋白 (albumin)、碱性磷酸酶 (alkaline phosphatase)、丙氨酸转氨酶 (alanine aminotransferase)、天冬氨酸转氨酶(aspartate aminotransferase)、肌酐 (creatinine)、钙 (calcium)、胆固醇 (cholesterol)、肌酸激酶 (creatine kinase)、葡萄糖 (glucose)、总胆红素 (total bilirubin)、总蛋白 (total protein)、甘油三酯 (triglycerides) 和尿素氮 (urea nitrogen)含量。
1.5 统计学分析
使用 SPSS19.0统计学软件进行统计学分析。首先,检测各组数据是否符合正态分布,正态分布实验数据以mean±SD表示,采用独立样本t-test比较各测定组间差异,采用单样本 t-test比较同年龄段北平顶猴与恒河猴或食蟹猴各测定组的差异。以年龄和性别为控制变量,以体重和各检测项目值为变量,采用偏相关分析各年龄组体重对各检测项目值的影响。非正态分布实验数据以中位数±四分位数间距表示,采用非参数检验中的 Mann-Whitney检验比较含非正态分布的实验数据的各测定组间差异。
2 结果
2.1 青幼年北平顶猴血液学指标参考值检测及其分析
2~4 a青幼年北平顶猴的血液学指标参考值及范围见表 1。在青幼年北平顶猴中,除雌性个体红细胞数低于雄性个体外 (P=0.027),其他检测影响雌、雄间差异不明显。去除年龄和性别的影响后,体重对青幼年北平顶猴血液学指标的影响也不显著,仅平均血红蛋白含量与体重相关性有统计学意义 (R=0.39; P=0.0040)。
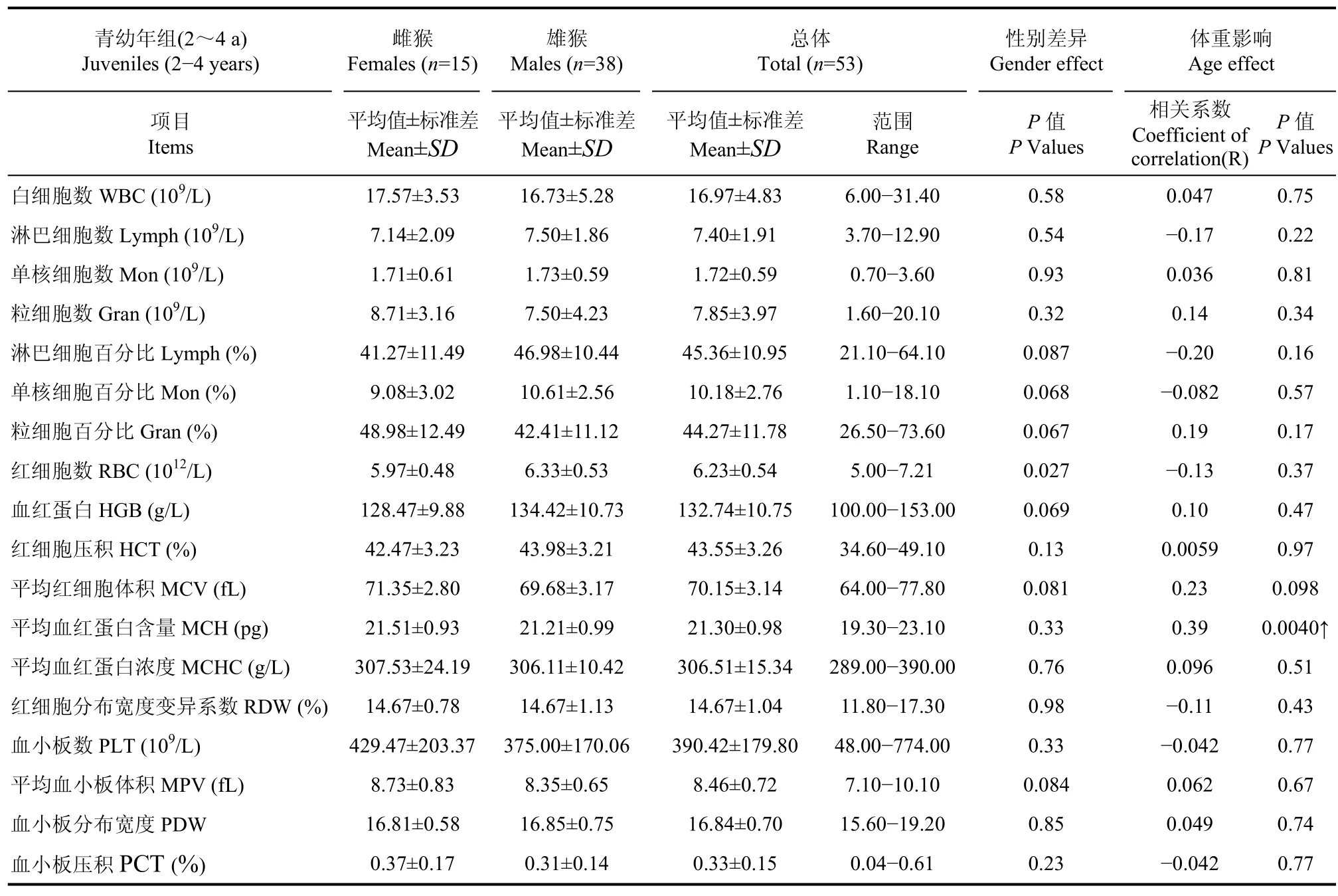
表1 青幼年(2~4 a)北平顶猴不同性别间血液学指标正常值参考范围Table 1 Normal hematology values in female and male juvenile northern pig-tailed macaques aged 2-4 years
2.2 青幼年北平顶猴血液生化指标参考值检测及其分析
2~4 a青幼年北平顶猴的血液生化指标参考值及范围见表 2。在青幼年北平顶猴中,血液生化指标雌、雄间差异较大:雌性猴个体的丙氨酸转氨酶(P=0.013)和总胆红素 (P=0.018)高于雄性个体,而碱性磷酸酶 (P=0.00036)、胆固醇 (P=0.031)、肌酐(P=0.024)、钙 (P=0.016)和白蛋白 (P=0.050)等则低于雄性个体,其中碱性磷酸酶在雌、雄之间差异极显著,其他检测指标差异不明显。去除年龄和性别的影响后,体重对青幼年北平顶猴血液生化指标的影响不显著,仅肌酐与体重明显正相关 (R=0.31;P=0.038)。细胞分布宽度变异系数 (R=-0.34; P=0.015)与体重负相关。
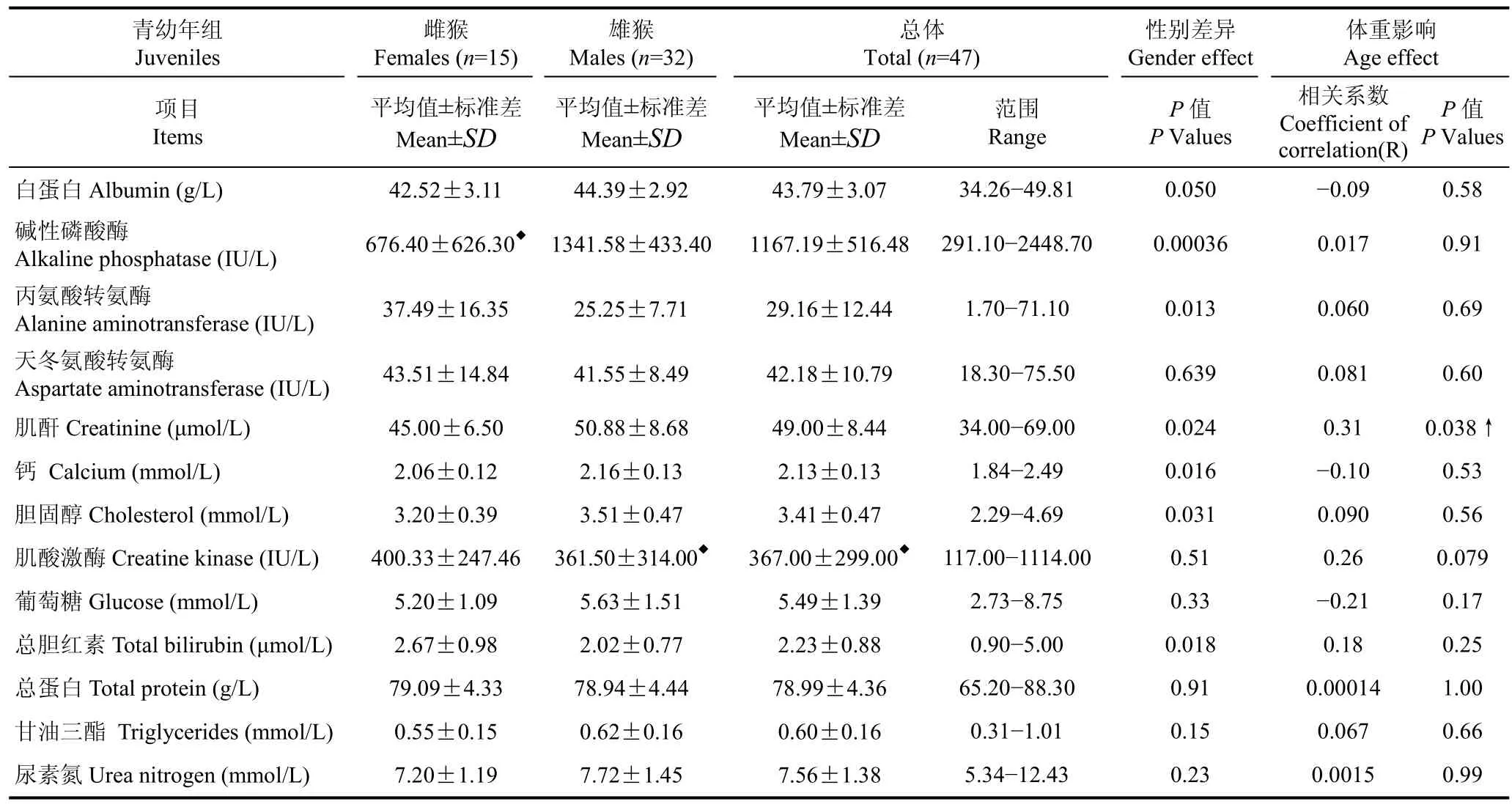
表2 青幼年(2~4 a)北平顶猴不同性别间血液生化指标正常值参考范围Table 2 Normal blood chemistry parameter values in juvenile northern pig-tailed macaques aged 2-4 years
2.3 成年北平顶猴血液学指标参考值检测及其分析
5~10 a成年北平顶猴的血液学指标及范围见表 3。在成年北平顶猴中,雌性个体的红细胞数(P=0.0054)、血红蛋白 (P=0.00068)和红细胞压积(P=0.0046)等明显低于雄性个体。去除年龄和性别的影响后,平均血红蛋白含量 (R=0.36; P=0.010)、粒细胞百分比(R=0.31; P=0.026)和血红蛋白(R=0.31;P=0.027)与体重正相关,而淋巴细胞数(R=-0.32;P=0.022)、淋巴细胞百分比(R=-0.28; P=0.043)和红

表3 成年(5~10 a)北平顶猴不同性别间血液学指标正常值参考范围Table 3 Normal hematology values in female and male adult northern pig-tailed macaques aged 5-10 years.
2.4 成年北平顶猴血液生化指标参考值检测及其分析
5~10 a成年北平顶猴的血液生化指标见表4。在成年北平顶猴中,雌性个体的尿素氮略高于雄性个体 (P=0.036),白蛋白略低于雄性个体(P=0.016),肌酸激酶 (P=0.000088)和碱性磷酸酶(P=0.0000062)明显低于雄性个体。去除年龄和性别的影响后,肌酐与体重明显正相关(R=0.43;P=0.0017),而天冬氨酸转氨酶 (R=-0.37; P=0.0069)和胆固醇 (R=-0.41; P=0.0026)与体重负相关。

表4 成年(5~10岁)北平顶猴不同性别间血液生化指标正常值参考范围Table 4 Normal blood chemistry parameter values in adult northern pig-tailed macaques aged 5-10 years.
2.5 青幼年与成年北平顶猴血液学指标的比较
比较青幼年与成年北平顶猴总体的血液指标可见,年龄对北平顶猴血液学指标的影响主要体现为免疫细胞的差异。成年北平顶猴的白细胞数(P=0.0011)、淋巴细胞数 (P=0.00094)、单核细胞数(P=0.000068)和血小板分布宽度 (P=0.0036)均极显著低于青幼年猴。
2.6 青幼年与成年北平顶猴血液生化指标的比较
比较青幼年与成年北平顶猴血液生化指标可见,成年北平顶猴的碱性磷酸酶 (P=0.000000039)、天冬氨酸转氨酶 (P=0.00010)和胆固醇 (P=0.00051)等均极显著低于青幼年猴。而肌酐 (P=0.0024)和甘油三酯 (P=0.040)则高于青幼年猴。该结果说明年龄同样是影响北平顶猴血液生化指标的重要因素。
3 讨论
随着生物医学研究的发展,对实验动物的要求也愈加严格。实验动物的标准化和背景清晰化直接影响诸多研究领域的确立和对实验结果的评价。目前,平顶猴已成为广泛应用的非人灵长类实验动物。但是,大多数关于平顶猴的研究报道对其种类和来源均无描述 (Moss et al, 2012; Balagopal et al,2012),直接影响了后续研究的标准化和连续性。而且,对平顶猴的部分生物学特征的研究尚处于起步阶段 (Reeves & Fultz, 2008),对广泛分布于东南亚国家和地区的北平顶猴的基础生物学特征研究则尚属空白 (Malaivijitnond et al, 2012)。
我国和周边国家分布的平顶猴群为北平顶猴,在将其发展成为实验动物时,有必要对其遗传及生理生化基础指标进行测定和研究。血液是机体的主要运输和物质交换系统,具有维持机体内环境稳定的功能,血液学指标是反映机体状况的重要标志。血液生理生化值能在一定程度上反映动物的代谢、生理机能状况及物种特征等。本研究首次测定了北平顶猴的18项血液学指标和13项血液生化指标参考值及范围,并对这些指标进行了统计学分析。
根据以往报道,年龄、性别和体重等都有可能影响猕猴的血液学和血液生化指标 (Schuurman &Smith 2005; Smucny et al, 2004)。我们将北平顶猴分为2~4 a的青幼年猴和5~10 a的成年猴,发现在各年龄段的北平顶猴中,性别间的血液学指标差异主要为红细胞和血红蛋白差异:雌性青幼年平顶猴的红细胞数显著低于雄性,血红蛋白和红细胞压积也低于雄性,但差异不明显;而雌性成年平顶猴的红细胞数、血红蛋白、红细胞压积和碱性磷酸酶等均极显著低于雄性。这与中国恒河猴和雌、雄食蟹猴间的差异一致 (Liu & Xie, 2012)。有报道称中国恒河猴和雌、雄食蟹猴间的淋巴细胞存在差异 (Lee et al, 2012; Liu & Xie, 2012),在北平顶猴中却未发现该差异。血液生化指标性别间的差异在青幼年北平顶猴中较大,而在成年北平顶猴中较小。这可能和青幼平顶猴不同性别间生长发育状态的不同有关。但在不同的年龄组中,雌性北平顶猴的碱性磷酸酶均显著低于雄性。已报道的雌、雄食蟹猴间也存在该差异,而且雌、雄食蟹猴间天冬氨酸转氨酶和丙氨酸转氨酶也存在显著差异 (Liu & Xie,2012),在北平顶猴中亦未观察到该差异。雌、雄中国恒河猴的碱性磷酸酶无差异 (Chen et al, 2009;Lee et al, 2012)。
不同年龄组的比较血液学指标表明,青幼年北平顶猴的各类白细胞数目和血小板分布宽度均高于成年个体,这与人类中儿童和成人的血常规差异一致。而Dai et al (2000)报道在不同年龄组的中国恒河猴中,青幼年与成年个体无明显差异,仅血小板分布宽度低于成年个体。这可能和猴子种类或实验方法及抽样误差等相关。另外,比较血液生化指标表明,成年北平顶猴的碱性磷酸酶、天冬氨酸转氨酶及胆固醇等均低于青幼年北平顶猴,在中国恒河猴中也存在该现象 (Dai et al, 2000)。但甘油三酯和肌氨酸酐在中国恒河猴中的结果却与北平顶猴相反,为成年猴低于青幼年猴。由于未查阅到青幼年与成年食蟹猴血液学和血液生化指标的数据,因此本文未比较其差异。
以往的报道均未分析除年龄和性别外,体重对猕猴血液学和生化指标的影响,我们发现,在青幼年北平顶猴中,体重因素只与平均血红蛋白含量和肌酐正相关,但在成年北平顶猴中,体重与多个血液学和血液生化指标相关。该结果提示在相关研究中,体重可能是需要考虑的因素。
此外,由于在性别间和不同年龄组中,北平顶猴的血液学和血液生化指标与中国恒河猴和食蟹猴的差异不同。因此,我们进一步选择均有报道的同年龄段的中国恒河猴 (Chen et al, 2009)和食蟹猴(Liu & Xie, 2012)与北平顶猴比较。发现在3~5 a的年龄段内,北平顶猴与中国恒河猴或食蟹猴的血液学和血液生化指标正常值差异较大,而中国恒河猴和食蟹猴之间的血液学和血液生化指标差异相对较小 (数据未列出)。北平顶猴与中国恒河猴比较,仅白细胞数、平均血红蛋白浓度、天冬氨酸转氨酶和葡萄糖等无明显差异,而与食蟹猴相比,仅血小板压积无明显差异。血液学指标相差最大的是单核细胞数和单核细胞百分比,北平顶猴的平均值高于中国恒河猴4倍,高于食蟹猴1.6倍。血液生化指标相差最大的碱性磷酸酶,北平顶猴的碱性磷酸酶平均值高于中国恒河猴和食蟹猴2倍,而丙氨酸转氨酶却低于两者1.6倍。也有其他研究通过Y染色体和线粒体的DNA进化分析,发现平顶猴在~500万年前就与恒河猴猴和食蟹猴产生了分歧,而恒河猴和食蟹猴则在 240万年后才出现分歧 (Tosi et al, 2000),这与血液学和血液生化指标结果一致。初步说明在猕猴属中,北平顶猴可能是一个相对于中国恒河猴和食蟹猴有较大差异的种群。
本实验得到的血液学和血液生化数据均来源于经检疫后的健康北平顶猴,在分析该群体后发现:(1) 性别间的差异主要体现为红细胞数、血红蛋白量和碱性磷酸酶等的不同,可能和雌、雄个体的运动和耗能不同相关;(2) 年龄间的差异则表现为免疫细胞和代谢酶类不同,其中,白细胞数、淋巴细胞数和单核细胞数等在成年后下降,可能和不同生长发育阶段中免疫系统成熟过程相关,而碱性磷酸酶和天冬氨酸转氨酶在成年后下降,则可能和青幼年猴生长过程中的较快代谢相关;3) 体重对成年猴的影响大于青幼年猴,可能与成年猴的营养状态、社会等级和遗传特性等有一定关联。因此,在今后的动物管理和实验动物选择中,应考虑这些因素对北平顶猴血液学的影响。另外,一些本研究未分析但需要提及的因素包括:(1) 由于该批猴均来源于越南,其产地和品系是否对其血液学数据有一定影响;(2) 该批猴为引进的人工饲养猴群,与我国野生北平顶猴相比,其生活环境及营养状态存在一定的差异。这些差异是否与群体间的血液学和血液生化数据相关,还有待进一步研究证实。总之,本文得到了不同年龄段内较大规模的北平顶猴血液学和血液生化正常参考值指标,并分析了年龄、性别和体重对这些指标的影响,为将来北平顶猴饲养管理中的疾病诊断和分析,实验动物数据库的建立及其疾病动物模型发展提供了参考数据。
Agy MB, Frumkin LR, Corey L, Coombs RW, Wolinsky SM, Koehler J,Morton WR, Katze MG. 1992. Infection of Macaca nemestrina by human immunodeficiency virus type-1. Science, 257(5066): 103-106.
Balagopal A, Gama L, Franco V, Russell JN, Quinn J, Higgins Y, Smeaton LM, Clements JE, Thomas DL, Gupta A; NWCS 319 and ACTG 5175 study team. 2012. Detection of microbial translocation in HIV and SIV infection using the Limulus amebocyte lysate assay is masked by serum and plasma.PLoS One, 7(8): e41258.
Brennan G, Kozyrev Y, Hu SL. 2008. TRIMCyp expression in Old World primates Macaca nemestrina and Macaca fascicularis. Proceedings of the National Academy of Sciences of the United States of America, 105(9):3569-3574.
Cao G, Liu FL, Zhang GH, Zheng YT. 2012. The primate TRIMCyp fusion genes and mechanism of restricting retroviruses replication. Zoological Research, 33(1): 99-107 [曹光, 刘丰亮, 张高红, 郑永唐. 2012. 灵长类动物中 TRIMCyp融合基因模式及对逆转录病毒复制的限制作用. 动物学研究, 33(1): 99-107].
Cao G, Nie WH, Liu FL, Kuang YQ, Wang JH, Su WT, Zheng YT. 2011.Identification of the TRIM5/TRIMCyp heterozygous genotype in Macaca assamensis. Zoological Research, 32(1): 40-49. [曹光, 佴文惠, 刘丰亮,况轶群, 王金焕, 苏伟婷, 郑永唐. 2011. 熊猴存在 TRIM5/TRIMCyp杂合子基因型. 动物学研究, 2011, 32(1): 40-49.]
Chen Y, Qin S, Ding Y, Wei L, Zhang J, Li H, Bu H, Lu Y, Cheng J. 2009.Reference values of clinical chemistry and hematology parameters in rhesus monkeys (Macaca mulatta). Xenotransplantation, 16(6): 496-501.
Dai J, Tang D, Lu S, Kuang D, Yang F, Cheng S, Huang R. 2000. Clinical normal values of hematology and serum biochemistry in domestically bred and reared rhesus monkeys. Acta Laboratorium Scientia Sinica, 8(4):224-230. [代解杰, 唐东红, 鲁帅尧, 匡德宣, 杨帆, 树军, 黄韧. 2000.人工饲养条件下恒河猴血液学、血液生化正常参考值测定及分析. 中国实验动物学报, 8(4): 224-230.]
Gippoliti S. 2001. Notes on the taxonomy of Macaca nemestrina leonina blyth, 1863 (Primates: Cercopithecidae). Hystrix, the Italian Journal of Mammalog, 12(1): 51-54.
Groves CP. 2001. Primate Taxonomy. Washington, DC, USA: Smithsonian Institution Press, 222-224.
Haberthur K, Engelman F, Barron A, Messaoudi I. 2010. Immune senescence in aged nonhuman primates. Experimental Gerontology, 45(9):655-661.
Hatziioannou T, Evans DT. 2012. Animal models for HIV/AIDS research.Nature Reviews Microbiology, 10(12): 852-867.
Hukkanen RR, Liggitt HD, Anderson DM, Kelley ST. 2006. Detection of systemic amyloidosis in the pig-tailed macaque (Macaca nemestrina).Comparative Medicine, 56(2): 119-127.
Kuang YQ, Tang X, Liu FL, Jiang XL, Zhang YP, Gao GX, Zheng YT. 2009.Genotyping of TRIM5 locus in northern pig-tailed macaques (Macaca leonina), a primate species susceptible to Human Immunodeficiency Virus type 1 infection. Retrovirology, 6(1): 58.
Lee JI, Shin JS, Lee JE, Jung WY, Lee G, Kim MS, Park CG, Kim SJ. 2012.Reference values of hematology, chemistry, electrolytes, blood gas,coagulation time, and urinalysis in the Chinese rhesus macaques (Macaca mulatta). Xenotransplantation, 19(4): 244-248.
Lei AH, Pang W, Zhang GH, Zheng YT. 2013. The use and research of pigtailed macaques for AIDS nonhuman primate models: An overview.Zoological Research, 34(2): 77-88. [雷爱华, 庞伟, 张高红, 郑永唐. 2013.平顶猴在HIV/AIDS动物模型中的应用及研究进展. 动物学研究, 34(2):77-88.]
Liao CH, Kuang YQ, Liu HL, Zheng YT, Su B. 2007. A novel fusion gene,TRIM5-Cyclophilin A in the pig-tailed macaque determines its susceptibility to HIV-1 infection. AIDS, 21(Suppl 8): S19-S26.
Liu SG, Xie L. 2012. Measurement of hematological and serum biochemical parameters in feeding population of cynomolgus monkey in Eastern China.Laboratory Animal Science, 2(4): 34-37. [刘仕刚, 谢亮. 2012. 华东地区人工饲养食蟹猴血液常规和血清生化值的测定. 实验动物科学, 2(4):34-37.]
Macellini S, Ferrari PF, Bonini L, Fogassi L, Paukner A. 2010. A modified mark test for own-body recognition in pig-tailed macaques (Macaca nemestrina). Animal Cognition, 13(4): 631-639.
Malaivijitnond S, Arsaithamkul V, Tanaka H, Pomchote P, Jaroenporn S,Suryobroto B, Hamada Y. 2012. Boundary zone between northern and southern pig-tailed macaques and their morphological differences. Primates,53(4): 377-389.
Moss JA, Malone AM, Smith TJ, Butkyavichene I, Cortez C, Gilman J,Kennedy S, Kopin E, Nguyen C, Sinha P, Hendry RM, Guenthner P, Holder A, Martin A, McNicholl J, Mitchell J, Pau CP, Srinivasan P, Smith JM,Baum MM. 2012. Safety and pharmacokinetics of intravaginal rings delivering tenofovir in pig-tailed macaques. Antimicrobial Agents and Chemotherapy, 56(11): 5952-5960.
Newman RM, Hall L, Kirmaier A, Pozzi LA, Pery E, Farzan M, O'Neil SP,Johnson W. 2008. Evolution of a TRIM5-CypA splice isoform in old world monkeys. PLoS Pathogens, 4(2): e1000003.
Patton DL, Sweeney YT, Paul KJ. 2009. A summary of preclinical topical microbicide rectal safety and efficacy evaluations in a pigtailed macaque model. Sexually Transmitted Diseases, 36(6): 350-356.
Reeves RK, Fultz PN. 2008. Characterization of plasmacytoid dendritic cells in bone marrow of pig-tailed macaques. Clinical and Vaccine Immunology, 15(1): 35-41.
Schuurman HJ, Smith HT. 2005. Reference values for clinical chemistry and clinical hematology parameters in cynomolgus monkeys.Xenotransplantation, 12(1): 72-75.
Smucny DA, Allison DB, Ingram DK, Roth GS, Kemnitz JW, Kohama SG,Lane MA, Black A. 2004. Changes in blood chemistry and hematology variables during aging in captive rhesus macaques (Macaca mulatta).Journal of Medical Primatology, 33(1): 48-54.
Tosi AJ, Morales JC, Melnick DJ. 2000. Comparison of Y chromosome and mtDNA phylogenies leads to unique inferences of macaque evolutionary history. Molecular Phylogenetics and Evolution, 17(2): 133-144.
Virgen CA, Kratovac Z, Bieniasz PD, Hatziioannou T. 2008. Independent genesis of chimeric TRIM5-cyclophilin proteins in two primate species.Proceedings of the National Academy of Sciences of the United States of America, 105(9): 3563-3568.
Weed MR, Wilcox KM, Ator NA, Hienz RD. 2008. Consistent, high-level ethanol consumption in pig-tailed macaques via a multiple-session, limitedintake, oral self-dosing procedure. Alcoholism: Clinical Experimental Research, 32(6): 942-951.
Wilson SJ, Webb BL, Ylinen LM, Verschoor E, Heeney JL, Towers GJ.2008. Independent evolution of an antiviral TRIMCyp in rhesus macaques.Proceedings of the National Academy of Sciences of the United States of America, 105(9): 3557-3562.
