橙黄决明素的制备及其与牛血清白蛋白的相互作用
2013-09-19寇自农徐龙权
寇自农,徐龙权
(大连工业大学 现代教育技术部,辽宁 大连 116034)
0 引 言
橙黄决明素(Aurantio-obtusin)是豆科植物决明子(CassiaobtusifoliaL.)或小决明子(CassiatoraL.)中的一种蒽醌类化合物[1-3],被《中国药典》确定为决明子药材TLC、HPLC检测主要标示物,具有降血脂、降血糖等药理活性。外源化合物和血清白蛋白相互作用是实现药物运输和发挥药效的主要方式。荧光光谱法已经被用来研究黄芩苷、茜素、丹参素、丹酚酸A、橙皮苷等与牛和人血清白蛋白的相互作用[4-7]。探讨橙黄决明素与血清白蛋白的相互作用,对于阐述橙黄决明素的药物作用机理具有重要意义。本文采用硅胶真空液相层析从决明子中分离制备橙黄决明素,根据化合物的理化性质和波谱数据鉴定其化学结构。采用荧光光谱法研究橙黄决明素和牛血清白蛋白的相互作用,评价橙黄决明素和牛血清白蛋白的结合及其特性。
1 实 验
1.1 仪器与试剂
JC-84多功能提取罐;真空液相层析柱;X-5型显微熔点仪;UltiMate3000高效液相色谱;UPLC-QTOF-MS 液 质 联 用 仪;C13-NMR、H1-NMR,瑞士 Bruker,400MHz;LS-55荧光光谱仪;LAMBDA 35紫外-可见分光光度计;pHS-3C型酸度计;旋转蒸发仪。
决明子药材,四川温江;薄层硅胶板GF254;层析硅胶,青岛海洋化工厂;乙腈,色谱纯;磷酸、氨水、硫酸,分析纯,天津市科密欧化学试剂公司;丙酮、氯仿、石油醚、乙酸乙酯,工业级。决明子药材经鉴定为豆科植物决明CassiaobtusifoliaL.干燥种子。橙黄决明素溶液:橙黄决明素用95%的乙醇溶解,用水稀释成2.5×104mol/L的贮备液;牛血清白蛋白,Sigma公司,纯度>95%,用pH 7.4的Tris-HCl缓冲溶液配制成5.0×10-5mol/L贮备液;水为二次蒸馏水。
1.2 方 法
1.2.1 HPLC与TLC分析条件
Hypersil ODS2色谱柱(250mm×4.6mm,5μm),大连依利特分析仪器公司;流动相,A为乙腈,B为0.1%磷酸水溶液;流动相梯度,0~30min(25%A),30~60min(25% ~70%A),60~70min(70% ~100%A);体 积 流 量,1.0mL/min;检测波长,280nm[3];UPLC-QTOF/MS 分 析,色 谱 柱 BEH-C18(100mm ×2.1mm,1.7μm);体积流量,0.25mL/min。流动相,乙腈(A)和0.1%甲酸水(B);梯度洗脱,0~60min,0~100%A;正离子模式检测,氮气作雾化气,氩气作碰撞气;毛细管电压,±3kV;离子源温度,120℃;毛细管温度,350℃;脱溶剂气体积流量,800L/h,锥孔气体积流量,50L/h;锥孔电压,正离子35V;正离子能量,25~50eV;质谱检测扫描范围(m/z),100~1 000;TLC展开剂,V(石油醚)∶V(丙酮)=3∶1,氨气熏蒸显色[8]。
1.2.2 提取与分离
20kg决明子药材用80L甲醇回流提取3次,得到甲醇提取物。将提取物溶入20L4%硫酸水溶液,90℃水浴加热水解4h,用20L乙酸乙酯萃取3次,得到橙黄决明素粗提物。粗提物在硅胶真空液相层析柱上以氯仿洗脱,TLC检测收集含橙黄决明素部分,合并浓缩;第2次真空液相层析分离用V(石油醚)∶V(丙酮)=100∶0~9∶1梯度洗脱,TLC检测收集橙黄决明素部分,合并蒸干得到橙黄决明素。将橙黄决明素用V(石油醚)∶V(丙酮)=9∶1溶液重结晶得到纯品。
1.2.3 结构鉴定
用显微熔点仪测定样品熔点。UPLCQTOF-MS和 NMR 测定样品分子质量。用C13-NMR、H1-NMR谱,鉴定化合物的结构[1]。
1.2.4 光谱分析
在10mL刻度试管中依次加入0.5mL 5.0×10-5mol/L的BSA溶液和0.05~0.35mL 2.5×10-4mol/L的橙黄决明素溶液,用pH 7.4的Tris-HCl缓冲溶液稀释定容至5mL。分别在25、37、47℃3种温度下恒温10min,扫描各个温度下的荧光光谱、同步荧光光谱和三维荧光光谱;在10mL刻度试管中分别加入0.5mL 5.0×10-5mol/L BSA溶液,依次加入0.1~0.3mL 2.5×10-4mol/L橙黄决明素溶液,用pH 7.4的Tris-HCl缓冲溶液稀释定容至5mL,摇匀。在紫外分光光度计上进行紫外光谱扫描。
2 结果与讨论
2.1 提取与分离
20kg决明子药材经甲醇提取、硫酸水溶液水解、乙酸乙酯萃取后得到橙黄决明素粗提物3kg。HPLC分析甲醇提取物和水解物的色谱图如图1所示。结果表明,水解后强极性化合物明显减少,橙黄决明素含量明显提高,应该是橙黄决明素苷在酸性条件下水解为橙黄决明素。采用水解-萃取的方法有利于提高橙黄决明素的提取得率。
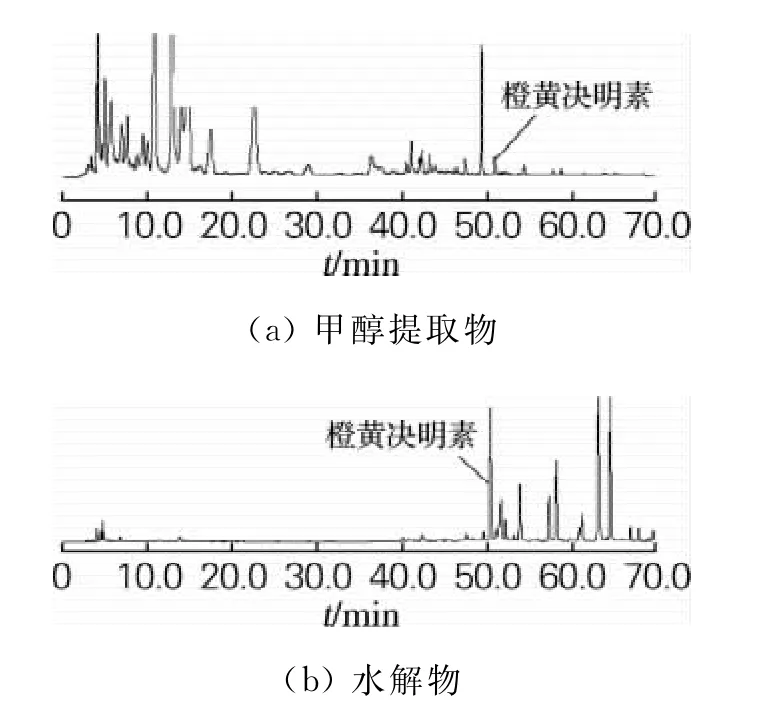
图1 决明子甲醇提取及水解物液相色谱图Fig.1 HPLC chromatogram of methanol extract and extract hydrolysate fromCassia obtusifolia L.
粗提物分别采用氯仿-丙酮和石油醚-丙酮体系作为洗脱剂,以硅胶真空液相层析法进行二次分离,得到橙黄决明素粗品10.5g。V(石油醚)∶V(丙酮)=9∶1溶液进行重结晶,干燥后得到橙黄决明素8.2g。
2.2 结构鉴定
橙黄色结晶(石油醚-丙酮),mp 242~243℃。ESI-MSm/z:331.067 1([M+H]+);1H-NMR(ACETONE-d6,400MHz)δ:2.83(3H,s,6-CH3),3.97,3.94(3H,s,2,8-OCH3),7.87(1H,s,H-4),9.15(1H,brs,7-OH),9.36(1H,brs,3-OH),(1H,s,1-OH)。13C-NMR(ACETONE-d6,400MHz)δ:15.66(C-6),59.98,61.20(2,8-OCH3),107.29(C-5),111.88(C-9a),123.83(C-8a),125.91(C-4a),126.04(C-4),129.29(C-6),131.82(C-10a),139.44(C-2),147.18(C-7),155.15(C-3),156.20(C-1),157.19(C-8),180.43(C-10),187.80(C-9)。以上数据与文献[1]一致,确定化合物为橙黄决明素。
2.3 橙黄决明素对BSA荧光的猝灭作用
BSA中含有酪氨酸、色氨酸、苯丙氨酸等残基,激发波长280nm时,其发射光波长一般位于350nm附近,不同浓度橙黄决明素与BSA作用的荧光光谱图见图2。从图2可以看出,随着橙黄决明素浓度的增加,BSA荧光光谱荧光强度逐渐下降,但最大波长与峰形无明显的变化,说明橙黄决明素对BSA产生了荧光猝灭作用。
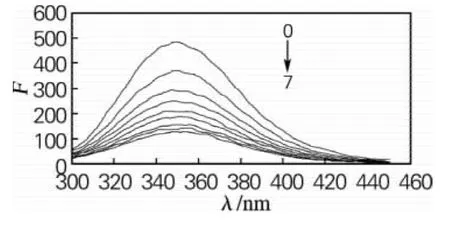
图2 橙黄决明素对BSA的荧光淬灭作用光谱图Fig.2 Fluorescence quenching spectra of aurantio-obtusin to BSA
2.4 橙黄决明素对BSA荧光的猝灭机理
荧光猝灭过程通常分为静态猝灭和动态猝灭。静态猝灭主要是荧光分子与猝灭剂之间形成了不发光的配合物,动态猝灭主要是荧光分子和猝灭剂分子之间相互碰撞的结果,其作用过程符合Stem-Volmer方程

式中:F0和F分别为不加和加入猝灭剂后蛋白的荧光强度;cA为猝灭剂浓度;Kq为扩散碰撞猝灭速率常数;τ0为无猝灭剂时荧光分了的荧光寿命,一般生物大分子的荧光寿命为10-8s;KSV为Stem-Volmer猝灭常数,其本质是双分子猝灭速率常数与单分子衰变速率常数的比率,反映了2种衰变途径之间的竞争。当不同温度下的KSV有明显变化时,其荧光猝灭应该是基于分子间相互碰撞的动态猝灭方式,反之则为静态猝灭。分别考察了25、37、47℃下不同浓度橙黄决明素BSA荧光强度的变化,以F0/F分别对橙黄决明素浓度cA曲线拟合的结果见图3。25、37、47℃3个温度下的Kq和KSV见表1。从图3和表1可以看出,随着温度的升高,3个温度条件下的Stem-Volmer方程得到猝灭常数KSV变化不明显,初步判断橙黄决明素对BSA荧光猝灭为静态猝灭,其猝灭速率常数Kq为1.412×1013L/(mol·s),远大于猝灭剂对生物大分子的最大碰撞猝灭常数2.0×1010L/(mol·s)[5],进一步证明橙黄决明素对BSA荧光不是由于动态碰撞引起,只能是静态猝灭方式。
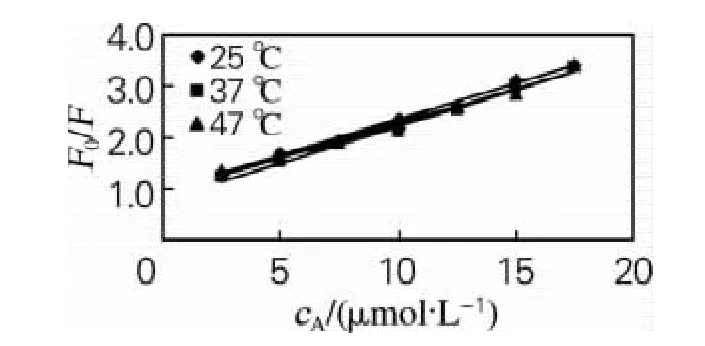
图3 橙黄决明素与BSA的Stem-Volmer曲线Fig.3 Stem-Volmer curves for the binding of aurantio-obtusin and BSA

表1 橙黄决明素与BSA作用的结合特性及热力学参数Tab.1 The binding property and thermodynamic parameters of aurantio-obtusin and BSA
BSA紫外吸收光谱随猝灭剂加入的变化也是研究猝灭机理重要方法,动态猝灭并不改变蛋白吸收光谱,静态猝灭由于生成基态配合物可能引起吸收光谱的变化。橙黄决明素对牛血清白蛋白紫外吸收光谱的影响见图4。

图4 橙黄决明素对牛血清白蛋白紫外吸收光谱的影响Fig.4 The effect of aurantio-obtusin on absorption spectrum of BSA
由图4可知,随着橙黄决明素的增加,BSA的218、280nm处特征吸收峰峰形与波长无明显变化,在315nm处新增加一个吸收峰,且吸收峰强度逐渐增大,可能是橙黄决明素与BSA结合形成了基态配合物,进一步证明了橙黄决明素对BSA的荧光猝灭为静态猝灭。
2.5 橙黄决明素与BSA结合特性和结合常数
对于静态猝灭,橙黄决明素与BSA结合常数和特性可以通过公式(2~4)来进行计算[5]。
采用不同温度下的lg[(F0-F)/F]对lgcA作图,直线截距和斜率分别为橙黄决明素与BSA分子间的结合常数Ka及结合位点数n。3个温度下方程式分别为:y=1.050 3x+5.376 3(R2=0.997 7,25℃);y=1.175 9x+5.952 0(R2=0.997 1,37℃);y=0.999 2x+5.104 7(R2=0.988 6,47℃)。计算结果见表1。从表1可以看出,橙黄决明素与BSA分子结合,其ΔH>0,ΔS>0,说明两者结合是疏水作用力,这与橙黄决明素是极性相对较弱的蒽醌类化合物有关;而ΔG<0,说明两者结合是一个自由能降低的自发过程。
2.6 橙黄决明素对牛血清白蛋白构象的影响
2.6.1 同步荧光谱的分析
药物分子对蛋白质构象的影响可采用同步荧光光谱分析。Δλ=15、60nm的同步荧光光谱分别显示蛋白质中酪氨酸(a)和色氨酸(b)残基的光谱特性。图5为橙黄决明素与BSA相互作用的同步荧光光谱,由图5可以看出,固定BSA浓度随着橙黄决明素的增加,酪氨酸、色氨酸残基的荧光猝灭效应明显,但色氨酸的发射波长没有明显变化,酪氨酸的发射波长由286nm向左蓝移至283nm。可能是橙黄决明素与酪氨酸的疏水性结合改变了其周围环境,提高了疏水性,引起了蛋白质构象的变化[5]。

图5 橙黄决明素与BSA相互作用的同步荧光光谱Fig.5 Synchronous fluorescence spectra of BSA in the presence of aurantio-obtusin
2.6.2 三维荧光光谱的分析
BSA和BSA加入猝灭剂的三维荧光光谱及等高线见图6。图6(a),(b)中的峰1(λex=λem)是溶液瑞利散射光谱,橙黄决明素加入前后,其强度变化不明显,说明橙黄决明素与BSA的结合并未影响蛋白分子的大小变化。由图(a),(b),(c),(d)均可以看到反映BSA酪氨酸和色氨酸残基的荧光峰2,主峰为λex/λem=281nm/350nm,次峰为λex/λem=230nm/340nm,峰2的主次峰强度在橙黄决明素加入后都明显减弱,说明橙黄决明素加入不仅使酪氨酸和色氨酸残基荧光发生了猝灭,其多肽骨架荧光λex/λem=230nm/340nm 荧光也有所降低。
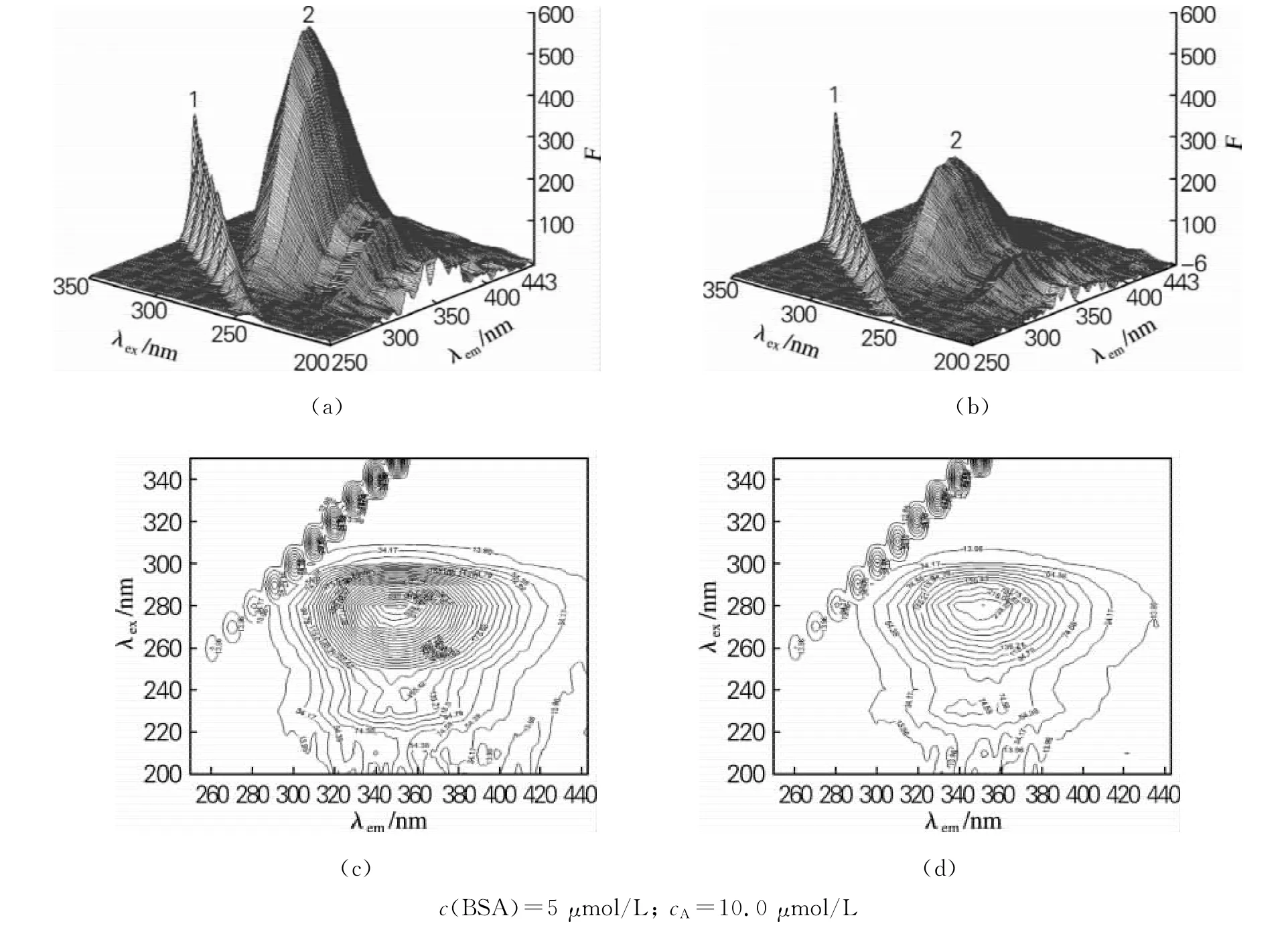
图6 BSA(a)、(c)与BSA-aurantio-obtusin(b)、(d)三维荧光光谱及等高线图Fig.6 Three-dimensional fluorescence and contour spectra of BSA (a),(c)and BSA-aurantio-obtusin(b),(d)
3 结 论
采用硅胶真空液相层析从决明子中分离制备了橙黄决明素。橙黄决明素对牛血清白蛋白有明显的荧光猝灭作用且荧光猝灭属于静态猝灭。橙黄决明素与牛血清白蛋白的结合位点数为1,与BSA之间的结合主要是以疏水作用力相结合的自发过程。橙黄决明素与牛血清白蛋白的酪氨酸的疏水性结合可能引起了蛋白质构象的变化,但牛血清白蛋白分子的大小并未有明显的变化。
[1]郝延军,桑育黎,赵余庆.决明子蒽醌类化学成分研究[J].中草药,2003,34(1):18-19.
[2]戴迎春,邓楠,刘文,等.决明子中橙黄决明素的提取、分离及纯化方法的研究[J].中南药学,2011,9(3):179-182.
[3]胡轶娟,朱军,万丽.决明子 HPLC指纹图谱研究[J].中国中医药科技,2008,15(5):365-367.
[4]刘彩虹,李玉琴,贾宝秀,等.黄芩苷与人血清白蛋白的相互作用研究[J].分析测试学报,2011,30(5):532-536.
[5]GE Feng,JIANG Lixiang,LIU Diqiu,et al.Interaction between alizarin and human serum albumin by fluorescence spectroscopy[J].Analytical Sciences,2011,27:79-84.
[6]张曦,寇自农,石羽佳,等.同步荧光光谱法研究丹参素-牛血清白蛋白体系的荧光增强效应[J].分析测试学报,2011,30(4):444-447.
[7]张曦,寇自农,石羽佳,等.丹酚酸A对牛血清白蛋白的荧光猝灭作用[J].大连工业大学学报,2012,31(2):95-97.(ZHANG Xi,KOU Zinong,SHI Yujia,et al.Fluorescence quench to bovine serum albumin by Sal A[J].Journal of Dalian Polytechnic University,2012,31(2):95-97.)
[8]胡轶娟,万丽,张加雄,等.决明子药材薄层色谱鉴别研究[J].时珍国医国药,2006,17(11):2129.
