嗜酸乳杆菌和嗜热链球菌混菌发酵合成共轭亚油酸的动力学
2013-09-19于田,王际辉,庞宇辰,叶淑红,肖珊,王晗
于 田,王 际 辉,庞 宇 辰,叶 淑 红,肖 珊,王 晗
(大连工业大学 辽宁省食品生物技术重点实验室,辽宁 大连 116034)
0 引 言
共轭亚油酸(Conjugated linoleic acid,CLA)是含有共轭双键的一系列亚油酸,由必需脂肪酸亚油酸衍生的共轭双烯的多种位置与几何异构体的总称[1]。CLA 在抗癌[2]、抗氧化[2-3]、降脂[4]和免疫调节[5-6]方面都有着很强的生物活性。CLA的合成法主要有2种,第1种是碱法异构化,目前主要采用此法,可实现大量生产,然而产物组成相对复杂,并不利于产品的研发与应用;第2种是微生物合成法,反应条件温和,优点是产物与天然食物中的CLA相似,主要具有c9,t11-CLA和10t,12c-CLA这2种生理活性的异构体,有利于产品的研发与应用。
微生物生长代谢过程相当复杂,想要建立分批发酵过程的机制模型几乎是没有可能的,而数学拟合模型建立起来相对简单并可通过分析验证,计算自动化也易于实现。通过模型的建立可以更好地了解微生物的代谢过程,寻找最佳发酵条件,提高产量。本研究利用益生菌嗜酸乳杆菌和嗜热链球菌混菌发酵合成CLA,对其发酵过程进行动力学研究,建立了动力学模型,并应用Ori-gin 8.0软件对数据拟合得到模型中参数,为放大实验数据,优化发酵工艺提供理论依据。
1 实 验
1.1 材料与仪器
1.1.1 菌 株
嗜热链球菌、嗜酸乳杆菌,大连工业大学食品学院实验室保藏菌株。
1.1.2 培养基
脱脂乳培养基:脱脂乳12%,经10min 115℃灭菌。
1.1.3 主要仪器与试剂
RE-52A型旋转蒸发仪;SG46-280S不锈钢手提式蒸汽灭菌锅;Phs-3C精密pH计;UV775B紫外分光光度计;伊利高蛋白脱脂高钙奶粉;红花籽油,食品级;Tween-80,食品级;CLA 标准品,Sigma公司;正己烷、甲醇、氯仿、无水硫酸钠,国产分析纯。
1.2 实验方法
1.2.1 红花油水解乳化液的制备
将亚油酸与Tween-80以质量比2∶1溶于去离子水中,使亚油酸终质量浓度为50mg/mL,加少量蒸馏水进行混合,然后进行超声乳化分散。超声条件是超声功率400W,工作5s,间歇5s,乳化15min,在冰水浴条件下进行。然后用0.22μm微孔滤膜对红花油水解乳化液过滤除菌,4℃保藏备用。
1.2.2 发酵方法
嗜酸乳杆菌和嗜热链球菌以1∶1、接种量3%、红花油水解乳化液添加量4%加入脱脂乳培养基,41℃恒温培养17h。
1.2.3 菌体干重
接种的发酵液离心分离后,经85℃烘干至恒重,与未接种发酵液的差值即为菌体干重。
1.2.4 CLA提取方法
经脱脂乳发酵后,向发酵乳中加入甲醇和氯仿混合物,V(甲醇)∶V(氯仿)=1∶2,经过10 000r/min、20min、4℃冷冻离心,下层的有机相收集起来。添加无水硫酸钠进行干燥,旋转蒸发仪在30℃条件下蒸发脱去溶剂,残余物再转移到螺口试管[7]。
1.2.5 CLA含量的测定
CLA吸收值在波长233nm处测定,然后进行标准曲线的绘制。得到标准曲线为y=0.179 1x+0.101 4,R2=0.999[8]。“1.2.4”中的提取物使用正己烷溶解,在波长233nm处进行检测,通过计算得到共轭亚油酸的含量。
1.3 计算工具软件
采用Origin 8.0进行非线性拟合[9]。
2 结果与讨论
2.1 CLA发酵过程动力学曲线
测定发酵过程中参数如图1所示。菌体生长:0~1h菌体生长缓慢,属于适应培养环境的阶段;从2h起进入对数生长期;8~10h菌体进入稳定期。合成CLA产物:0~7h合成速度缓慢;8h后加快合成产物速度;12h后快速合成产物CLA;14h时,CLA达到最大的合成速度。发酵液的pH:整个发酵过程pH呈下降趋势。从图1可以看出,在前8h主要是菌体的生长阶段,合成CLA的量很少,主要是因为亚油酸异构酶为诱导酶,它的产生需要一个过程,培养时间短酶活力较低;但是在8h之后,pH范围为4.7~5.5,菌体量相对稳定,CLA大量合成,因为此时环境pH为亚油酸异构酶的最适pH[10]。

图1 CLA发酵动力学曲线Fig.1 The kinetic curve of batch fermentation
2.2 菌体的生长动力学模型
通常描述菌体生长的模型是Monod方程[11],该模型适合细胞生长慢、密度低的情况。由图1可知,乳酸菌生长迅速、密度大不适于Monod方程,而适合于S型曲线,即Verhulst-Pearl提出的Logistic模型。在分批发酵过程中Logistic模型很好地反映出菌体浓度的增加,因此本实验采用Logistic模型描述并拟合菌体生长规律,即
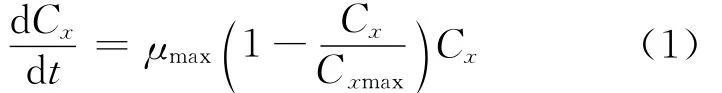
式(1)中:μmax为最大的生长速率;Cxmax为菌体的生长上限。
刚开始分批发酵,Cx/Cxmax忽略不计,因为菌体浓度Cx远小于Cxmax,方程(1)表示对数生长的菌体;菌体结束对数生长期进入稳定期,即Cx=Cxmax,方程(1)表示停止生长的菌体。在0~t,对方程(1)的两边分别积分,可以得到:
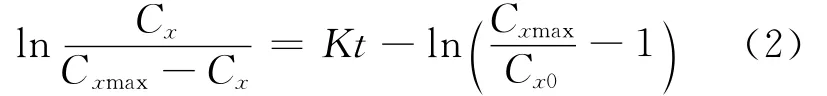
式(2)中:Cx0为初始菌体干重,mg/mL,本实验中测得Cx0=0.007mg/mL;Cxmax为最大菌体干重,mg/mL,本实验中测得Cxmax=1.105mg/mL。
将Cx0,Cxmax实验值带入公式(2),整理得:

利用最小二乘法,使残差平方和最小,即满足

式(4)中:M为实验数据组数;re为测定的实验值;rs为计算的模型值。
非线性拟合菌体生长动力学模型式(3)如图2得到拟合结果,拟合公式为y=1.105/[1+exp(5.06-Kx)],得到K=0.977 63。

图2 菌体的生长动力学模型曲线Fig.2 The kinetic model fitting curve of cell growth in the fermentation
如图2所示,微生物生长过程的实验点数据和菌体生长动力学模型数据都能较好的拟合,R2=0.985 09。因此,此模型可以作为以后放大实验的参考。
2.3 CLA产物合成动力学模型
目前还不能用统一的模型来描述代谢产物生成动力学,因为微生物的生长代谢是一个非常复杂的过程。通过研究产物的合成速率与细胞的生长速率的相互关系,细胞合成代谢产物的规律被Gaden分为3类[14]:
(1)相关模型:细胞的生长和产物的合成是相关的,基质的分解代谢产物通常就是产物。
(2)部分相关模型:产物合成和基质消耗是间接相关的。合成的产物是能量代谢的间接结果。
(3)非相关模型:产物合成和细胞生长无直接的关系。在细胞生长过程中,没有产物积累,停止细胞生长后,开始合成产物。
由发酵动力学曲线图1知,乳酸菌合成CLA过程是属于部分相关模型。Luedeking-Piret方程用于描述部分相关模型,动力学方程式可表示为:

式(5)中:a,b是合成产物动力学模型中的参数;是与菌体相关的产物的形成率;bCx是与非伴随菌体生长的产物的形成率。
对公式(3)左右两边分别求导,整理得:
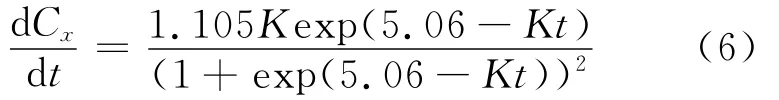
将公式(3)、(6)代入式(5),整理得:
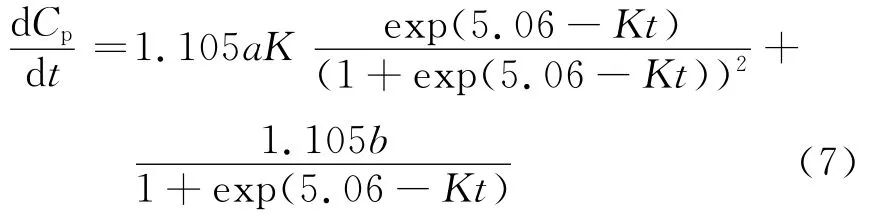
在0~t对方程(7)左右两边积分,整理得:
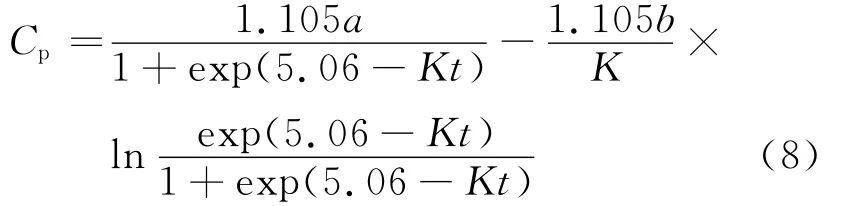
将K=0.977 63代入公式(8),整理得:

利用Origin 8.0软件非线性拟合菌体生长动力学模型式(9),如图3所示的拟合结果,同时由软件处理得到了拟合公式为:
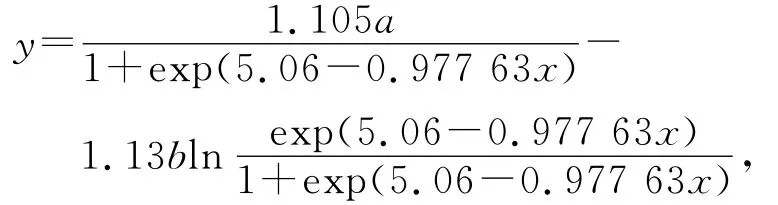
得到a=-15.862 58,b=8.262 57。
如图3所示,微生物合成CLA过程的大部分实验点的数据和CLA产物合成动力学模型的数据拟合较好,R2=0.986 75。因此,此模型可以作为以后放大实验的参考。
2.4模型拟合值与实验值的比较
利用Origin 8.0软件,通过发酵动力学模型数学表达式的建立,拟合得到模型参数值,可知在整个乳酸菌混菌发酵合成CLA的过程中随着时间的变化菌体量和CLA合成量的拟合值,结果如表1所示。

图3 CLA合成动力学模型的拟合曲线Fig.3 The kinetic model fitting curve of CLA producing

表1 发酵动力学模型计算值和实验值比较Tab.1 Comparison of computed and experimental data of fermentation kinetics model
从表1可知,实验值与拟合值基本接近,拟合情况较好,说明所建立的模型能较好地反映出嗜酸乳杆菌和嗜热链球菌混菌发酵合成CLA的过程。
3 结 论
研究了嗜酸乳杆菌和嗜热链球菌混菌合成CLA的发酵动力学,并通过Origin 8.0软件分析得到了菌体生长和CLA合成量两个动力学模型及其参数,相关系数R2分别为0.985 09和0.986 75,说明该模型基本上能够描述嗜酸乳杆菌和嗜热链球菌混菌合成CLA的发酵过程,可为实际工业化生产提供理论依据。
[1]林江,曾哲灵,熊涛.产共轭亚油酸微生物及发酵条件研究[J].江西科学,2008,26(1):165-168.
[2]HA Y L,GRIMM N K,PARIZA M W.Anticarcinogens from fried ground beef;heat-altered derivatives of linoleic acid[J].Carcinogenesis,1987,8(12):1881-1887.
[3]ZHANG A,CHEN Z Y.Oxidative stability of conjugated linoleic acid relative to other polyunsaturated fatty acid[J].Journal of the American Oil Chemists'Society,1997,74(12):1611-1613.
[4]刘莹,胡建民,富亮.共轭亚油酸的性质及其生理功能[J].畜禽业,2006(6):20-21.
[5]LAI Changhua,YIN Jingdong,LI Defa,et al.Effects of dietary conjugated linoleic acid supplementation on performance and immune function of weaned pigs[J].Archives of Animal Nutrition,2005,59(1):41-51.
[6]WHIGHAM L D,HIGBEE A,BJORLING D E,et al.Decreased antigen-induced eicosanoid release in conjugate linoleic acid-fed guinea pigs[J].American Journal of Physiology-Regulatory,Integrative and Comparative Physiology,2002,282(4):R1104-R1112.
[7]李鹏,叶淑红,王际辉,等.一株嗜酸乳杆菌产共轭亚油酸的条件优化[J].中国酿造,2009(12):56-58.
[8]张丽莉,王欢,穆春,等.一株干酪乳杆菌突变株固定化对共轭亚油酸生物合成的影响[J].食品科技,2009,34(4):34-37.
[9]余训爽.Origin 8.0软件在处理物理化学实验数据中的应用[J].长江大学学报,2010,7(3):300-302.
[10]顾思天.植物乳杆菌ZS2058中亚油酸异构的分离纯化及酶学性质的研究[D].无锡:江南大学,2008.
[11]戚以政,汪叔雄.生化反应动力学与反应器[M].2版.北京:化学工业出版,1999.
