经阴道彩色多普勒超声联合血清CA125监测卵巢癌新辅助化疗的疗效
2013-09-18YANGXue
杨 雪 YANG Xue
于 宁 YU Ning
李 翔 LI Xiang
卵巢癌是目前早期诊断率低而死亡率最高的妇科肿瘤。肿瘤细胞减灭术加以铂类和(或)紫杉醇为主的化疗是晚期卵巢癌的基本治疗模式。然而由于确诊时75%~80%的卵巢癌患者已属于晚期,肿瘤大且多发腹腔内多种组织器官广泛种植和远处转移,难以进行手术治疗[1]。随着治疗方法的不断改进,对此类患者术前给予1~3个疗程以铂类和(或)紫杉醇为主的化疗,可为手术创造有利条件,提高化疗后肿瘤细胞减灭术的切除率,从而改善患者预后。如何准确评价新辅助化疗的早期疗效是该领域的研究热点之一。本研究旨在探讨经阴道彩色多普勒血流显像(TV-CDFI)与血清CA125联合检测评价卵巢癌新辅助化疗疗效的价值。
1 资料与方法
1.1 研究对象 2010-03~2011-10青岛大学医学院附属医院收治60例卵巢癌患者,均为女性,均于化疗前经超声、CT、胸水和腹水细胞学检查、穿刺活检组织学证实为卵巢癌,纳入标准:病理学分期为Ⅲ、Ⅳ期,患者全身状况能耐受手术和化疗,以前未接受过相关治疗。患者年龄30~69岁,中位年龄53岁;Ⅲ期44例,Ⅳ期16例。全部患者均行以铂类和紫杉醇为主的化疗,1~3周期后复查超声。
1.2 仪器与方法 采用GE Logiq 9彩色多普勒超声诊断仪,E8C型号探头,探头频率4~9 MHz,超声检查时先确定原发灶的最大切面,并测量肿块原发灶体积(长×宽×厚×0.52),记录肿瘤的形态、边缘、数目、回声特征,肿瘤内部血流信号的形态、分布、最大血流速度(Vmax)及阻力指数(RI),然后叠加彩色多普勒,探查低速血流要求壁滤波50~100 Hz,低脉冲重复频率为1000 Hz左右。在噪声信号调至最小时取血管最丰富的断面进行彩色多普勒血流信号分析,测量血流参数时调整声束与血流入射夹角<60°,测量3次取平均值。常规经腹测量胸、腹水量。
1.3 化疗方案 主要为PT方案:顺铂(商品名诺欣,江苏豪森药业有限公司,批号100101)75 mg/m2,紫杉醇(商品名福王,扬子江药业集团有限公司,批号10010801)135 mg/m2,采用腹腔+静脉联合化疗,每3周为一周期,共完成2~3个周期,不超过3个周期。部分不能应用腹腔化疗者(PS评分较差者)采用紫杉醇135 mg/m2联合卡铂(批号9110102ES,江苏恒瑞医药公司),曲线下面积(AUC)=4~5静脉化疗。
1.4 新辅助化疗的适应证 绝对适应证[2]:①临床Ⅳ期(不包括胸腔积液);②估计重量>1 g的转移病灶由于转移的部位特殊(如转移至肝门、肠系膜上动脉)而无法达到完全减瘤者。相对适应证:①弥漫性腹膜转移(重量>100 g);②估计转移病变总重量超过1000 g;③有大的块状腹膜转移灶(重量>10 g);④大量腹水(>5 L);⑤WHO体能状况达2、3级。满足以上2条即可行新辅助化疗。
1.5 血清CA125检测 新辅助化疗前后分别抽取静脉血,采用微粒子捕捉免疫发光技术(MEIX)测定血清CA125水平。以CA125水平下降>50%判定为有效。
1.6 评估标准 根据术前超声检查结果及术后病理结果进行评定,采用WHO实体肿瘤化疗疗效评定标准[3]:完全缓解(CR):肿瘤完全消失;部分缓解(PR):肿块缩小50%以上;无变化(SD):肿瘤体积无变化;进展(PD):肿块体积增大或有新病灶出现。以CR+PR为有效。
1.7 统计学方法 采用SPSS 13.0软件,化疗前后原发灶体积及血流参数变化变化比较采用配对t检验,TV-CDFI、CA-125及二者联合对卵巢癌新辅助化疗疗效的诊断效能比较采用χ2检验,术前超声测量的残余癌最大直径与病理残余癌最大直径的相关性采用Pearson相关分析,P<0.05表示差异有统计学意义。
2 结果
2.1 病理检查结果 大体见卵巢肿块质地变软,体积缩小、甚至消失。镜下见化疗前卵巢癌组织中肿瘤细胞丰富;化疗后,化疗有效者卵巢癌组织中肿瘤细胞明显退变,可见凋亡细胞及坏死组织,肿瘤组织纤维化。
2.2 新辅助化疗前后原发灶体积变化及血供变化 与化疗前比较,新辅助化疗后超声测量原发灶体积明显缩小、Vmax显著降低、RI显著升高,差异有统计学意义(t=4.210、3.256、3.398, P<0.01),见表 1。

表1 新辅助化疗前后超声测量卵巢原发灶大小及血流参数变化
2.3 TV-CDFI诊断结果 术后病理证实化疗有效52例,TV-CDFI诊断阳性52例,其中真阳性44例,敏感性为84.6%(44/52),假阳性8例;无效8例,TV-CDFI诊断8例,其中真阴性7例,特异性为87.5%(7/8)。
2.4 血清CA125检测结果 52例化疗有效者中,36例表现为不同程度的CA125明显降低,敏感性为69.2%(36/52)。无效8例中,CA125真阴性6例,特异性为75.0%(6/8),CA125多为轻度降低。
2.5 TV-CDFI联合血清CA125评价卵巢癌新辅助化疗疗效的效能 TV-CDFI联合血清CA125检测,诊断真阳性47例,其敏感性为90.0%,诊断准确率亦提高到90.8%,较单独应用显著提高,差异有统计学意义(P<0.05),见表 2。

表2 TV-CDFI、CA125及二者联合检测对卵巢癌新辅助化疗的诊断效能(%)
2.6 手术指导 本组58例初诊时原发灶较大,体积约为(350.45±316.66)cm³,盆腔外转移,不具备手术条件。行新辅助化疗后,体积缩小为(203.11±194.53)cm³,均获得手术机会。术前超声测量的残余癌最大直径与病理残余癌最大直径呈显著正相关(r=0.879, P<0.01)见图1。
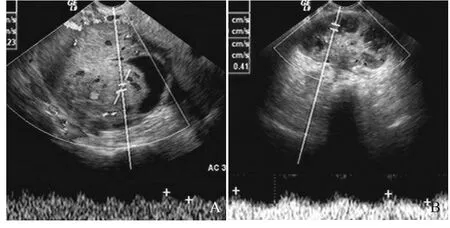
图1 A.化疗前,肿块体积较大,内部血流信号丰富,RI=0.23;B.化疗后,肿块体积缩小,血流丰富程度降低,RI=0.41
3 讨论
卵巢癌的常规治疗方式是最大限度的肿瘤细胞减灭术及术后辅助化疗,由于晚期卵巢癌具有易广泛盆腹腔转移、病灶固定及周围组织严重受侵等特点,直接行手术治疗往往困难较大且并发症多,很难达到理想的减瘤术效果。新辅助化疗可使肿瘤缩小、松动,腹水减少,消除远处转移灶,降低肿瘤分期,从而增加手术的可行性[4]。
因新辅助化疗的方式、疗程和化疗药物不同,患者对化疗药物的敏感程度不同,需要对新辅助化疗疗效进行评估,早期判断新辅助化疗疗效有利于发现对治疗无反应的顽固性肿瘤,及时调整治疗方案,减少化疗药物的毒副作用,改善患者预后。同时,对术前新辅助化疗后残留肿瘤范围的准确判断,为新辅助化疗后肿瘤细胞减灭术的实施时机提供依据[5]。病理检查是判断化疗疗效的“金标准”,但它是在新辅助化疗结束后的评估,不能用于早期调整治疗方案。
疗效评估常建立在瘤体形态学变化的基础上。准确测量肿瘤大小的改变是评估新辅助化疗疗效的先决条件。Qayyum等[6]对比了超声、CT与MRI测量的肿瘤大小,并与术后病理标本大小对照,认为超声是最准确实用的评估方法。本研究应用4~9 MHz经阴探头,提高了仪器分辨率,能清晰地确定肿瘤的边界,精确地测量肿瘤的大小。
本组达病理完全缓解的6例患者中,5例超声诊断明确,1例超声诊断为残余癌,其原因可能为原发肿瘤部位癌组织变性坏死,大量纤维组织增生,淋巴细胞弥漫浸润,肉芽肿形成所致图像改变。本研究化疗后术前超声与术后病理测量残余癌大小呈显著正相关(r=0.879, P<0.01),超声总有效率与病理结果基本符合,为临床客观评估化疗疗效、优化手术方式、避免无效化疗提供了可靠的依据。本研究结果显示,无论是化疗有效者还是无效者,化疗1个疗程后肿瘤体积均无显著变化,可见术前新辅助化疗早期肿瘤体积尚未发生影像学可检测到的变化。新辅助化疗后肿瘤明显缩小往往出现在第2周期的后期,对于2个周期仍未见疗效者 ,认为对化疗药物不敏感或原发耐药,在可能的情况下尽早实施手术。本研究中对2例化疗无效患者及时调整了治疗方案,避免了无效化疗,同时为术后及复发时选择化疗方案提供了最重要的证据[7]。因此,建议在新辅助化疗第2周期结束后常规进行超声监测,以便临床及时有效地调整治疗方案。
肿瘤化疗反应的血管变化往往先于体积变化。目前常用的评估实体肿瘤化疗疗效方案是在2个化疗疗程后,以肿瘤大小变化为依据进行判定。本组新辅助化疗前后肿瘤Vmax及RI差异有统计学意义,与化疗后肿瘤血管密度降低有关,在1个疗程后即可根据血管反应预知肿瘤疗效,具有可靠的准确性,可及时调整治疗方案,避免不敏感患者承受无效治疗的毒副作用、可能造成的治疗延误及社会医疗资源的浪费[8]。CA125是目前诊断卵巢癌最敏感的标志物,与卵巢上皮癌抗原有关,在胚胎过程中由体腔上皮产生,出生后消失,在卵巢癌中重新出现,与肿瘤负荷增加有关[9]。新辅助化疗后,肿瘤负荷降低,CA125水平下降,术前血清CA125水平变化能对新辅助化疗的疗效作出有效评价,甚至CA125减退水平可以决定减瘤术的成败。Kang等[10]报道CA125水平减少50%表示肿瘤对化疗有反应,成倍增长则表示效果不佳,肿瘤继续进展。本研究对60例Ⅲ、Ⅳ期卵巢癌患者术前血清CA125水平进行分析,认为将CA125临界值定为500 U/ml时,预测效能最高。41例CA125<500 U/ml者中,33例(80.5%)获得满意手术;而19例CA125> 500 U/ml者中,仅6例(31.6%)获得满意手术,敏感性为68.3%,认为CA125是评估手术可行性的较好指标,但血清CA125检测不能提供肿瘤的形态、大小、位置等信息。本组患者于每次化疗前后检测CA125,1~3周期化疗后行TV-CDFI检查,提高了诊断准确率,可对疗效进行评价。
综上所述,TV-CDFI检查对肿瘤内部和周围的血流动态检测具有显著优势,并可以直观地显示新辅助化疗前后原发灶的大小、形态、边界、内部回声及血流情况的变化,对新辅助化疗后理想减瘤术的施行有重要指导意义。TV-CDFI联合血清CA125监测卵巢癌新辅助化疗疗效可相互补充,提高了评价的准确率,对临床治疗具有指导意义。
[1] 杨运胜, 高国兰, 杨心凤, 等. 晚期卵巢癌术前新辅助化疗的临床研究. 实用癌症杂志, 2007, 22(3): 302-304, 310.
[2] Vergote I, Trope CG, Amant F, etal. Neoadjuvant chemotherapy or primary surgery in stage IIIC or IV ovarian Cancer. N Engl J Med,2010, 363(10): 943-953.
[3] Freedman OC, Dodge J, Shaw P, etal. Diagnosis of epithelial ovarian carcinoma prior to neoadjuvant chemotherapy. Gynecol Oncol, 2010, 119(1): 22-25.
[4] Weinberg LE, Rodriguez G, Hurteau JA. The role of neoadjuvant chemotherapy in treating advanced epithelial ovarian cancer. J Surg Oncol, 2010, 101(4): 334-343.
[5] Brun J, Rouzier R, Seile F, etal. Neoadjuvant chemotherapy or primary surgery for stage III/IV ovarian cancer: contribution of diagnostic laparescopy. BMC Cancer, 2009, 9: 171.
[6] Qayyum A, Coakley FV, Westphalen AC, etal. Role of CT and Mr imaging in predicting optimal cytoreduction of newly diagnosed primary epithelial ovarian cancer. Gynecol Oncol, 2005, 96(2):301-306.
[7] Valent S, Oláh O, Sára L, etal. Ultrasonography in the diagnosis of ovarian and endometrial carcinoma. Orv Hetil, 2011, 152(47):1887-1893.
[8] Huber S, Medl M, Helbich T, etal. Locally advanced breast carcinoma: computer assisted semiquantitative analysis of color Doppler ultrasonography in the evaluation of tumor response to neoadjuvant chemotherapy (work in progress). Anticancer Res,2000, 19(9): 601-607.
[9] 王新燕, 唐贵波. 彩色多普勒超声血流阻力指数结合CA125对卵巢肿瘤的诊断价值. 中国医学影像学杂志, 2012, 20(9): 692-694, 699.
[10]Kang S, Kim TJ, Seo SS, etal. Interaction between preoperative CA-125 level and survival benefit of neoadjuvant chemotherapy in advanced epithelial ovarian cancer. Gynecol Oncol, 2011, 120(1):18-22.
