甘油提高巴氏芽孢杆菌脲酶的热稳定性
2013-09-17许燕波钱春香陆兆文
许燕波 钱春香 陆兆文
(东南大学材料科学与工程学院,南京211189)(东南大学江苏省土木工程材料重点实验室,南京 211189)
甘油提高巴氏芽孢杆菌脲酶的热稳定性
许燕波 钱春香 陆兆文
(东南大学材料科学与工程学院,南京211189)
(东南大学江苏省土木工程材料重点实验室,南京 211189)
摘 要:研究了保存时间和保存温度对碳酸盐矿化菌脲酶活性的影响,发现在低温4℃条件下,脲酶活性在29 d内出现不同程度下降;常温短期储存时,酶活性可以保持3 d,3 d后酶活性值下降明显.为提高脲酶的热稳定性,向碳酸盐矿化菌中添加甘油作为保护剂,常温下添加总体积分数20%的甘油,可以提高酶的稳定性,脲酶活性在30℃下3 d内保持不变,但甘油保护作用有限,高温储存超过7 d后酶活性值下降明显;而在保存温度4℃条件下,添加体积分数为10%的甘油,碳酸盐矿化菌可以储存30 d,底物分解量可以达到初始菌液的95%.
关键词:碳酸盐矿化菌;脲酶;甘油;热稳定性
巴氏芽孢杆菌是一株碳酸盐矿化菌株,在生长过程中产生的脲酶具有分解尿素、产生碳酸根的能力.利用碳酸盐矿化菌的这种特性,学者们开展了碳酸盐矿化菌在文物修复、土壤固化、治沙固沙、重金属污染处理等领域的应用研究,并取得积极的成果[1-5].
脲酶,系统命名为酰胺水解酶(urea amidohydrolase),是人类首次获得晶体并发现含有镍离子的金属酶.酶作为一种具有催化活性的蛋白质,易受到多种因素影响而丧失活性,一般酶要避免处于高温、强酸、强碱的环境中,例如,高温会导致氢键或者疏水键破坏[6-7].因此,实现碳酸盐矿化菌在上述领域的规模应用,必须考虑脲酶的稳定性问题.
添加保护剂是目前工业上提高酶稳定性的最重要手段[6].刘朝辉等[7]研究了几种糖类和多元醇类保护剂提高β-甘露聚糖酶热稳定性的作用,研究表明,蔗糖、壳聚糖和山梨醇浓度均为2 g/L时能够显著提高该酶的热稳定性.郑贤良等[8]通过向重组α-环糊精葡萄糖基转移酶(α-CGT酶)液中添加化学添加剂来提高其热稳定性及贮存稳定性,研究了在不同温度下添加剂对酶液贮存稳定性的影响,当单独加入各种添加剂在50℃水浴1 h和室温放置108 d后,发现含有20%甘油的酶液稳定性最好.
本文研究保存时间和保存温度对碳酸盐矿化菌脲酶活性的影响,并添加甘油作为保护剂,从而提高脲酶的热稳定性,为矿化菌的应用提供基础.
1 材料与方法
1.1 材料
试剂药品为乙二醇、甘油、对二甲氨基苯甲醛、浓盐酸和乙醇,均为分析纯.碳酸盐矿化菌由本实验室自己培养制备.
实验仪器有756紫外可见分光光度计、DDS-12A计电导率测定仪、冷冻恒温振荡器(HZ-9210K)、单人单面净化工作台(SW-CJ-1FD)和隔水式电热恒温培养箱(GNP-9160BS-Ⅲ).
1.2 酶活性测定方法
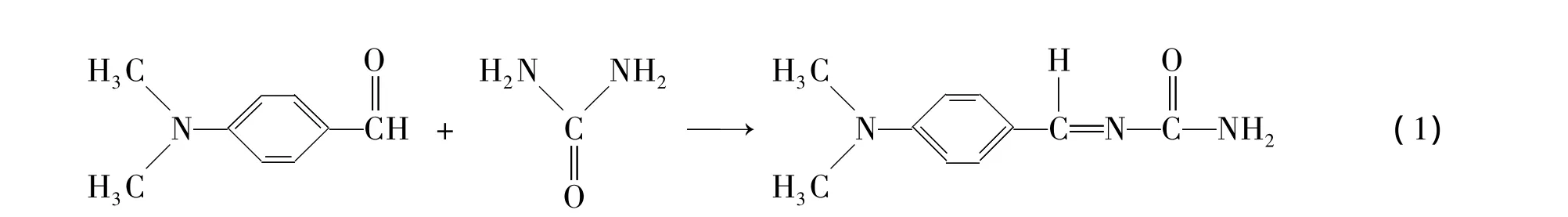
脲酶的活性以其单位时间内分解尿素的能力来表征.脲酶的活性测试方法有很多,本文选择电导率法和比色法来测量菌液中的脲酶活性U.
1)电导率法测定脲酶活性
溶液的电导率与溶液中离子的浓度密切相关.随着微生物分解底物、溶液中铵根离子和碳酸根离子浓度增高,溶液的电导率也随之增高.
配制2 mol/L的尿素溶液,取25 mL于烧杯中,并加入20 mL去离子水,放入恒温水浴锅中,搅拌速度设置为250 r/min.取5 mL完全生长好的菌液,并立即注射到烧杯中,每隔30 s记录电导率的数值,直到电导率的数值变化趋稳,电导率的变化值记为k.单位酶活性值记为U,U=2×10kAμmol·urea/min,其中,A为特定系数,取11.11.
2)比色法
菌株的酶活性是通过测定直接底物的残留量来确定的.底物浓度的测定方法是利用显色剂(对二甲氨基苯甲醛)在酸性条件下与底物反应,生成的对二甲氨基甲醛脲为柠檬黄色化合物,其颜色的深浅与底物含量成正比,可以用比色法测定.样品中的氨和二氧化碳主要改变显色液的酸度,可以通过加酸中和的方法消除干扰.其反应式为
称取4 g对二甲氨基苯甲醛,溶于200 mL无水乙醇中,加入20 mL浓盐酸,混合均匀,储存于棕色试剂瓶中.
配制标准尿素浓度的溶液,分别移取1,2,4,5 mL尿素溶液于50 mL容量瓶中,加入5 mL对二甲氨基苯甲醛溶液,混合定容.在比色皿中依次得到430 nm波长下的光密度值(OD),绘制出标准曲线[9],如图 1 所示.
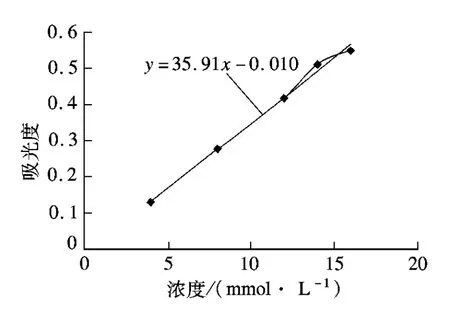
图1 尿素浓度-吸光度标准曲线
1.3 脲酶活性变化
温度和时间是对微生物生命活动影响较重要的影响因素.而在实际使用过程中又必须考虑短期保存和长期保存2种情况.选择冰箱的常用冷藏温度4℃作为长期保存温度,在短期保存情况下,选择15,20,25,30和40℃作为短期储存温度和酶活性测试温度,分析脲酶活性随时间变化.
1.4 保护剂提高脲酶稳定性
对加入保护剂的脲酶,在不同温度下保存后,向每100 mL菌液中加入过量的尿素,通过测定对底物的分解能力,分析脲酶活性在不同温度下的稳定性变化.
2 结果与讨论
2.1 保存条件对菌株脲酶活性的影响
4 ℃是常用的冷冻保藏温度,将100 mL培养好的菌液(去离子水调整OD值为1.2)储存于4℃冰箱中,利用电导率法测定脲酶活性变化,并选择15,20,25,30和40℃作为测试温度点,结果如表1所示.实验结果发现,在4℃保存条件下,5 d内电导率显示的脲酶活性在各个测试温度点保持不变.而40℃测试温度点的酶活性值在29 d后从6.66 μmol·urea/min 降到 4.44 μmol·urea/min,下降了33%.15℃测试温度点的酶活性值15 d内基本不变,在15 d后则由于电导率变化值太小而无法测出,这是因为酶活性值的大小易受温度影响,在测试温度较高时酶分解底物的反应速度较快,从而导致显示的电导率的变化值较大,测试温度较低时则变化值较小.在20,25,30和40℃测试温度点,22 d后酶活性值下降均较为明显.
选择15,20,25,30和40℃作为常温下的保存温度和测试温度点,分析脲酶活性变化,结果如表1所示.
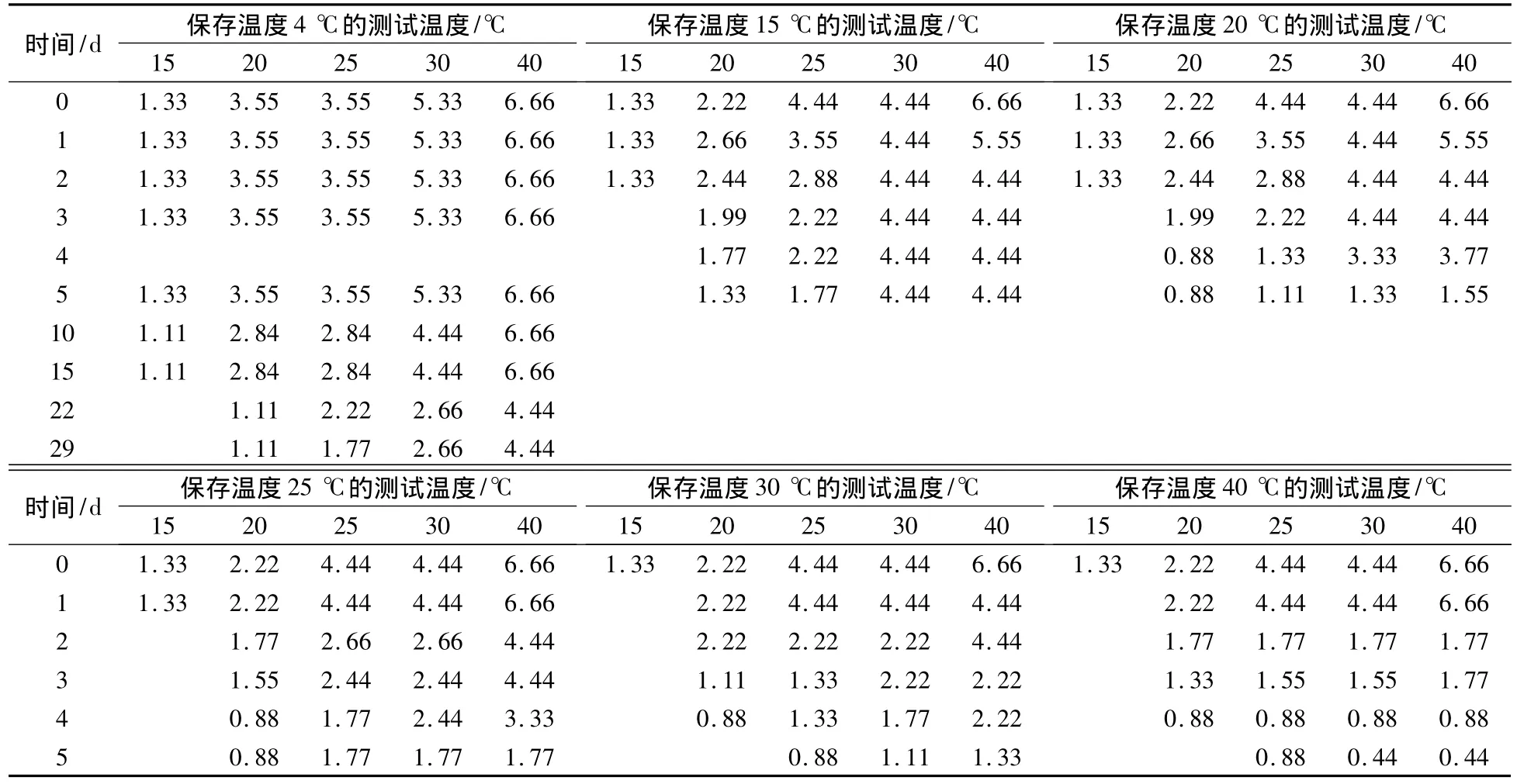
表1 不同测试温度的脲酶活性(OD=1.2) μmol·urea/min
当测试温度为15℃,保存温度为15,20和25℃时,酶活性值在3 d内可以测出,而在保存温度为30和40℃条件下,3 d后已经无法测出.当测试温度为25℃时,在保存温度为15,20和25℃条件下,酶活性值在3 d后下降50%,5 d后从4.44 μmol·urea/min 降到 1 μmol·urea/min 左右,而在30和40℃保存条件下,3 d后下降幅度超过了50%,5 d后酶活性值下降到低于1 μmol·urea/min.因此,常温下脲酶活性可以保持3 d,在3 d后下降明显.
2.2 保护剂对脲酶活性影响
碳酸盐矿化菌不可避免会受到保存温度和时间的影响,活性降低.乙二醇和甘油作为多元醇,是常见的保护剂.实验中向每100 mL菌液(OD=1.2)中添加保护剂.保护剂体积分数和种类分别为0%、20%乙二醇、30%乙二醇、10%乙二醇 +10%甘油、20%甘油和30%甘油.在30℃下保存3 d后,加入过量的尿素,分析菌液对尿素的分解量.实验结果如图2所示.
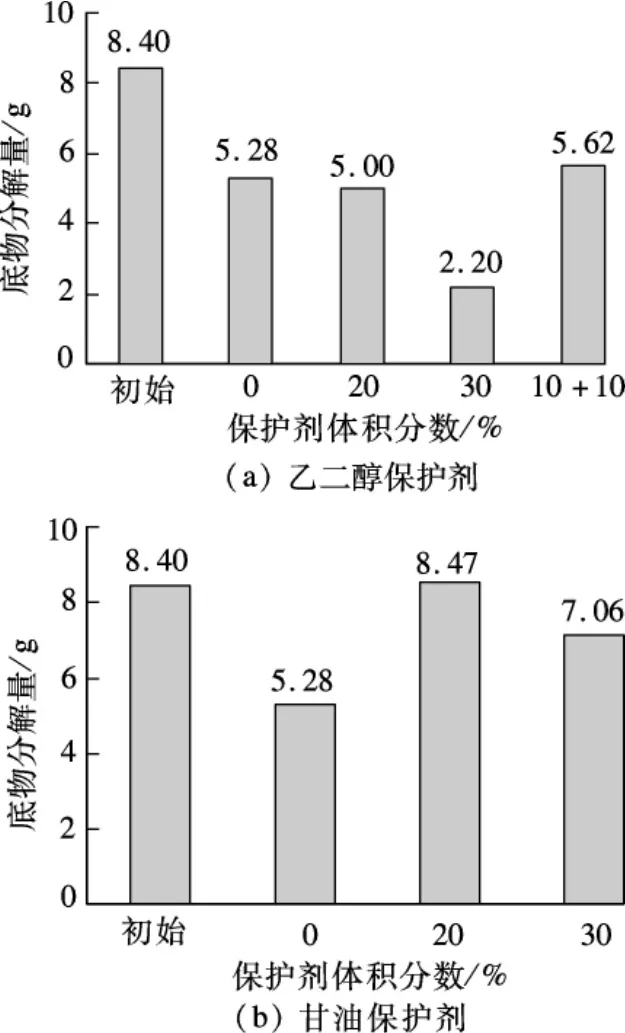
图2 保护剂对底物分解量的影响
乙二醇的保护作用并不理想,初始100 mL菌液的底物分解量为8.4 g,30℃保存3 d后分解量减少为5.28 g,添加20%乙二醇后100 mL菌液对底物的分解量为5 g.并且乙二醇体积分数增加并不能提高保护性能,添加30%的乙二醇后底物分解量为2.2 g,但甘油的体积分数只占10%,底物分解量明显提高.含有20%甘油作为保护剂的菌液3 d后分解量与初始无异,证明甘油是一种可以用于碳酸盐矿化菌的良好保护剂.
添加甘油作为保护剂能保持较稳定的酶活性,这是因为甘油与水分子相互作用,改变了水的表面张力,使酶与水之间形成溶剂层,同时甘油的羟基与酶的酰胺基以氢键的方式相互作用,促进酶的热稳定性.甘油分子较小,可以结合在酶分子的肽链空隙里,增强了分子内的疏水作用,减少酶分子间的相互作用;另一方面可阻止部分导致酶失活的物质接近活性中心,从而提高了酶的稳定性.
向每100 mL碳酸盐矿化菌(OD=1.2)中添加甘油作为保护剂,甘油保护剂的体积分数分别为0%,5%,10%,15%和20%,同时选择15,30和40℃三个温度点作为短期保存温度,菌液在各保存温度下放置7 d后,取出并向其中加入过量底物,用比色法分析底物的分解量.实验结果如图3所示.

图3 甘油保护不同温度下放置7 d底物分解图
在保存温度15℃储存7 d后,空白试样底物分解量为2.90 g,达到初始菌液底物分解量的35%;而添加了甘油作为保护剂的试样,底物分解量与空白试样相比都得到提高,且随着体积分数增加而增加,甘油保护剂体积分数为20%时,达到初始菌液底物分解量的73%.
在保存温度30℃储存7 d后,空白试样底物分解量为初始分解量的15%;而添加了甘油作为保护剂的试样,底物分解量都在50%以上,且随着甘油保护剂体积分数的增加,底物分解量也相应增加,但增加幅度不如15℃条件下的增幅明显.
在保存温度40℃放置7 d,空白试样的底物分解量为1.53 g;而添加了甘油作为保护剂的试样,底物分解量也均未超过50%,甘油保护剂体积分数为20%,底物分解量也只有3.60 g,说明在储存温度较高的情况下甘油保护作用是有限的.
同样,4℃作为长期保存温度,向每100 mL菌液中添加甘油作为保护剂,保护剂体积分数依次为0%,5%,10%,15%和20%.菌液储存30 d后,取出并向其中加入过量的底物尿素,用比色法分析底物分解量.实验结果如图4所示.
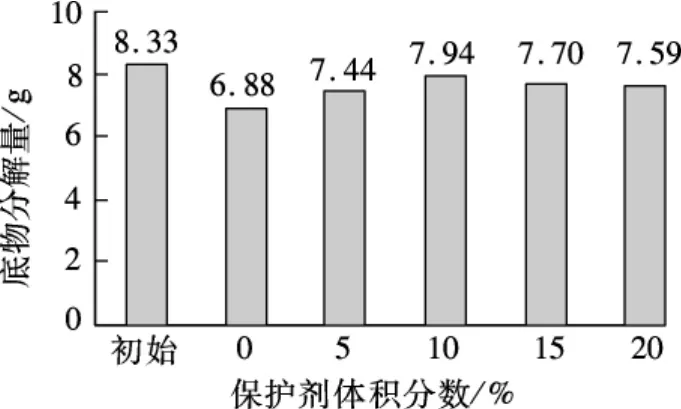
图4 甘油保护下于4℃储存30 d底物分解图
在保存温度4℃条件下保存30 d后,未添加甘油保护剂的空白试样,底物最大分解量为6.88 g,达到了初始菌液底物分解量的82.5%.添加了甘油作为保护剂的试样,结果差距不大,甘油保护剂体积分数10%的试样,底物最大分解量为7.94 g,达到初始菌液底物分解量的95%.这一方面是由于甘油的保护作用,另一方面微生物在4℃条件下进入休眠状态,生命活动停止,酶活性保持稳定,温度提高后加入底物后酶重新开始分解底物.
考虑到实际使用时的需要,常温下(10~40℃)保存时,选择体积分数为20%的甘油作为碳酸盐矿化菌的保护剂,即向每1 L菌液中添加250 mL甘油,同时保存时间不宜超过7 d.碳酸盐矿化菌的长期保存可以选择4℃,甘油保护剂体积分数为10%.
3 结论
1)碳酸盐矿化菌的脲酶活性在4℃条件下保存,5 d内电导率显示的脲酶活性在各个测试温度点保持不变;在15℃测试温度点,15 d后酶活性值由于电导率变化太小而无法测出,在20,25,30和40℃测试温度点,酶活性值22 d后下降均明显;常温短期储存时,酶活性可以保持3 d,在3 d后酶活性值明显下降.
2)为保持酶活性的稳定性,向碳酸盐矿化菌中添加甘油作为保护剂.研究发现,常温下添加总体积分数20%的甘油,可以提高酶的稳定性,但甘油保护作用有限,高温储存超过7 d后酶活性值明显下降;而保存温度4℃条件下,体积分数为10%的甘油作为保护剂,碳酸盐矿化菌可以长期储存30 d,底物分解量可达到初始菌液的95%.
[1]李沛豪,居文俊.细菌诱导碳酸钙矿化材料及其应用前景[J].建筑材料学报,2009,12(4):482-486.
Li Peihao,Ju Wenjun.Applications of calcium carbonate mineralization material induced by bacterium[J].Journal of Building Materials,2009,12(4):482 - 486.(in Chinese)
[2]黄琰,罗学刚,何晶,等.微生物在石英砂中诱导方解石沉积的实验研究[J].西南科技大学学报,2009,24(2):65-69.
Huang Yan,Luo Xuegang,He Jing,et al.Studies on the experiment of microbiologically-induced calcite precipitation in silica[J].Journal of Southwest University of Science and Technology,2009,24(2):65 -69.(in Chinese)
[3]黄琰,罗学刚,杜菲.微生物诱导方解石沉积加固的影响因素[J].西南科技大学学报,2009,24(3):87-93.
Huang Yan,Luo Xuegang,Du Fei.Studies on the effect factor of microbiologically-induced calcite precipitation[J].Journal of Southwest University of Science and Tech-nology,2009,24(3):87-93.(in Chinese)
[4]成亮,钱春香,王瑞兴,等.碳酸盐矿化菌株固结土壤Cd2+的生物矿化过程[J].硅酸盐学报,2008,36(增刊1):216-222.
Cheng Liang,Qian Chunxiang,Wang Ruixing,et al.Bioremedidation process of Cd2+removal from soil by bacteria biomineralization[J].Chinese Ceramic Society,2008,36(S1):216 -222.(in Chinese)
[5]Sondi I,Matijevic E.Homogeneous precipitation by enzyme-catalyzed reactions-strontium and barium carbonates[J].Chemistry of Materials,2003,15(6):1322 -1326.
[6]李丽.微生物酶促形成方解石胶结砂粒的实验与模拟[D].南京:东南大学材料科学与工程学院,2011.
[7]刘朝辉,武伟娜,刘跃,等.保护剂提高β-甘露聚糖酶热稳定性的研究[J].天津大学学报,2008,41(1):114-118.
Liu Zhaohui,Wu Weina,Liu Yue,et al.Enhancing the thermostability of β-mannanase by protective additives[J].Journal of Tianjin University,2008,41(1):114 -118.(in Chinese)
[8]郑贤良,吴丹,李兆丰,等.化学添加剂提高重组α-环糊精葡萄糖基转移酶酶制剂稳定性[J].生物工程学报,2011,27(2):185 -195.
Zheng Xianliang,Wu Dan,Li Zhaofeng,et al.Enhanced storage stability of recombinant enzyme preparation of α-CGTase from Paenibacillus macerans by chemical additives[J].Chinese Journal of Biotechnology,2011,27(2):185 -195.(in Chinese)
[9]李亚星,徐秋明,曹一平,等.分光光度法测定树脂包衣尿素溶出的研究[J].中国土壤与肥料,2010(1):84-87.
Li Yaxing,Xu Qiuming,Cao Yiping,et al.Colorimetric estimation of urea release rate in coated urea[J].Soil and Fertilizer Science in China,2010(1):84 -87.(in Chinese)
Study on enhancing urease thermostability of Bacillus pasteurii by glycerol
Xu Yanbo Qian Chunxiang Lu Zhaowen
(School of Materials Science and Engineering Southeast University,Nanjing 211189,China)(Jiangsu Key Laboratory of Construction Materials,Southeast University,Nanjing 211189,China)
Abstract:Effect of preservation time and temperature on the carbonate-mineralization microbe urease activity is studied.The urease activity decreases in 29 days at 4℃ while it can be kept for 3 days at normal temperature before obvious decrease afterwards.Glycerol is selected as the protective additive to enhance the urease thermostability.The urease activity keep stable for 3 days at 30℃,and the best volume fraction for glycerol is 20%at normal temperature.However its effect of preservation is limited,and the urease activity decreases obviously after 7 days at high store temperature.The decomposition ability can reach up to 95%at 4 ℃ after 30 days with 10%glycerol,and the carbonate-mineralization microbe can be kept in reserve for a month.
Key words:carbonate-mineralization microbe;urease;glycerol;thermostability
中图分类号:Q89
A
1001-0505(2013)01-0147-05
doi:10.3969/j.issn.1001 -0505.2013.01.028
收稿日期:2012-04-16.
许燕波(1986—),男,硕士生;钱春香(联系人),女,博士,教授,博士生导师,cxqian@seu.edu.cn.
基金项目:江苏省科技支撑计划资助项目(BK2010062).
引文格式:许燕波,钱春香,陆兆文.甘油提高巴氏芽孢杆菌脲酶的热稳定性[J].东南大学学报:自然科学版,2013,43(1):147-151.[doi:10.3969/j.issn.1001 -0505.2013.01.028]
