Ⅰ、Ⅱ级原发性高血压患者糖化血红蛋白与早期肾损害的关系
2013-09-17林从娟林志鸿蔡川奇蔺佩鸿郑建清
林从娟 林志鸿,2 蔡川奇 蔺佩鸿 郑建清
1.福建医科大学附属第一医院急诊科,福建福州 350005;2.福建省高血压研究所,福建福州 350005
高血压常伴发糖代谢异常,高血压人群的糖尿病患病率平均为18%。高血压一旦合并糖代谢异常或糖尿病,其靶器官的损害更为严重,心脑血管事件的风险显著增加[1]。糖化血红蛋白(HbA1c)的重要性以及其反映患者近2~3个月的血糖情况已达成共识。英国前瞻性糖尿病研究(UKPDS)发现,HbA1c增加1%,则冠心病危险性增加11%[2]。Khaw等[3]的研究也表明,对于2型糖尿病患者,在对收缩压、胆固醇水平、体质量指数等因素进行校正后,HbA1c水平每增加1%,心血管病的风险就升高21%,男性病死率升高22%,女性病死率升高28%。
但对于非糖尿病的原发性高血压患者而言,HbA1c的水平是否也与高血压患者的靶器官损害相关,目前的研究尚未完全阐明。本研究就原发性高血压患者HbA1c与微量白蛋白尿 (microalbuminur,MAU)间的关系及意义展开探讨,以明确HbA1c对高血压患者早期肾损害的临床价值。
1 资料与方法
1.1 一般资料
选择2011年8月~2012年7月福建医科大学附属第一医院(以下简称“我院”)首次就诊未治疗的Ⅰ、Ⅱ级原发性高血压患者286例,其中男160例,女126例,年龄30~91岁,平均64.5岁,均符合《2010年中国高血压防治指南》诊断标准:140 mm Hg≤收缩压<180 mm Hg和(或)90 mm Hg≤舒张压<110 mm Hg(1 mm Hg=0.133 kPa),所有患者排除继发性高血压、糖尿病、肝肾功能不全、原发性肾脏疾病、心力衰竭、脑卒中、恶性肿瘤等。同时选取同期健康体检者82例为对照组,其中男47例,女35例,年龄34~78岁,平均61.5岁。所有高血压患者按HbA1c水平分为HbA1c正常组(HbA1c<6%,n=152)和 HbA1c升高组(HbA1c≥6%,n=134)。本研究经福建医科大学附属第一医院伦理委员会批准,所有患者均经过知情同意后进行。
1.2 研究方法
1.2.1 生化指标检测 所有患者均在晨起空腹状态下采静脉血检测三酰甘油(TG)、总胆固醇(TCHO)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、尿素氮(BUN)、血肌酐(Scr)、尿酸(UA)、空腹血糖(FPG),由我院检验科应用AU2700全自动生化分析仪进行统一的检测。
1.2.2 HbA1c水平的检测 应用BIO-RAD VARIANT-Ⅱ,采用高效液相色谱法进行HbA1c浓度的检测。
1.2.3 尿微量白蛋白(UAlb)及肾小球滤过率(GFR)的检测所有患者检查前日禁止剧烈运动及高蛋白饮食,留取研究对象的晨起第1次小便的中段尿液3~5 mL,送我院检验科采用西门子BN-Ⅱ特定蛋白测定仪,应用散色比浊法检测UAlb。通过免疫比浊法测定血清胱抑素C的水平估算GFR。
1.3 统计学方法
采用统计软件SPSS 17.0对数据进行分析,正态分布计量资料以均数±标准差(±s)表示,两独立样本的计量资料采用t检验;多组间比较采用方差分析,两两比较采用LSD-t检验。非正态分布的计量资料用中位数(M)及四分位数(P25,P75)表示,采用秩和检验。计数资料以率表示,采用χ2检验。计量资料间关系采用Spearman相关分析。多因素分析采用多元线性逐步回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 基本情况及生化指标比较
三组年龄、性别构成比、体重指数、收缩压、舒张压差异均无统计学意义(P>0.05);HbA1c正常组、HbA1c升高组收缩压及舒张压均高于对照组,差异有统计学意义 (P<0.05); 各组 TG、TCHO、HDL-C、LDL-C、GFR、FPG 等生化指标差异无统计学意义(P>0.05)。见表1、2。在与肾功能相关的指标中,HbA1c升高组HbA1c、UAlb水平高于HbA1c正常组,差异有统计学意义(P<0.05);而HbA1c正常组与对照组间HbA1c、UAlb水平差异无统计学意义(P>0.05);三组间GFR、Scr、BUN、UA水平差异无统计学意义 (P>0.05)。
表1 各组基本情况比较(±s)

表1 各组基本情况比较(±s)
注:与对照组比较,bP<0.05;“-”表示无数据;HbA1c:糖化血红蛋白
组别 例数 年龄(岁) 男性[n(%)] 体重指数(kg/m2) 收缩压(mm Hg) 舒张压(mm Hg) 高血压病程[年,M(P25,P75)]HbA1c正常组HbA1c升高组对照组1521348265.0±12.163.7±12.161.6±10.886(56.6)74(55.2)47(57.3)23.3±3.124.1±4.023.2±2.2143.9±10.8b 143.5±10.6121.5±5.183.2±8.4b 83.9±8.770.1±5.55.0(2.0,16.0)5.0(1.0,18.0)-
表2 各组生化指标比较(±s)
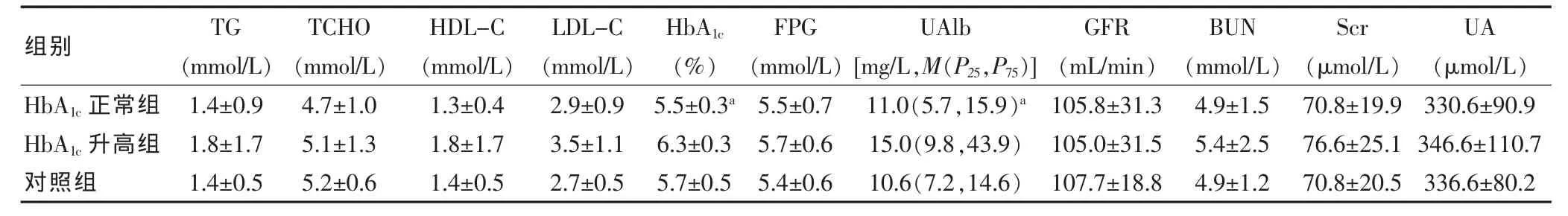
表2 各组生化指标比较(±s)
注:与HbA1c升高组比较,aP<0.05;TG:三酰甘油;TCHO:总胆固醇;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;FPG:空腹血糖;HbA1c:糖化血红蛋白;UAlb:尿微量白蛋白;BUN:尿素氮;Scr:血肌酐;UA:尿酸;GFR:肾小球滤过率
组别 TG(mmol/L)TCHO(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)HbA1c(%)FPG(mmol/L)HbA1c正常组HbA1c升高组对照组1.4±0.91.8±1.71.4±0.54.7±1.05.1±1.35.2±0.61.3±0.41.8±1.71.4±0.52.9±0.93.5±1.12.7±0.55.5±0.3a 6.3±0.35.7±0.5 UAlb[mg/L,M(P25,P75)]GFR(mL/min)BUN(mmol/L)Scr(μmol/L)UA(μmol/L)5.5±0.75.7±0.65.4±0.611.0(5.7,15.9)a 15.0(9.8,43.9)10.6(7.2,14.6)105.8±31.3105.0±31.5107.7±18.84.9±1.55.4±2.54.9±1.270.8±19.976.6±25.170.8±20.5330.6±90.9346.6±110.7336.6±80.2

表3 UAlb与各指标之间的相关分析结果
2.2 UAlb与各指标之间的相关性分析
Spearman相关分析显示,UAlb与 HbA1c及FPG呈正相关,而与 GFR、Scr、BUN、UA、SBP、DBP、年龄、高血压病程及血脂水平等无相关性。见表3。
2.3 UAlb的多因素回归分析
以UAlb为因变量,以上述各指标为自变量进行多元线性逐步回归分析。结果表明HbA1c和FPG水平是UAlb的独立危险因素(P<0.05),见表4。
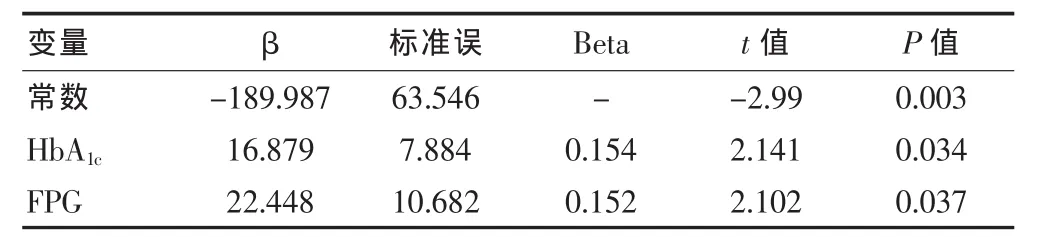
表4 UAlb影响因素的多元逐步回归分析
3 讨论
高血压常伴发糖代谢异常,高血压一旦合并糖代谢异常或糖尿病,其靶器官的损害更为严重,心脑血管事件的风险将显著增加。HbA1c可以反映患者2~3个月的血糖水平,国内外的研究表明,即使在血糖正常范围的人群中,HbA1c也和心血管疾病的发生有关[4-6]。近年研究发现高血压及糖尿病患者在发生明显靶器官损害之前就已出现尿蛋白排泄率的轻度增加,因此MAU已被视为高血压及糖尿病亚临床型肾功能损害的重要指标[7]。
本研究结果显示,在轻中度的原发性高血压患者中,虽然其FPG仍在正常范围之内,但有部分患者的HbA1c已经出现异常。而且HbA1c升高的高血压患者其UAlb要比HbA1c正常患者要高,而HbA1c正常的高血压患者其UAlb的排泄水平与正常的健康体检者之间则没有显著性差异;而三者之间以胱抑素计算的GFR及血Cr水平也未见明显差异。同时高血压患者UAlb与HbA1c水平呈独立相关关系,而与年龄、血压水平、血脂、血Cr及GFR无关。提示对于轻中度的原发性高血压患者而言,HbA1c水平可能是预测早期肾功能损害的独立危险因素之一。既往有研究发现原发性高血压患者的血压水平及高血压病程也是MAU危险因素[8],本研究未观察到此一关系,可能与本研究入选的高血压患者血压水平不是很高,为Ⅰ、Ⅱ级高血压,而且高血压病程也不长有关。
高血压本身可导致MAU,动脉粥样硬化及血管内皮功能异常是高血压患者出现MAU的原因之一[9-10]。而当高血压合并HbA1c升高时,表明高血压患者已出现糖代谢异常,虽然此时患者的空腹血糖或餐后血糖可能仍然处于正常水平。但升高的HbA1c会加重高血压患者血管内皮功能的损害,增加血管僵硬度,导致动脉顺应性减退,加重肾血管及肾小球的损害,使其通透性增加[11];另外HbA1c还可显著提高成纤维母细胞PKC的活性,诱导转化生长转移因子β(TGFβ)mRNA的表达,使具有生物学活性的TGFβ的合成增加,导致肾小球系膜细胞增生,肾小球内皮细胞通透性增加;促进白细胞合成及释放超氧化物和蛋白水解酶,引起肾组织损伤,进一步增加尿UAlb的排泄,加重肾脏的损伤[12-14]。
综上所述,对于血糖正常的轻中度原发性高血压患者而言,及时检测HbA1c水平和UAlb将有助于早期发现肾功能的损害及其严重程度,及时采取有效措施干预,以阻止高血压患者靶器官损害的进展和心脑血管事件的发生。
[1]Cushman WC,Evans GW,Byington RP,et al.Effects of intensive blood-pressure control in type 2 diabetes mellitus[J].N Engl J Med,2010,362(17):1575-1585.
[2]Molinaro RJ.Targeting HbA1c:standardization and clinical laboratory measurement[J].MLO Med Lab Obs,2008,40(1):10-14.
[3]Khaw KT,Wareham N,Bingham S,et al.Association of hemoglobin A1c with cardiovascular disease and mortality in adults:the European prospective investigation into cancer in Norfolk[J].Ann Intern Med,2004,141(6):413-420.
[4]Holman R.Metformin as first choice in oral diabetes treatment:the UKPDSexperience[J].JournAnnuDiabetolHotelDieu,2007,10:13-20.
[5]徐安平,李卫宁,张毅,等.糖化血红蛋白检测对非糖尿病高血压患者的临床价值[J].检验医学与临床,2012,9(7):777-778.
[6]Selvin E,Steffes MW,Zhu H,et al.Glycated hemoglobin,diabetes,and cardiovascular risk in nondiabetic adults [J].N Engl J Med,2010,362(9):800-811.
[7]Viazzi F,Leoncini G,Conti N,et al.Microalbuminuria is a predictor of chronic renal insufficiency in patients without diabetes and with hypertension:the MAGIC study[J].Clin J Am Soc Nephrol,2010,5(6):1099-1106.
[8]周永兰,骆秉铨,赵雨灯,等.原发性高血压患者尿蛋白与肌酐比值和心血管危险因素的关系[J].中华高血压杂志,2011,19(10):943-946.
[9]孙宁玲,王鸿懿,朱鼎良,等.白蛋白尿与高血压患者血压水平的关系[J].中华肾脏病杂志,2010,26(10):762-765.
[10]Mahfoud F,Ukena C,Poss J,et al.Microalbuminuria independently correlates to cardiovascular comorbidity burden in patients with hypertension[J].Clin Res Cardiol,2012,101(9):761-766.
[11]Nogueira AR,Fernandes AS,Coutinho ES,et al.Factors associated with microalbuminuria in resistant hypertension [J].Int J Cardiol,2007,21(1):86-87.
[12]林婷,林捷,陈红芳.综合护理干预对2型糖尿病合并高血压患者生活质量的影响[J].现代医院,2011,11(10):64-66.
[13]牟逸晴,刘胜华,傅杰武.通心络联合缬沙坦治疗2型糖尿病肾脏病变Ⅲ期的疗效观察[J].疑难病杂志,2011,10(6):423-425.
[14]Sander D,Schulze-Horn C,Bickel H,et al.Combined effects of hemoglobin A1c and C-Reactive Protein on the progression of subclinical carotid atherosclerosis,the invade study[J].Stroke,2006,37(2):351-357.
