酸解氧化小麦淀粉的制备及性能
2013-09-17唐洪波董四清李艳平
唐洪波 董四清 李艳平
(沈阳工业大学理学院,沈阳 110870)
小麦淀粉是常见的淀粉之一,可广泛用于食品和非食品领域。为提高淀粉应用品质,扩大其应用领域,常采用化学、物理、酶等改性的方法使其满足应用要求[1]。与原淀粉相比,酸解淀粉具有糊化温度高、黏度低、粘合能力较强等特点[2],氧化淀粉具有糊化温度低、糊黏度小、凝沉性弱、糊透明高、成膜性好等特点[3],而酸解氧化淀粉将同时具备酸解淀粉与氧化淀粉的特性。本研究以小麦淀粉为原料,盐酸为酸解剂,次氯酸钠为氧化剂,对小麦淀粉进行酸解氧化复合改性,并测定其性能,为扩大小麦淀粉在工业上更广泛应用提供依据。
1 材料与方法
1.1 试验材料
小麦淀粉:上海宝鼎酿造有限公司;次氯酸钠(有效氯含量10.5%):沈阳化工股份有限公司;盐酸(AR):沈阳市派尔精细化工制品厂;氢氧化钠(AR):天津市博迪化工有限公司;酒石酸氢钾:沈阳化学试剂厂;碘(CP):沈阳市试剂一厂;碘化钾(AR):沈阳市新化试剂厂;硝酸银(AR):沈阳惠中理工用品厂;溴化钾(SP):美国PIKE公司。
1.2 仪器设备
SHZ-D真空泵:河南凡义市英谷豫华仪器厂;NDJ-1型旋转黏度计:上海天平仪器厂;BCD-177A冰箱:合肥美菱股份有限公司;VI-1501型可见分光光度计:天津市港东科技发展有限公司;1910-2电热恒温干燥箱:金坛市大地自动化仪器厂;BL-320H电子天平:梅特勒上海仪器有限公司;TDL80-2B离心机:上海安亭科学仪器厂;Q50 V20.10 Build 36热重分析仪:美国 Thermal Analysis公司;Q20 V24.4 Build 116差示扫描量热分析仪:美国Thermal Analysis公司。
1.3 试验方法
1.3.1 酸解氧化小麦淀粉制备
1.3.1.1 酸解小麦淀粉制备
准确称取25 g小麦淀粉(含水量为12.67%),用水将其制成质量分数为36%的淀粉乳,置于三口烧瓶中,搅拌,水浴加热至45℃后,加入一定量(HCl占淀粉干基质量1%)质量分数为36%的盐酸,酸解4 h。酸解结束后,用质量分数为4%的氢氧化钠溶液将乳液pH 中和至6.5~7.5,再经过滤、洗涤、干燥、粉碎、筛分得酸解小麦淀粉,备用。
1.3.1.2 酸解氧化小麦淀粉制备
准确称取25 g酸解小麦淀粉(流度23 mL,含水量11.56%),用水将其配制成质量分数为36%的淀粉乳,置于三口烧瓶中,搅拌,水浴加热至一定温度,缓慢用次氯酸钠溶液(有效氯含量12%)将乳液pH调至碱性后,继续缓慢滴加剩余量的次氯酸钠溶液,同时用质量分数为4%的氢氧化钠溶液保持乳液pH恒定。次氯酸钠溶液加完后,继续反应一段时间,然后用一定量质量分数10%的亚硫酸钠溶液还原乳液中残余的次氯酸钠(用碘化钾试纸检验),最后用质量分数为10%的稀盐酸将乳液pH中和至6~7,再经过滤、洗涤、干燥、粉碎、筛分得酸解氧化小麦淀粉。
1.3.2 酸解程度测定
酸解程度采用流度法测定[4]。淀粉酸解程度大,其流度也越大;反之,淀粉酸解程度小,其流度也越小。
1.3.3 羧基含量测定
准确称取1.5 g干燥研细的样品,转移到100 mL烧杯中,加入25 mL 0.1 mol/L盐酸不断搅拌,30 min后用玻璃砂芯漏斗过滤,用无氨蒸馏水洗至无氯离子为止。将洗好的样品移入锥形瓶中,加入300 mL蒸馏水,搅拌均匀后在沸水浴中加热,连续搅拌,待糊化完全后继续加热15 min,加入1%酚酞作指示剂,趁热用0.1 mol/L氢氧化钠标准溶液滴定,呈淡红色为终点,记取消耗毫升数。称取同样质量的原淀粉做空白,操作与样品相同,记取消耗毫升数。样品中羧基含量用质量分数表示,按下式计算[5]:

1.3.4 蓝值
采用 Gilbert和 Spragg法测定[6]。
1.3.5 冻融稳定性
冻融稳定性以析水率计[7]。析水率越大,冻融稳定性越差;反之,析水率越小,冻融稳定性也越好。
1.3.6 膨胀能力
膨胀能力以膨胀度计,测定方法见文献[8]。
1.3.7 抗酸、碱性
将样品配成质量分数为4%的乳液,在沸水浴中加热搅拌至完全糊化后,将溶液放入冷水浴中冷却至室温(25℃),用旋转黏度计测其黏度。然后用酸或碱将溶液pH调至3或10,并用玻璃棒搅拌5 min,再次用旋转黏度计测定其黏度。测定3次并求出平均值。黏度的计算公式如下[9-10]:
η=Κα
式中:η为绝对黏度;K为系数;α为指针读数。
1.3.8 偏光显微镜
将几毫克(5.0~9.5 mg)样品置于洁净载玻片上,以乙醇为溶剂将样品颗粒均匀分散,再用盖玻片将样品颗粒进一步均匀分散开,取下盖玻片即得载有干燥且颗粒分布均匀样品的载玻片。通过选择适当放大倍数、调焦及调整光源灯泡,选择适当观察区域,观察样品颗粒的大小和形状。
1.3.9 热失重(TGA)分析
以Q50热重分析仪对样品的热失重进行分析。测试条件:试样质量15~16 mg,置于密闭铝盒中,升温速率10℃/min,温度范围10~800℃。
1.3.10 差示扫描量热(DSC)分析
以Q20差示扫描量热分析仪对样品的DSC进行分析。测试条件:试样质量为3.0~5.5 mg,置于密闭铝盒中,升温速率10℃/min,温度范围10~250℃。
1.3.11 数据处理
各组试验数据均做平行样品,用SPSS11.5进行统计分析。
2 结果与分析
2.1 反应时间对酸解氧化小麦淀粉羧基含量的影响
反应时间对酸解氧化小麦淀粉羧基含量的影响如图1所示。反应条件:反应温度40℃,pH 9.0,次氯酸钠用量35%(占干酸解小麦淀粉质量百分数)。
增加反应时间,虽然有利于提高次氯酸钠的反应效率,但是随着反应时间的延长,如果淀粉羧基含量增加非常缓慢,增加的反应效率不足以抵消延长时间所带来不利因素的影响,反而又不利于氧化淀粉的生产。文献表明,当反应时间大于2.5 h时,用碘化钾溶液来定性检测NaOCl的残余量,未见检出,说明次氯酸钠反应基本完全[11]。
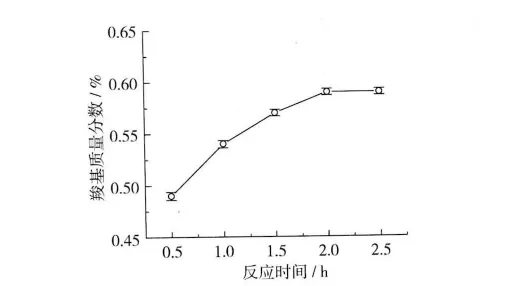
图1 反应时间对酸解氧化小麦淀粉羧基含量的影响
由图1可以看出,当反应时间小于2 h时,随反应时间的增加,酸解氧化小麦淀粉的羧基含量增加;当反应时间大于2 h时,继续增加反应时间,酸解氧化小麦淀粉的羧基含量基本不变。因此,适宜的反应的时间为2 h。
2.2 反应温度对酸解氧化小麦淀粉羧基含量的影响
反应温度对酸解氧化小麦淀粉羧基含量的影响如图2所示。反应条件:反应时间2 h,pH 9.0,氧化剂用量35%。
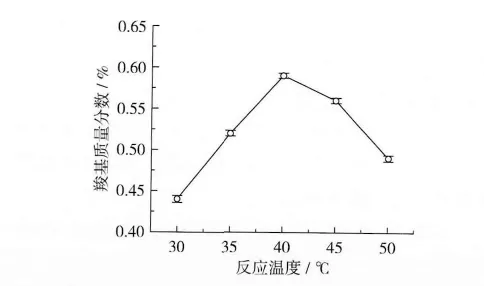
图2 反应温度与酸解氧化小麦淀粉羧基含量的影响
当反应温度较低时,反应活性较差,随着反应温度的升高反应活性也提高,从而影响反应的进行[12]。由图2可以看出,当反应温度低于40℃时,随着温度的增加,酸解氧化小麦淀粉的羧基含量增大;当反应温度高于40℃时,随着反应温度的增加,酸解氧化小麦淀粉的羧基含量降低。其原因可解释为:一方面,当反应温度较高时,易使淀粉发生部分糊化,导致次氯酸钠分子渗透到淀粉颗粒内部的能力下降,另一方面,反应温度较高使次氯酸钠分解量增加,有效降低了次氯酸钠用量,从而使酸解氧化小麦淀粉的羧基含量下降。因此,适宜的反应温度为40℃。
2.3 pH对酸解氧化小麦淀粉羧基含量的影响
pH对酸解氧化小麦淀粉羧基含量的影响如图3所示。反应条件:反应时间2 h,反应温度40℃,次氯酸钠用量35%。
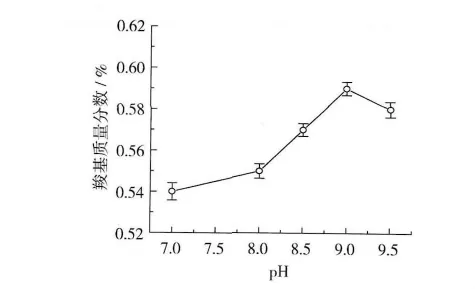
图3 pH对酸解氧化小麦淀粉羧基含量的影响
次氯酸钠可以按以下4种方式随机地氧化淀粉:C2、C3及C4碳原子上的仲羟基被氧化成酮基;将直链淀粉与支链淀粉分子中的还原性醛基氧化成羧基;C6碳原子上的伯羟基被氧化成羧基,生成糖醛酸链;烯二醇基被氧化成醛基。对于以次氯酸钠为氧化剂的氧化淀粉反应来说,当乳液pH较低时,有利于醛基生成;当乳液pH接近中性时,有利于羰基生成;当乳液 pH较高时,有利于羧基生成[13]。文献表明,以次氯酸钠氧化木薯淀粉,最佳pH为9.0[11]。
由图3可以看出,当pH小于9.0时,酸解氧化小麦淀粉羧基含量随着pH增加而增加;当pH大于9.0时,酸解氧化小麦淀粉羧基含量反而降低。其原因可能是:当pH较大时,淀粉颗粒产生较大膨胀,淀粉分子链间间隙减小,阻碍了次氯酸钠分子的扩散,从而使酸解氧化小麦淀粉羧基含量降低。因此,适宜的pH为9。
2.4 次氯酸钠用量对酸解氧化小麦淀粉羧基含量的影响
次氯酸钠用量对酸解氧化小麦淀粉羧基含量的影响如图4所示。反应条件:反应时间2 h,反应温度40 ℃,pH 9.0。
次氯酸钠的用量能显著影响氧化淀粉的羧基含量,而且在所有影响氧化淀粉羧基含量的因素中,各因素对羧基含量影响的主次顺序依次为次氯酸钠用量、pH、反应时间、反应温度[14]。
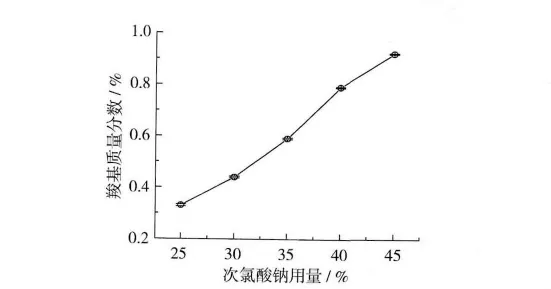
图4 次氯酸钠用量对酸解氧化小麦淀粉羧基含量的影响
由图4可以看出,次氯酸钠用量对酸解氧化小麦淀粉羧基含量的影响较大,且随着次氯酸钠用量的增大,酸解氧化小麦淀粉羧基含量增加。试验中发现,使用放置时间较长的次氯酸钠来氧化淀粉,所得产品的羧基含量会降至很低,这时次氯酸钠主要起到漂白作用。考虑到实际生产对淀粉羧基含量的要求,次氯酸钠用量选35%。
2.5 氧化酸解顺序对酸解氧化小麦淀粉羧基含量的影响
酸解条件:小麦淀粉或氧化小麦淀粉25 g(绝干),淀粉乳质量分数36%,盐酸用量1%,酸解时间4 h,酸解温度45℃。
氧化条件:酸解小麦淀粉或小麦淀粉25 g(绝干),淀粉乳质量分数36%,反应时间2 h,反应温度40℃,pH 9.0,次氯酸钠用量35%。

表1 酸解氧化顺序对酸解氧化小麦淀粉羧基含量的影响
由表1可以看出,先酸解后氧化所得到的酸解氧化小麦淀粉羧基含量比先氧化后酸解所得到的酸解氧化小麦淀粉羧基含量大。原因可能是小麦淀粉经酸解后,淀粉分子变小,可参与反应的羟基增加,氧化剂分子可以与淀粉分子有更多的接触,促进反应,使得先酸解后氧化所得到的酸解氧化小麦淀粉羧基含量稍微大一些。因此,先酸解后氧化顺序优于先氧化后酸解顺序。
2.6 蓝值、冻融稳定性、膨胀能力
小麦淀粉、酸解小麦淀粉的蓝值、冻融稳定性、膨胀能力如表2所示。
由表2可见,小麦淀粉经酸解、氧化后,其蓝值、冻融稳定性增大,但膨胀能力降低,即酸解、氧化使小麦淀粉蓝值、冻融稳定性增加,而降低了其膨胀能力。
2.7 抗酸、碱性
小麦淀粉、酸解小麦淀粉抗酸、碱性如表3所示。黏度变化越小,抗酸、碱性越强;黏度变化越大,抗酸、碱性也越弱。
由表3可见,小麦淀粉经酸解、氧化后,黏度减小。小麦淀粉、氧化小麦淀粉、酸解小麦淀粉及酸解氧化小麦淀粉的黏度在碱性环境增大,而在酸性环境减小。小麦淀粉酸解、氧化程度越大,其黏度变化率越小,且在碱性环境下黏度变化率较大,即酸解、氧化提高了小麦淀粉的抗酸、碱性。
2.8 偏光显微镜分析
小麦淀粉、酸解小麦淀粉(流度23 mL)、酸解氧化小麦淀粉(流度23 mL,羧基含量0.59%)的偏光显微镜照片如图5所示。
由图5可以看出,小麦淀粉颗粒形状为圆形;小麦淀粉经酸解、氧化后,其部分颗粒变为不规则,表面偏十字光消失,且酸解氧化小麦淀粉颗粒的破损程度较酸解小麦淀粉大;而酸解小麦淀粉由于其酸解程度低,使其许多颗粒表面仍保持偏十字光,颗粒完整性较好。
2.9 DSC和TGA
小麦淀粉、酸解小麦淀粉(流度50.2 mL)、酸解氧化小麦淀粉(流度为23 mL,羧基含量为0.59%,羧基含量0.59%)的 DSC、TGA曲线如图6、图7所示。利用差热曲线的吸热或放热峰可表征当温度变化时引起试样发生的任何物理或化学变化;利用热重曲线的质量与温度变化关系可表征样品的热稳定性。
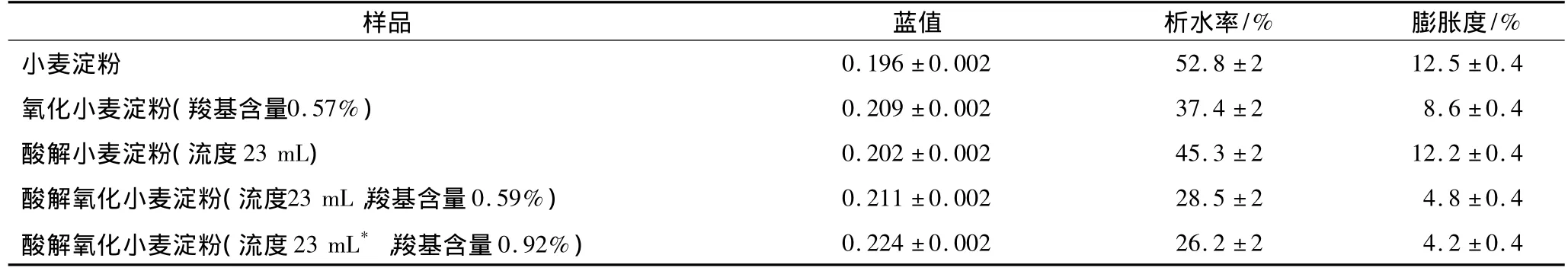
表2 蓝值、冻融稳定性、膨胀能力
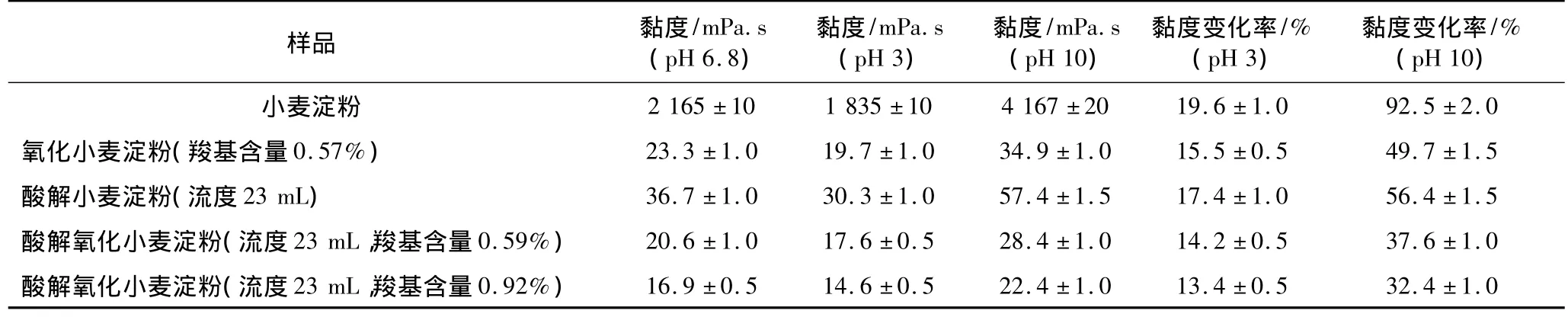
表3 抗酸性、抗碱性
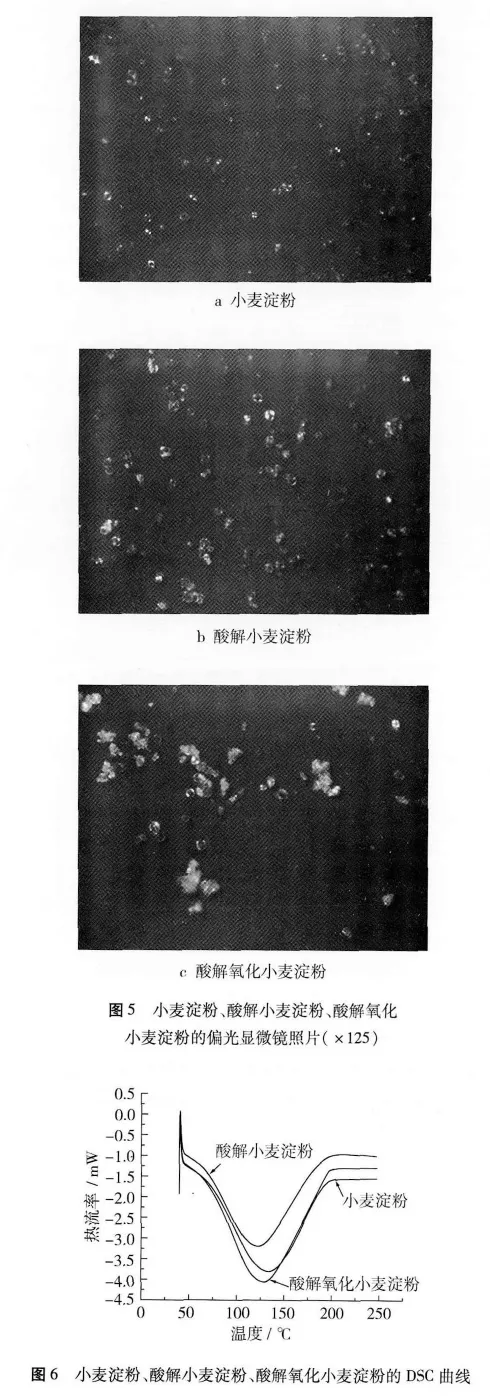
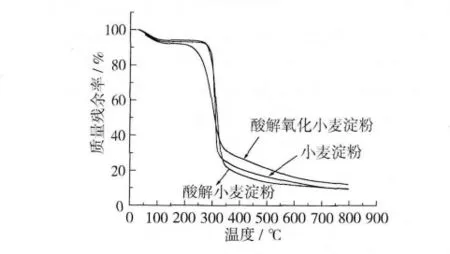
图7 小麦淀粉、酸解小麦淀粉、酸解氧化小麦淀粉的TGA曲线
从图6、图7可以看出,小麦淀粉经酸解后,其吸收峰的起始温度(To)、峰值温度(Tp)、结束温度(Tc)、熔融焓(ΔH)及分解温度均发生了变化。小麦淀粉、酸解小麦淀粉DSC与TGA曲线热力学数据如表4、表5所示。
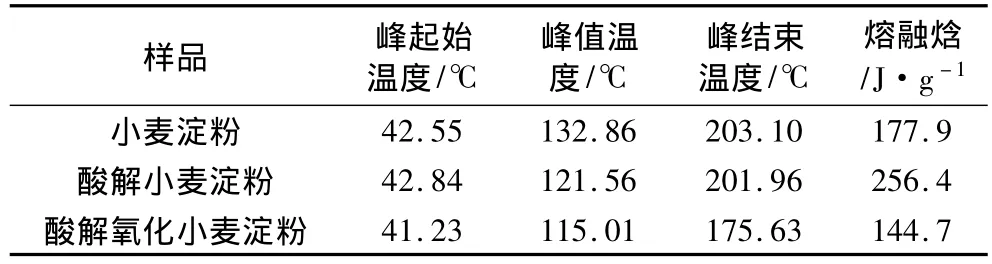
表4 峰起始温度、峰值温度、峰结束温度与熔融焓
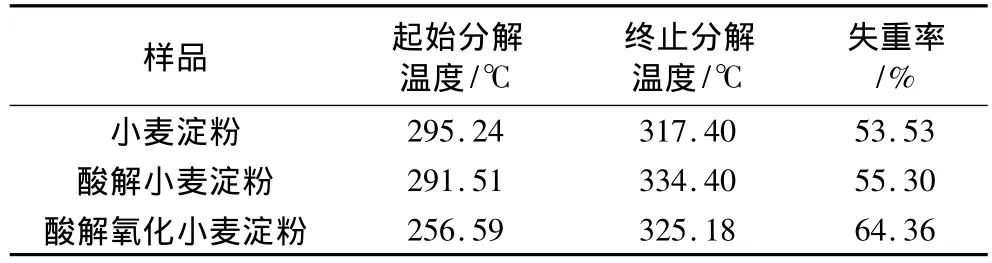
表5 起始分解温度、终止分解温度、失重率
由表4、表5可知,小麦淀粉经酸解、氧化后,其DSC曲线吸收峰的起始温度变化不大。酸解提高了小麦淀粉DSC曲线吸收峰的起始温度和熔融焓,而氧化降低了起始温度、峰值温度、结束温度和熔融焓;与酸解小麦淀粉相比,氧化使起始分解温度、终止分解温度降低,失重率增加,热稳定性降低。
3 结论
3.1 制备酸解氧化小麦淀粉的较佳工艺条件为:反应温度40℃,反应时间2 h,pH 9.0,先酸解后氧化顺序优于先氧化后酸解顺序。
3.2 小麦淀粉经酸解氧化后,其抗酸性、抗碱性、冻融稳定性均得到改善,蓝值增加,膨胀能力降低。
3.3 小麦淀粉经酸解、氧化后,其热稳定性降低,淀粉颗粒表面偏十字光减弱;酸解提高了小麦淀粉DSC曲线吸收峰的起始温度和熔融焓,而氧化降低了起始温度、峰值温度、结束温度和熔融焓。
[1]Majzoobi M,Radi M,Farahnaky A,et al.Physicochemical properties of pre-gelatinized wheat starch produced by a twin drum drier[J].Journal of Agricultural Science and Technology,2011,13(2):193 -202
[2]陶进华,施仰周.酸解工艺对小麦淀粉黏度的影响[J].粮食与饲料工业,2005(9):27-29
[3]徐洋,黄立新,赵璧秋.次氯酸钠氧化小麦淀粉反应及其性质的研究[J].现代食品科技,2010,26(8):805-809
[4]张艳萍.变性淀粉制造与应用[M].北京:化学工业出版社,2001
[5]Matsuguma L S,Lacerda L G,Schnitzler E.Characterization of native and oxidized starches of two varieties of peruvian carrot(arracacia xanthorrhiza,B.)from two production areas of paraná state,brazil[J].Brazilian Archives of Biology and Technology,2009,52(3):701 -713
[6]Hizukuri S,Kaneko T,Takeda Y.Measurement of the chain length of amylopectin and its relevance to the origin of crystalline polymorphism of starch granules[J].Biochimica et Biophysica Acta,1983,760(1):188 -191
[7]Yuan R C,Thompson D B.Freeze thaw stability of three waxy maize starch pasted measured by centrifugation and calorimetry[J].Cereal Chemistry,1998,75(4):571 -573
[8]Raina C S,Singh S,Bawa A S,et al.Some characteristics of acetylated,cross-linked and dual modified Indian rice starches[J].European Food Research and Technology,2006,223(4):561-570
[9]唐洪波,孙敏,李艳平,等.酸解、氧化马铃薯淀粉与酸解、氧化木薯淀粉性能比较[J].粮油加工,2010(7):71-73
[10]Alummoottil N J,Korappati S,Moothandasseri S S,et al.Gelatinisation properties of cassava starch in the presence of salts,acids and oxidising agents[J].Starch/St-rke,2005,57(11):547-555
[11]蓝平,蓝丽红,吴如春,等.次氯酸钠氧化淀粉的制备工艺研究[J].广西民族学院学报:自然科学版,2006,12(3):104-107
[12]胡震.氧化淀粉的制备[J].安徽农业科学,2011,39(4):2339-2340
[13]谭义秋.淀粉氧化反应机理的探究[J].农产品加工:学刊,2007(4):46-48
[14]张雯,张盛贵,张会翔,等.马铃薯氧化淀粉的工艺优化[J].甘肃农业大学学报,2008,43(4):131 -134.
