大兴安岭天然沼泽湿地生态系统碳储量
2013-09-15牟长城卢慧翠
牟长城,王 彪,卢慧翠,包 旭,崔 巍
(东北林业大学生态研究中心,哈尔滨,150040)
目前全球地表平均温度已上升(0.6±0.2)℃,其主要诱因是人类化石燃料使用及土地利用与土地覆盖变化导致大气圈中CO2、CH4和N2O等温室气体浓度增加[1]。这就引发了对全球碳循环动态及其可被管理程度深入理解的需求,以便帮助稳定大气圈中CO2浓度[2]。
湿地因其具有巨大土壤碳库、高甲烷排放及其在泥炭形成、沉积物堆积与植物生物量积累等方面的固碳潜力,使其成为全球碳循环的重要组成部分(如泥炭地仅占全球陆地表面3%,却含有近1/3全球土壤碳库(16—33%))[3-4]。
然而,由于目前在全球湿地碳储量估算方面仍存在着诸多的不确定性,尚难以客观准确地估算全球湿地的碳储量,这在一定程度上限制了人们对湿地在全球碳循环及其减缓气候变化等方面所发挥的重要作用的深入认识。这些不确定性首先表现在湿地面积的不断减少,如自工业革命以来由于气候变化(变暖变干)和人为活动(如泥炭采掘、开垦湿地、排水造林及发展城市等)干扰影响,全球湿地总面积已减少68%[3,5-8],这使得湿地碳储量估算无论是在局地、国家、区域和全球尺度上,还是在全球碳循环影响方面均存在着较大的不确定性[3,9-10]。其次,湿地碳储量测定方法上仍存在一些问题,例如,目前依据全球陆地土壤平均深度1m标准,得到全球湿地碳储量估计值为225 Pg(1Pg=1015g)[7],这与早期湿地碳储量估计值(180—249 Pg)[11-12]相一致;但有学者认为早期利用陆地土壤平均深度1m估计湿地碳储量不尽合理,这样可能低估了湿地碳储量,并采用平均泥炭层厚度230cm估计了北方和亚北极泥炭地碳储量,得到全球湿地碳储量估计值为445 Pg[3],较早期估计值提高了近1倍。此外,其他学者则认为不同气候区的湿地碳储量变异性较大,而且还受到植被类型、景观及水文条件的强烈影响[3,9-10,13-15]。因此,目前尚有必要查清不同气候区域及不同湿地类型的分布面积和碳储量,方能最终实现全球湿地碳储量的准确估算。
全球泥炭湿地及其碳储量主要集中分布于温带和北方区域,热带区域仅占10—30%[7],中国东北温带和寒温带气候区恰恰处于这一全球湿地集中分布区域之中,且以森林沼泽湿地为主体(主要分布于长白山和大、小兴安岭林区)的山地湿地面积达452.31万hm2,是我国森林沼泽湿地最集中的分布区[16-17]。目前国内有关东北山区森林湿地碳循环的研究主要集中在温室气体排放方面[18-31],而有关其碳储量方面的研究尚属起步阶段[32-35]。
本文以我国寒温带大兴安岭沿沼泽至森林方向湿地过渡带环境梯度上依次分布的5种典型天然沼泽湿地(草丛沼泽、灌丛沼泽、毛赤杨沼泽、白桦沼泽和落叶松沼泽)为研究对象,采用碳/氮分析仪测定法与标准木解析法,研究天然湿地生态系统碳储量(植被和土壤)、净初级生产力、年固碳量及其沿湿地过渡带水分环境梯度的分布格局,揭示其空间变异规律性,并定量评价各沼泽湿地类型的生态系统碳储量与固碳能力,以便为深入了解寒温带天然沼泽湿地长期碳汇作用提供科学依据。
1 研究区概况与研究方法
1.1 研究区概况
研究地点位于大兴安岭南翁河国家级自然保护区,处于北纬 51°05'07″—51°39'24″、东经 125°07'55″—125°50'05″,海拔高度一般为500—800m,气候属于寒温带大陆性季风气候,年平均气温-3℃,极端最低温度-48℃,年日照时数2500 h,无霜期90—100 d,植物生长期为110 d,年降雨量500 mm。本地区地带性土壤为棕色针叶林土壤,此外还有暗棕壤、草甸土、沼泽土、泥炭土。地带性植被为寒温带针叶林,但在宽阔平缓的谷地,随地势升逐渐高,地下水位逐渐降低,积水周期逐渐变短,积水逐渐减少,泥炭层逐渐变薄,形成了森林湿地过渡带水分环境梯度,其上依次分布有草丛沼泽、灌丛沼泽、毛赤杨沼泽、白桦沼泽和落叶松沼泽等该地区主要天然沼泽湿地类型。
1.2 研究方法
1.2.1 样地设置
本研究于2011年5月下旬即生长季初期进行样地设置,首先在研究区选取典型的天然森林湿地过渡带,然后沿着自沼泽到森林方向过渡带水分环境梯度,依次设置草丛沼泽、灌丛沼泽、毛赤杨沼泽、白桦沼泽、落叶松沼泽五种沼泽湿地类型的标准地(各样地地下水位依次距地表8—12cm、15—21cm、25—30cm、32—40cm和41—45cm)。标准地面积为20m×30m,每一沼泽类型均为3次重复,共计设置15块固定标准地。于2011年5月(生长开始期)对标准地的林木进行了每木调查,并在当年9月(生长结束期)对标准地的林木再次进行每木调查,同时采集植被、土壤以及凋落物样品。试验地主要乔木树种为兴安落叶松(Larix gmelinii),白桦(Betula platypyhlla)和毛赤杨(Alnus sibirica var.hirsuta),灌木层主要有油桦(Betula ovalifolia)、笃斯越橘(Vaccinium uliginosum)和细叶杜香(Ledum palustre),草本层主要有臌囊苔草(Carex schmidtii)、白毛羊胡子草(Eriophorum vaginatum)和小叶章(Calamagrostis angustifolia)。
1.2.2 植被碳储量测定
乔木层生物量调查:首先对落叶松沼泽、白桦沼泽、毛赤杨沼泽各标准地中胸径大于4cm林木进行每木检尺;然后按2 cm划分径级选取各径级标准木(在各类型标准地附近相同林分中选取),其中落叶松、白桦和毛赤杨各12株,共计选择36株标准木,并实测标准木的树干、树枝、树叶、树根的生物量。通过建立胸径与生物量的回归方程(表1),即W=a(Db),W为各器官生物量,D为林木的胸径,a、b为系数,通过计算进行拟合,进而结合林分径级分布计算出天然状态下各沼泽类型乔木层的生物量。
灌木层与草本层生物量测定:在每个标准地(20 m×30 m)的中心与四角设置5个2 m×2 m灌丛样方,随机设置10个1 m×1 m的草丛样方,采用收获法,获取灌木层与草本层地上与地下的生物量鲜重,并对其进行取样,在70℃下烘干至恒重,计算两者含水率,得到灌、草丛生物量干重。
凋落物生物量测定:于秋季落叶后在各样地中分别设置10个20 cm×20 cm的样方,收集其中全部凋落物装入封口袋,带回实验室,在70℃下烘干至恒重,得到凋落物的生物量。
植被碳储量测定:利用碳/氮分析仪 Multi N/C 3100和 HT 1300 Solids Module(Analytik Jena AG,Germany)通过1300℃干烧法测定乔木层、灌木层、草本层、凋落物层有机碳含量,然后用各组分的生物量乘以碳含量,可得到乔木层、灌木层、草本层与凋落物层的碳储量,将四者加和即可获得植被的碳储量。
1.2.3 土壤碳储量测定
在每个标准样地中心,以“品”字形设置3个土壤剖面,共计调查土壤剖面45个。由于土层较浅,50 cm以下即为母质层,下层取样深度到50 cm为止。确定土壤剖面后,用土壤环刀(100 cm3)在0—50 cm每10 cm为一取样层,土样用铝盒封装,带回实验室在烘箱105℃下烘干24 h后,测定其土壤容重;同时在同一土层深度取约500 g土样装入样品袋,带回实验室风干后,取出其中大于2 mm的根系或岩石后,在70℃下烘干24 h,研磨粉碎后过2 mm土壤筛,利用 Multi N/C 3100分析仪和 HT1300 Solid Module(Analytik Jena A G,Germany)测定土壤有机碳含量,并利用以下公式计算土壤有机碳储量。

某一土层i的有机碳密度(SOCi,kg/m2)的计算公式为:式中,Ci为土壤有机碳含量 (g/kg),Di为容重 (g/cm3),Ei为土层厚度(cm),Gi为直径大于2 mm的石砾所占的体积百分比(%)。
如果某一土壤剖面由k层组成,那么该剖面的碳密度(SOCi,kg/m2)[36]为:

1.2.4 净初级生产力和植被年净固碳量测定
乔木层净初级生产力是通过计算2011年5月(生长开始期)和9月(生长停止期)生物量的差值得到,灌木层净初级生产力为其生物量除以平均年龄(5a)[35,37],草本层净初级生产力为其地上部分与地下部分当年生物量加和(地上部分全部视为当年生,地下部分选取靠近茎干、颜色较浅部分作为当年生新根);乔木层、灌木层、草本层的年净固碳量通过各自的年净初级生产力与其相应的碳含量的乘积获得,将三者加和即可达到各沼泽类型的植被年净固碳量。
1.2.5 数据处理
文中数据均采用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),采用最小显著差异法(LSD)分析不同数据组间的差异性,显著性水平设置为α=0.05。

表1 大兴安森林沼泽群落建群种兴安落叶松、白桦和毛赤杨相对生长方程Table 1 Relative growth equations for Larix gmelinii,Betula platyphlla and Alnus sibirica var.hirsuta of forested wetlands in Daxing'anling of China
2 结果与分析
2.1 大兴安岭5种天然沼泽湿地植被碳储量
由表2可以得到,大兴安岭5种典型天然沼泽湿地的植被碳储量存在较大差异性。沿着沼泽至森林方向过渡带水分环境梯度依次分布的草丛沼泽、灌丛沼泽、毛赤杨沼泽、白桦沼泽、落叶松沼泽的植被碳储量分布在(0.48±0.08)—(8.33±0.66)kg/m2,灌丛沼泽和3种森林沼泽的植被碳储量较草丛沼泽增加了2.3倍和6.9—16.4倍,且3种森林沼泽显著高于灌丛沼泽和草丛沼泽,白桦沼泽与落叶松沼泽显著高于毛赤杨沼泽(P<0.05)。因此,大兴安岭5种典型天然沼泽湿地的植被碳储量沿过渡带环境梯度呈现出递增趋势。
此外,这5种天然沼泽湿地植被碳储量的垂直分配格局也不同。草丛沼泽的植被碳储量以草本层占优势地位(67.56%)、凋落物层次之(32.44%),且其草本层碳储量显著高于灌丛沼泽与森林沼泽的草本层(2.3倍和6.4—10.7倍,P<0.05);灌丛沼泽植被碳储量以灌木层占优势地位(76.70%)、凋落物层次之(13.69%)、草本层比重最小(9.61%),其灌木层碳储量显著高于森林沼泽的灌木层(5.3—15.9倍,P<0.05);3种森林沼泽植被碳储量均以乔木层占绝对优势地位(86.41%—93.64%)、凋落物层次之(4.77%—9.25%)、灌木层相对较小(0.89%—3.54%)、草本层比重最小(0.32%—1.25%),但三者乔木层的碳储量存在显著差异,白桦沼泽和落叶松沼泽乔木层碳储量为毛赤杨沼泽乔木层的2.4倍和2.1倍(P<0.05)。由此可见,草丛沼泽和灌丛沼泽植被碳储量相对较低主要源于垂直组织层次不完整(前者缺乏乔木层和灌木层,后者缺乏乔木层);毛赤杨沼泽植被碳储量之所以居于中等主要是源于乔木层碳储量相对较低。

表2 大兴安岭5种典型天然沼泽湿地的植被碳储量及其分配Table 2 Carbon storage and allocation proportion of five kinds of natural wetlands vegetation in Daxing'anling of China
2.2 大兴安岭5种天然沼泽湿地土壤碳储量
由表3可以得到,大兴安岭5种典型天然沼泽湿地的土壤碳储量存在显著差异性。沿沼泽至森林方向过渡带环境梯度依次分布的草丛沼泽、灌丛沼泽、毛赤杨沼泽、白桦沼泽、落叶松沼泽的土壤碳储量分布在(19.21±6.17)—(38.28±4.86)kgC/m2,灌丛沼泽和3种森林沼泽的土壤碳储量分别较草丛沼泽降低了13.6%和24.2%—49.8%,且5种天然沼泽湿地类型之间在土壤碳储量方面均存在着显著差异性(P<0.05)。因此,大兴安岭天然沼泽湿地土壤碳储量沿过渡带环境梯度呈现出递减趋势。
进一步分析得到5种天然沼泽湿地土壤碳储量的分布格局也存在差异性。在垂直分布上,草丛沼泽可分为0—40cm高碳储量层(19.9%—26.8%)和40—50cm低碳储量层(4.7%)2个土壤层;灌丛沼泽、毛赤杨沼泽、落叶松沼泽、白桦沼泽均可分为0—30cm高碳储量层(20.0%—33.2%)、30—40cm中碳储量层(11.9%—16.1%)和40—50cm低碳储量层(4.2%—5.6%)3个土壤层,且呈现出随土壤深度增加而递减的分布规律性。可见,草丛沼泽以0—40cm土壤层占绝对优势地位(95.3%),灌丛沼泽和森林沼泽则以0—30cm土壤层占优势地位(79.7%—82.5%)。在水平分布上,草丛沼泽在0—40cm各土壤层中碳储量均显著高于3种森林沼泽相应的土壤层(12.0%—293.9%,P<0.05),仅在30—40cm土壤层显著高于灌丛沼泽(81.1%,P<0.05);灌丛沼泽分别在10—20cm、0—40cm和10—30cm土壤层显著高于毛赤杨沼泽、白桦沼泽和落叶松沼泽(16.0%、32.5—137.5%、29.2%—81.7%,P<0.05);毛赤杨沼泽分别在在0—40cm、20—30cm土壤层显著高于白桦沼泽和落叶松沼泽(21.0%—104.4%、51.2%,P<0.05);落叶松沼泽仅在10—20cm土壤层显著高于白桦沼泽(22.9%,P<0.05)。这说明各沼泽类型在0—40cm各土壤层中碳储量分布的差异性是导致其土壤碳储量沿过渡带环境梯度呈现递减型分布的主要原因。
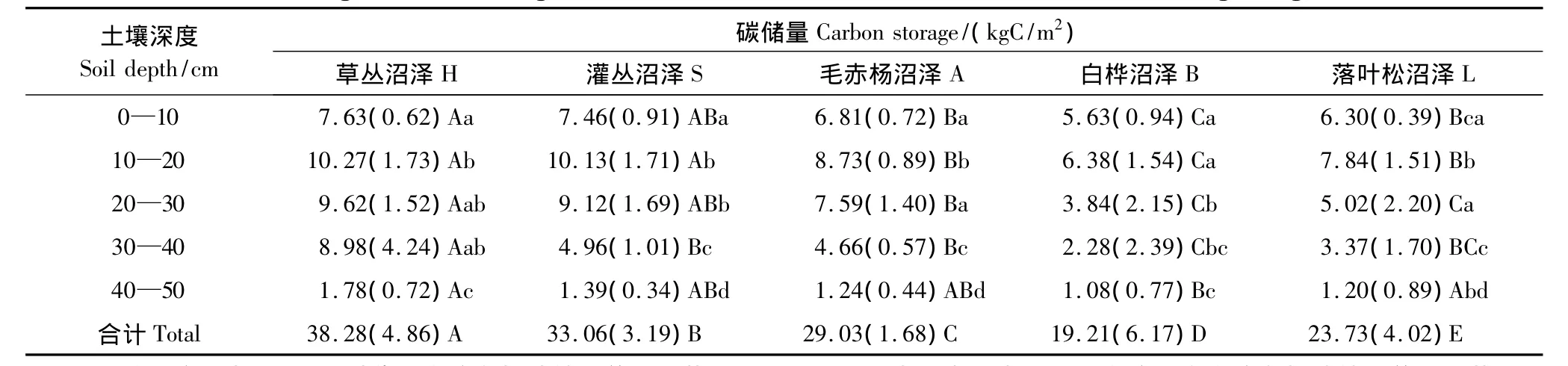
表3 大兴安岭5种典型天然沼泽湿地土壤有机碳储量及其分布特征Table 3 Soil organic carbon storage and its vertical distribution of five kinds of wetlands in Daxing'anling of China
2.3 大兴安岭5种天然沼泽湿地生态系统碳储量
2.4 大兴安岭天然沼泽湿地植被净初级生产力与植被年净固碳量
由表5可以得到,大兴安岭5种天然沼泽湿地植被净初级生产力与年净固碳量有所不同。草丛沼泽、灌丛沼泽、毛赤杨沼泽、白桦沼泽、落叶松沼泽净初级生产力分布在(0.68±0.10)—(1.08±0.12)kg·m-2·a-1,与净初级生产力最低的落叶松沼泽相比依次提高了17.7%、30.9%、58.8%、27.9%,但仅有毛赤杨沼泽为显著提高(P<0.05);植被年净固碳量分布在(0.32±0.09)—(0.51±0.06)kgC·m-2·a-1,与年净固碳量最低的草丛沼泽和落叶松沼泽相比依次提高了21.9%、59.4%、28.1%,也仅有毛赤杨沼泽为显著提高(P<0.05)。因此,大兴安岭5种天然沼泽湿地中毛赤杨沼泽的净初级生产力最高,草丛沼泽、灌丛沼泽、白桦沼泽居中等,落叶松沼泽最低;且毛赤杨沼泽年净固碳量也最高,灌丛沼泽和白桦沼泽居中等,草丛沼泽和落叶松沼泽年净固碳量最低。
同时,各沼泽湿地植被净初级生产力与年净固碳量在各组成层次上分布不同。草丛沼泽净初级生产力和年净固碳量仅由草本层所决定(100.0%);灌丛沼泽由灌木层和草本层组成,以灌木层占优势地位(61.8%和
由表4可以得到,大兴安岭5种典型天然沼泽湿地的生态系统碳储量相近。沿沼泽至森林方向过渡带环境梯度依次分布的草丛沼泽、灌丛沼泽、毛赤杨沼泽、白桦沼泽、落叶松沼泽生态系统碳储量分布在(27.54±7.16)—(38.28±4.86)kgC/m2,灌丛沼泽和3种森林沼泽的生态系统碳储量较草丛沼泽降低了10.6%和15.3%—28.9%,呈现出递减趋势,但仅草丛沼泽与白桦沼泽之间存在着显著的差异性(P<0.05)。因此,大兴安岭5种典型天然沼泽湿地的生态系统碳储量沿过渡带环境梯度基本上呈现恒定型分布格局。
此外,各类型沼泽生态系统碳储量的组成结构有所不同。草丛沼泽和灌丛沼泽生态系统碳储量以土壤碳储量占绝对优势地位(95.4%—98.8%),植被碳储量仅占很少比重(1.2%— 4.6%);森林沼泽生态系统的碳储量仍以土壤碳储量占优势地位(69.8%—88.4%),但植被碳储量所占比重有较大幅度增加(11.6%—30.3%)。这说明各沼泽类型发挥碳汇功能的方式有所不同,草丛沼泽和灌丛沼泽主要是以形成泥炭方式将碳素储存在土壤中,而森林沼泽则以形成泥炭与积累植被生物量两种方式储存碳素。64.1%),草本层占次要地位(38.2%和35.9%);森林沼泽(毛赤杨沼泽、白桦沼泽、落叶松沼泽)由乔木层、灌木层和草本层组成,以乔木层占绝对优势地位(79.4%—88.5%和81.2%—90.3%),草本层次之(8.0%—11.1%和7.3%—9.8%),灌木层最低(3.5%—10.3%和2.4%—9.4%)。可见,灌丛沼泽的灌木层和草本层的净初级生产力或年固碳量约为6∶4,森林沼泽的乔木层与林下植被的净初级生产力或年固碳量约为8∶2或9∶1,说明组成植被的次要层次在其生产力方面也具有一定程度的作用。

表4 大兴安岭五种天然沼泽湿地生态系统有机碳储量及其分配Table 4 Ecosystem organic carbon storage and allocation proportion of five kinds of natural wetlands in Daxing'anling of China
此外,各沼泽植被组成层次的初级生产力与年净固碳量沿过渡带环境梯度分布不同。草丛沼泽草本层的初级生产力和年净固碳量较灌丛沼泽、3种森林沼泽草本层提高了1.4倍、5.7—10.4倍和1.3倍、5.4—9.7倍,且三者之间均存在着显著差异性(P<0.05),呈现出沿过渡带环境梯度而递减的分布规律性;灌丛沼泽灌木层的初级生产力和年净固碳量较3种森林沼泽灌木层提高了6.9—17.3倍和7.3—23.0倍,且两者之间差异显著(P<0.05);毛赤杨沼泽和白桦沼泽乔木层的净初级生产力和年净固碳量较落叶松沼泽乔木层提高了42.6%—68.5%和42.3%—69.2%,且前两者与后者之间差异显著(P<0.05)。正是由于这些植被组成层次的初级生产力与年净固碳量沿过渡带环境梯度分布不同,才形成了各类型沼泽植被的净初级生产力与年净固碳量沿过渡带环境梯度的分布格局。

表5 大兴安岭5种天然沼泽湿地植被净初级生产力与年植被净固碳量Table 5 Net primary productivity and vegetation net carbon sequestration of five kinds of natural wetlands in Daxing'anling of China
3 结论与讨论
3.1 天然沼泽湿地植被碳储量
本研究得到大兴安岭5种典型天然沼泽湿地的植被碳储量(0.48—8.33 kgC/m2)沿湿地过渡带环境梯度呈递增规律性。这可能主要由于自沼泽到森林方向的过渡带存在着水分环境梯度(随着地势缓慢升高,地下水位由距地表8—12cm逐渐降低至41—45cm),植物适应过渡带水分环境,依次形成了草丛沼泽、灌丛沼泽、毛赤杨沼泽、白桦沼泽、落叶松沼泽等湿地群落类型,其中草丛沼泽和灌丛沼泽由于缺少乔木层致使两者的植被碳储量相对较小,毛赤杨沼泽群落建群种毛赤杨为亚乔木种且寿命相对较短(30—35a)致使其植被碳储量高于前两者但低于后两者,而白桦沼泽和落叶松沼泽群落建群种白桦和落叶松均为乔木树种且寿命相对较长(前者70—80a、后者150—200a)能够积累相对较多的生物量及碳量,结果导致这些天然沼泽湿地的植被碳储量沿过渡带呈递增规律性。
此外,大兴安岭天然沼泽湿地的植被碳储量与北方森林植被固碳估计值4.0—6.4 kgC/m2[38]相比,草丛沼泽和灌丛沼泽植被碳储量仅为其下限值的12.0%和39.8%,毛赤杨沼泽与其下限值接近(95.0%),而落叶松沼泽和白桦沼泽则高于其上限值(17.2%和30.2%)。因此,大兴安岭天然森林沼泽植被的碳储量与北方森林植被的碳储量相近或略高,但草丛沼泽和灌丛沼泽植被的碳储量却远低于北方森林。
3.2 天然沼泽湿地土壤碳储量
本研究得到大兴安岭5种天然沼泽湿地的土壤碳储量(19.2—38.3 kgC/m2)沿湿地过渡带环境梯度呈递减规律性。分析其原因,可能其主要还是由于过渡带存在着水分环境梯度,在过渡带下部生境地段积水严重,形成了较厚的泥炭层(40—50cm),随着地势逐渐提高,积水逐渐减轻,泥炭层逐渐变薄,至过渡带上部生境地段泥炭层则降至最低值(15—20cm),结果导致其土壤碳储量沿过渡带呈现递减趋势。
进一步与我国天然林土壤碳储量(10.9 kgC/m2)[39]和北方森林土壤碳储量(8.5 kgC/m2)[37]相比较,大兴安岭5种天然沼泽湿地土壤碳储量为前者的1.8—3.5倍,后者的2.3—4.5倍,这说明沼泽湿地土壤的碳汇功能强于森林土壤。
3.3 天然沼泽湿地生态系统碳储量
本研究得到大兴安岭5种典型天然沼泽湿地的生态系统碳储量(27.5—38.8 kgC/m2)沿过渡带环境梯度基本上呈恒定分布规律性。这可能主要是由于沿沼泽至森林方向过渡带水分环境梯度各类型沼泽湿地的植被碳储量总体上呈递增趋势,而土壤碳储量总体上呈递减趋势,两者综合作用导致各类型沼泽生态系统的碳储量相近。这一研究结果说明草丛沼泽、灌丛沼泽、森林沼泽在碳汇方面具有同等重要性,只是三者的固碳方式有所不同而以(草丛沼泽与灌丛沼泽以形成泥炭一种固碳方式为主,而森林沼泽则是以形成泥炭与树木生物量积累两种固碳方式同时发挥作用)。
此外,大兴安岭5种典型天然沼泽湿地的生态系统碳储量为北方森林生态系统碳储量(12.5—14.9 kgC/m2)[38]的1.8—3.1 倍,但接近北方泥炭地生态系统碳储量的下限值(39—134 kgC/m2)[38](低于下限值0.6%—29.5%),说明大兴安岭天然沼泽湿地生态系统碳储量高于北方森林但略低于北方泥炭地。这可能是由于其分布在北方泥炭地的南部边缘,温度相对较高,微生物分解过程相对较快,致使其土壤层泥炭积累速率有所降低。
3.4 天然沼泽湿地植被净初级生产力与年固碳量
大兴安岭5种天然沼泽湿地植被净初级生产力分布在0.68—1.08 kg·m-2·a-1之间(且毛赤杨沼泽最高,草丛沼泽、灌丛沼泽、白桦沼泽居中(0.80—0.89 kg·m-2·a-1),落叶松沼泽最低),这一研究结果与现有中国东北植被净初级生产力(0.6—1.4 kg·m-2·a-1)[40-42]的研究结论相一致,接近温带森林沼泽植被净初级生产力(1.0—1.5 kg·m-2·a-1)[43-44]的下限,但一般均高于寒温带兴安落叶松天然林植被的净初级生产力(0.76 kg·m-2·a-1)[45](仅落叶松沼泽略低(10.5%),其他4种沼泽类型提高幅度为5.3%—42.1%)。因此,寒温带大兴安岭天然沼泽湿地的植被净初级生产力整体上相对较高。
同时,大兴安岭天然沼泽湿地植被的年净固碳量分布在0.32—0.51 kgC·m-2·a-1之间(且毛赤杨沼泽最高,灌丛沼泽和白桦沼泽居中等(0.39—0.41 kgC·m-2·a-1),草丛沼泽和落叶松沼泽最低(0.32 kgC·m-2·a-1)),这与中国陆地植被固碳能力(0.49 kgC·m-2·a-1)[46]和全球平均植被固碳能力(0.41 kgC·m-2·a-1)[47]相比,仅毛赤杨沼泽植被固碳能力高于全国与全球平均值,灌丛沼泽和白桦沼泽达到或接近全球平均值,而草丛沼泽和落叶松沼泽植被固碳能力略低于全球平均值(22.0%)。因此,大兴安岭这5种典型天然沼泽湿地的植被固碳能力虽有所区别,但均属于碳汇功能相对较强的沼泽湿地植被类型。
[1] Houghton J T,Maccarthy J J,Metz B.Climate Change 2001:Contribution of Working GroupⅡ to the Third Assessment Report of the Intergovernmental Panel on Climate Change.Impacts,Adaption,and Vulnerability.Cambridge:Cambridge University Press,2001:267-269.
[2] Canadell JG,Ciais P,Cox P,Heimann M.Quantifying,understanding and managing the carbon cyclein the next decades.Clim.Change,2004,67(2/3):147-160.
[3] Gorham E.Northern peatlands:role in the carbon cycle and probable responses to climatic warming.Ecological Applications,1991,1(2):182-195.
[4] Maltby E,Immirzi P.Carbon dynamics in peatlands and other wetland soils regional and global perspectives.Chemosphere,1993,27(6):999-1023.
[5] Jenkinson D S,Adams D E,Wild A.Model estimates of CO2emissions from soil in response to global warming.Nature,1991,351:304-306.
[6] Larson D L.Effects of climate on numbers of northern prairie wetlands.Climatic Change,1995,30(2):169-180.
[7] IPCC,Special Report:Land Use,Land-Use Change,and Forestry.Cambridge:Cambridge University Press,2000.
[8] Neher D A,Barbercheck M E,El-Allaf SM,AnasaO.Effects of disturbance and ecosystem on decomposition.Applied Soil Ecology,2003,23(2):165-179.
[9] Bai J,Ouyang H,Deng W,Zhu Y,Zhang X,Wang Q.Spatial distribution characteristics of organic matter and total nitrogen of marsh soils in river marginal wetlands.Geoderma,2005,124(1/2):181-192.
[10] Roulet N T.Peatlands,carbon storage,greenhouse gases,and the Kyoto protocol:prospects and significance for Canada.Wetlands,2000,20(4):605-615.
[11] Armentano TV,Menges E S.Patterns of change in the carbon balance of organic soil-wetlandsof the temperate zone.Journal of Ecology,1986,74(3):755-774.
[12] Post W M,Emanuel W R,Zinke P J,Stangenberger A G.Soil carbon pools and world life zones.Nature,1982,298,156-159
[13] Tolonen K,Vasander H,Damman A W H,Clymo R S.Preliminary estimate of long-term carbon accumulation and loss in 25 boreal peatlands.Suo,1992,43(4/5):277-280.
[14] Bockheim JG,Hinkel K M,Nelson F E.Predicting carbon storage in tundra soils of Arctic Alaska.Soil Science Society of America Journal,2003,67(3):948-950.
[15] Moore T R,Turunen J.Carbon accumulation and storage in mineral subsoil beneath peat.Soil Science Society of America Journal,2004,68(2):690-696.
[16] Lang H Q.Wetland Vegetation in China.Bei jing:Science Press,1999.
[17] Li W H,Zhou X F,Liu X T.Forest and Wetlands Restoration and Stratagem of Forest Development in Northeast,China.Beijing,Science Press,2007.
[18] Gu H,Mu CC,Zhang BW,Yu L L.Short-term effects of fire disturbance on greanhouse gases emission from hassock and shrubs forested wetland in Lesser Xing'an Mountains,Northeast China.Acta Ecologica Sinica,2012,32(19):6044-6055
[19] Gu H,Mu CC,Zhang B W.Dynamics of greenhouse gases emission and its impact factors by fire disturbance from Alnus sibirica forested wetland in Xiaoxing'an Mountains,Northeast China.Acta Ecologica Sinica,2012,32(24):7808-7817.
[20] Mu C C,Zhang B W,Han L D,Yu L L,Gu H.Short-term effects of fire disturbance on greanhouse gases emission from Betula platyphyllaforested wetland in Xiaoxing'an Mountains,Northeast China.Chinese Journal of Applied Ecology,2011,22(4):857-865.
[21] Yu L L,Mu C C,Gu H,Zhang B W.Effects of fire disturbance on greanhouse gas emission from Larix gmelinii-Carex schmidtii forested wetlands in XiaoXing'an Mountains,Northeast China.Acta Ecologica Sinica,2011,31(18):5180-5191.
[22] Sun X X,Mu C C,Song C C,Wu Y X.Effects of Cutting on Methane Flux from Forested Swamps in Xiaoxing'an Mountains,Northeast China.Chinese Journal of Soil Science,2011,42(1):190-194.
[23] Sun X X,Mu C C,Song C C.Seasonal and spatial variations of methane emissions from montane wetlands in Northeast China.Atmospheric Environment,2011,45(10):1809-1816.
[24] Mu C C,Cheng W,Sun X X,Wu Y X.Seasonal Variation of Emission Fluxes of CO2,N2O and CH4from Larix gemlinii Swamps Soils in Xiaoxing'An Mountains of China.Scientia Silvae Sinicae,2010,46(7):7-15
[25] Mu C C,Liu X,Sun X X,Shi L Y,Feng D J,Cheng W,Wu Y X.Emissions of CO2,CH4and N2O from broad-leaned forested swamp soils in Xiaoxingan Mountains.Acta Ecologica Sinica,2010,30(17):4598-4608
[26] Mu C C,Wu Y X,Li W S,Xu R.Effects of forest cutting on greenhouse gas emissions from Larix gmelini-Sphagnum swamps in Lesser Xing'an Mountains of Heilongjiang,China.Chinese Journal of Applied Ecology,2010,21(2):287-293
[27] Shi L Y,Mu C C,Tian X M.CH4emission and it's driving factors from different marshs in Xiaoxing'an Mountains,Northeast China.Acta Ecologica Sinica,2010,30(19):5289-5295
[28] Mu C C,Shi L Y,Sun X X.Fluxs and contreols of CO2,CH4and N2O in a marsh wetland of Xiaoxing'an Mountains,Northeastern China.Chinese Journal of Plant Ecology,2009,33(3):617-623
[29] Sun X X,Mu C C,Shi L Y,Cheng W,Liu X,Wu Y X,Feng D J.Methane emission from forested swamp in Xiaoxing'an Mountains,Northeastern China.Chinese Journal of Plant Ecology,2009.33(3):535-545
[30] Sun X X,Mu C C,Feng D J,Liu X,Cheng W,Shi L Y.Effects of wetland draining for forestation on methane emissions in Xiaoxing'an Mountains,Northeast China.Acta Ecologica Sinica,2009,29(8):4251-4259
[31] Liu X,Mu C C,Li W S,Feng D J,Yu B.Emissions of CH4and N2O from Alnus sibirica swamps and the response to human disturbance in the Xiaoxing'an Mountains.Acta Scientiae Circumstantiae,2009,29(12):2642-2650
[32] Li W S,Mu C C,Wu Y X,Xu R.Productivity and Vegetation Carbon Density of Natural Swamp Forests in Lesser Xing'an Mountains,Heilongjiang.Journal of Northeast Forestry University,2010,38(8):39-44
[33] Zhou W C,Mu C C,Liu X,Gu H.Effects of fire disturbance on litter mass and soil carbon storage of Betula platyphylla and Larix gmelinii-Carex schmidtii swamps in the Xiaoxing'an Mountains of Northeast China.Acta Ecologica Sinica,2012,32(20):6387-6395.
[34] Zhou W C,Mu C C,Liu X,Gu H.Carbon Sink in Natural Swamp Forest Ecosystems in Lesser Xing'an Mountains.Journal of Northeast Forestry University,2012,40(7):71-75,127.
[35] Mu C C,Lu H C,Wang B,Bao X,Cui W.Short-term effects of harvesting on carbon storage of boreal Larix gmelinii-Carex schmidtii forested wetlands in Daxing'anling,northeast China.Forest Ecology and Management,2013,293(1):140-148.
[36] Yang J Y,Wang C K.Soil carbon storage and flux of temperate forest ecosystems in northeastern China.Acta Ecologica Sinica,2005,25(11):2875-2882
[37] Giese L A B,Aust WM,Kolka RK,Trettin CC.Biomass and carbon pools of disturbed riparian forests.Forest Ecology and Management,2003,180(1/3):493-508.
[38] Blais A M,Lorrain S,Plourde Y,Varfalvy L.Organic carbon densities of soils and vegetation of tropical,temperate and boreal forests.Environmental Science and Engineering,2005,155-185
[39] Liu SR,Wang H,Luan JW.A review of research progress and future prospective of forest soil carbon stock and soil carbon process in China.Acta Ecologica Sinica,2011,31(19):5437-5448
[40] Zhang X Z.Estimating and distribution of the vegetation net primary productivity in China Resources Science,1993,1:15-21
[41] Zhou G S,Zhang X S.Study on NPP of natural vegetation in China under glonal climate change.Acta Phytoecologica Sinica,1996,20(1):11-19
[42] Mao D H,Wang Z M,Luo L,Han JX.Dynamic changes of vegetation net primary productivity in permafrost zone of Northeast China in 1982—2009 in response to global change.Chinese Journal of Applied Ecology,2012,23(6):1511-1519
[43] Campbell C.Net primary production and standing biomass in northern continental wetlands.Inf.Rep.NOR-X-369,Natural Resources Canada,Canadian Forest Service,Northern Forestry Center,Edmonton,Alberta,2000.
[44] Trettin C C,Jurgensen M F,Gale M R,McLaughlin J W,McFee W W.Soil carbon in northern forested wetlands:impacts of silvicultural practices.Carbon forms and functions in forest soils,1995:437-461.
[45] Wu G,Feng Z W.Stndy on the biomass of larix spp.forest community in the frigid-temperate zone and the temperate zone of China.Journal of Northeast Forestry University,1995,23(1):95-101.
[46] He H,Pan Y Z,Zhu WQ,Liu X L,Zhang Q,Zhu X F.Measurement of terrestrial ecosystem service value in China.Chinese Journal of Applied Ecology,2005,16(6):1122-1127
[47] Li Y P,Ji J J.Simulations of Carbon Exchange Between Global Terrestrial Ecosystem and the Atmosphere.Acta Geographica Sinica,2001,56(4):379-389.
参考文献:
[16] 郎惠卿.中国湿地植被.北京:科学出版社,1998.
[17] 李文华,周晓峰,刘兴土.东北森林湿地保育与可持续发展战略研究.北京:科学出版社,2007
[18] 顾韩,牟长城,张博文,于丽丽.火干扰对小兴安岭草丛、灌丛沼泽温室气体短期排放的影响.生态学报,2012,32(19):6044-6055
[19] 顾韩,牟长城,张博文.火干扰对小兴安岭毛赤杨沼泽温室气体排放动态影响及其影响因素.生态学报,2012,32(24):7808-7817.
[20] 牟长城,张博文,韩丽冬,于丽丽,顾韩.火干扰对小兴安岭白桦沼泽温室气体排放的短期影响.应用生态学报,2011,22(4):857-865.
[21] 于丽丽,牟长城,顾韩,张博文.火干扰对小兴安岭落叶松-苔草沼泽温室气体排放的影响.生态学报,2011,31(18):5180-5191.
[22] 孙晓新,牟长城,宋长春,吴云霞.采伐对小兴安岭森林沼泽甲烷通量的影响.土壤通报,2011,42(1):190-194.
[24] 牟长城,呈伟,孙晓新,吴云霞.小兴安岭落叶松沼泽林土壤CO2,CH4和N2O的排放规律.林业科学,2010,46(7):7-15
[25] 牟长城,刘霞,孙晓新,石兰英,冯登军,呈伟,吴云霞.小兴安岭阔叶林沼泽土壤CO2、CH4和N2O排放规律及其影响因子.生态学报,2010,30(17):4598-4608
[26] 牟长城,吴云霞,李婉姝,徐蕊.采伐对小兴安岭落叶松-泥炭藓沼泽温室气体排放的影响.应用生态学报,2010,21(2):287-293
[27] 石兰英,牟长城,田新民.小兴安岭不同沼泽甲烷排放及其影响因子.生态学报,2010,30(19):5289-5295
[28] 牟长城,石兰英,孙晓新.小兴安岭典型草丛沼泽湿地CO2、CH4和N2O的排放动态及其影响因素.植物生态学报,2009,33(3):617-623
[29] 孙晓新,牟长城,石兰英,呈伟,刘霞,吴云霞,冯登军.小兴安岭森林沼泽甲烷排放及其影响因子.植物生态学报.2009,33(3):535-545
[30] 孙晓新,牟长城,冯登军,刘霞,呈伟,石兰英.排水造林对小兴安岭沼泽甲烷排放的影响.生态学报,2009,29(8):4251-4259
[31] 刘霞,牟长城,李婉姝,冯登军,于波.小兴安岭毛赤杨沼泽CH4和N2O排放规律及其对人为干扰的响应.环境科学学报,2009,29(12):2642-2650
[32] 李婉姝,牟长城,吴云霞,徐蕊.小兴安岭地区天然沼泽林生产力与植被碳密度.东北林业大学学报,2010,38(8):39-44
[33] 周文昌,牟长城,刘夏,顾韩.火干扰对小兴安岭白桦沼泽和落叶松-苔草沼泽凋落物和土壤碳储量的影响.生态学报,2012,32(20):6387-6395.
[34] 周文昌,牟长城,刘夏,顾韩.小兴安岭天然森林沼泽生态系统碳汇功能.东北林业大学学报,2012,40(7):71-75,127.
[39] 刘世荣,王晖,栾军伟.中国森林土壤碳储量与土壤碳过程研究进展.生态学报,2011,31(19):5437-5448
[40] 张宪洲.我国自然植被净第一性生产力的估算与分布.自然资源,1993,18(1):15-21
[41] 周广胜,张新时.全球气候变化的中国自然植被的净第一性生产力研究,植物生态学报,1996,20(1):11-19
[42] 毛德华,王宗明,罗玲,韩佶兴.1982—2009年东北多年冻土区植被净初级生产力动态及其对全球变化的响应.应用生态学报,2012,23(6):1511-1519
[45] 吴刚,冯宗炜.中国寒温带,温带落叶松林群落生物量的研究概述.东北林业大学学报,1995,23(1):95-101.
[46] 何浩,潘耀忠,朱文泉,刘旭拢,张晴,朱秀芳.中国陆地生态系统服务价值测量.应用生态学报,2005,16(6):1122-1127
[47] 李银鹏,季劲钧.全球陆地生态系统与大气之间碳交换的模拟研究.地理学报,2001,56(4):379-389
