杉木人工林土壤质量演变过程中土壤微生物群落结构变化
2013-09-15徐明恺汪思龙张倩茹潘华奇胡江春
刘 丽,徐明恺,汪思龙,2,张倩茹,王 楠,潘华奇,胡江春,*
(1.中国科学院沈阳应用生态研究所/森林与土壤生态国家重点实验室,沈阳 110016;2.中国科学院会同森林生态实验站,湖南 418307;3.中国科学院沈阳应用生态研究所,沈阳 110016)
杉木Cunninghamia Lanceolata是我国亚热带主要的造林树种,在我国南方林业生产中占有重要的地位。近几十年来,杉木人工林取代自然林并不断连栽引起的土壤质量恶化,生产力下降等问题凸显,严重制约了杉木人工林可持续发展[1-3]。针对杉木纯林和连栽带来的种种弊端,我国学者提出通过混交和轮栽等经营模式来缓解杉木纯林和连栽造成的土壤质量退化,达到恢复土壤肥力,提高杉木人工林可持续生产力的目的[4]。土壤微生物是土壤生态系统的重要组分部分,几乎所有的土壤过程都直接或间接的与土壤微生物有关[5]。许多学者认为森林土壤微生物及其生态功能变化是土壤质量演变的关键过程,并围绕土壤微生物和功能群开展了大量的研究[6-7]。在我国南方,随着天然阔叶林被人工林所取代,加上人工林经营管理措施(混交林模式)的影响,土壤微生物群落结构、种群多样性及功能群会随土壤质量发生改变,进而可以反映出一个生态系统土壤质量受损程度或恢复潜力。在评价人工林经营管理措施时,及时有效的监测土壤微生物及功能群变化,可为实现退化土壤生态系统恢复和人工林可持续经营提供理论依据,对揭示人工林经营引起土壤质量演变的微生物学机理具有重要意义。
当前,随着分子生物学技术的快速发展,许多方法和理念被应用到土壤微生物生态学研究中,并因此而逐渐形成了一个新的研究方向——土壤微生物分子生态学[8],极大的丰富了人们对土壤生态系统中不可培养微生物及其群落的认识[9]。我国有关土壤微生物与杉木人工林土壤质量变化的研究,主要局限于采用传统方法研究土壤微生物数量、生化作用等方面[10-11]。然而,不同人工林经营模式(连栽和混交)引起的杉木人工林土壤质量变化对土壤微生物(细菌和真菌)的群落结构和多样性产生怎样的影响?有哪些关键种群发生变化?微生物群落结构,多样性和关键种群变化与杉木人工林土壤退化/恢复之间有怎样的关系?针对这些问题,传统微生物学方法已远远不能解决。因此,尝试从分子水平来解释这些科学问题是本研究的目的,同时旨在揭示人工林经营导致土壤质量演变的微生物分子生态学机理。
1 材料与方法
1.1 研究区域与样地概况
研究地位于湖南省会同县中国科学院会同森林生态实验站(109°36'E,26°51'N),海拔200—500 m,为低山丘陵地貌,属亚热带湿润气候,年均气温16.5℃,年均降雨量约1200 mm,年均相对湿度80%,土壤为红黄壤,由板页岩发育而成,土层厚度约50 cm。地带性植被类型为典型的亚热带常绿阔叶林,组成树种多以栲树(Castanopsis spp.)和石栎(Lithocarpus spp.)为主。但是,由于人为活动的影响,原有地带性森林植被破坏严重,而代之以杉木(C.lanceolata)为主的人工林和马尾松(Pinus massoniana)为主的或以马尾松和白栎(Quercus fabri)、枫香(Liquedabar formosana)等为主的次生常绿针叶、阔叶混交林。
研究样地分为两组,一组为杉木连栽林试验地,另外一组为杉木混交林试验地。每一组试验地的坡度、坡向和海拔等立地条件一致。第1组试验地包括:常绿阔叶林(NF,native forest),平均林龄为41a,到2007年4月为止面积为10 hm2;杉木一代林(FCF,first-generation C.lanceolata plantation),1983年春在部分NF皆伐地上营造;杉木二代林(SCF,second-generation C.lanceolata plantation),1983年春在21年生杉木一代林皆伐地上营造;杉木三代林(TCF,third-generation C.lanceolata plantation),1983年春在21年生杉木二代林皆伐地上营造。3种杉木纯林种植密度2000株/hm2,每种林份面积达到3 hm2。第2组试验地营造于1990年,1989年秋杉木一代林皆伐后营造的杉木二代林(CF,C.lanceolata plantation)、杉木火力楠混交林(CFM,C.lanceolata-Michelia macclurei mixed plantation)、杉木桤木混交林(CFA,C.lanceolata-Alnus cremastogyne mixed plantation)和杉木刺楸混交林(CFK,C.lanceolata-kalopanax septemlobus mixed plantation),每种林份面积达到3 hm2。3种混交林中,杉木与阔叶树的比例为8∶2,其中杉木的种植密度约为1296株/hm2,阔叶树的种植密度为324株/hm2。CF种植密度为1620株/hm2。
1.2 样品采集与处理
2007年4月在上述8个森林类型中按照坡面由左至右分别设置3个样方(10 m×10 m),在每个样方内设4个采样点,除去表层凋落物后采集0—10 cm土壤,混合,去除植物残体和石子,过2 mm土壤筛,均匀分成3份,一份置于4℃冰箱冷藏,另一份置于-20℃冰箱冷冻,供土壤微生物DGGE分析实验;第3份置室内自然风干、磨碎、过100目孔径筛,用于土壤理化性质分析。
1.3 测定方法
1.3.1 土壤化学性质的测定
土壤pH测定,将风干供试土样制成土∶水为1∶2的混合液,静置30 min,然后用酸度计测定。土壤总有机碳和全氮测定,将风干供试土样过100目土壤筛,准确称取1.0000 g土样,土壤总有机碳和全氮采用元素分析仪vario EL III(Elementar,Germany)直接测定。土壤可溶性有机碳测定采用文献[12]的方法测定,供试土壤冷水浸提有机碳。土壤速效养分测定,土壤铵态氮、硝态氮、速效磷和速效钾的测定参照文献[13]。
1.3.2 土壤微生物总DNA提取与纯化
土壤细菌总DNA提取参照文献[14]。土壤真菌总DNA提取参照文献[15]。粗DNA采用DNA胶纯化试剂盒Kit Ver.2.0(TaKaRa)进行纯化,纯化方法参照操作说明进行。
1.3.3 PCR-DGGE
以不同土壤样品的总DNA为模板,土壤细菌16SrDNA特异片段用细菌通用引物GC+341f-907r[16]进行PCR扩增。土壤真菌28S rDNA特异片段采用通用引物GC+U1-U2[17]进行扩增。PCR和DGGE条件采用文献[18]。
1.3.4 特征条带测序和系统发育分析
DGGE特征条带在无菌操作下用刀片切下,放入 EP管中,加入30μL TE(10 mmol/L Tris-HCl;1 mmol/LEDTA,pH值8.0),4℃过夜处理。待胶中DNA溶出后,取3μL作为模板,再次进行PCR扩增,并用DGGE确认扩增结果与切胶迁移位置是否一致。确认一致后,以不带GC夹的引物进行PCR扩增。PCR产物使用试剂盒纯化,委托上海生工生物工程技术有限公司测序。将所得序列登录GenBank。应用GenBank提供的Blast进行同源性比较,并将最邻近的序列保存为FASTA格式。利用Clustal软件进行多序列比对并生成ALN格式文件,利用MEGA4.0软件包中的Seqboot软件进行分析,并应用邻接法构建系统发育树,确定所测序列微生物克隆的系统发育地位。
1.4 计算和统计方法
运用主成分分析(Principal Component Analysis,PCA)综合评价不同杉木人工林生态系统土壤肥力质量现状,确定不同杉木人工林土壤质量的变化趋势。运用图像分析软件Quantity One(4.6.2)分析DGGE图谱。利用DGGE图谱的数字化结果计算土壤样品微生物群落的Shannon-Wiener指数(H')、丰富度(S)和均匀度(EH),以此来评价土壤微生物群落结构多样性的变化。数据的方差分析、标准误差和相关性分析均采用SPSS 13.0软件进行,作图采用ORIGIN 6.0软件进行。
2 结果与分析
2.1 杉木人工林土壤质量变化主成分分析
表1中显示不同杉木人工林土壤养分、pH值和C/N比的变化。鉴于单一分析各个指标难以明确各杉木人工林土壤质量的变化,因此采用PCA方法分析土壤质量的变化趋势。
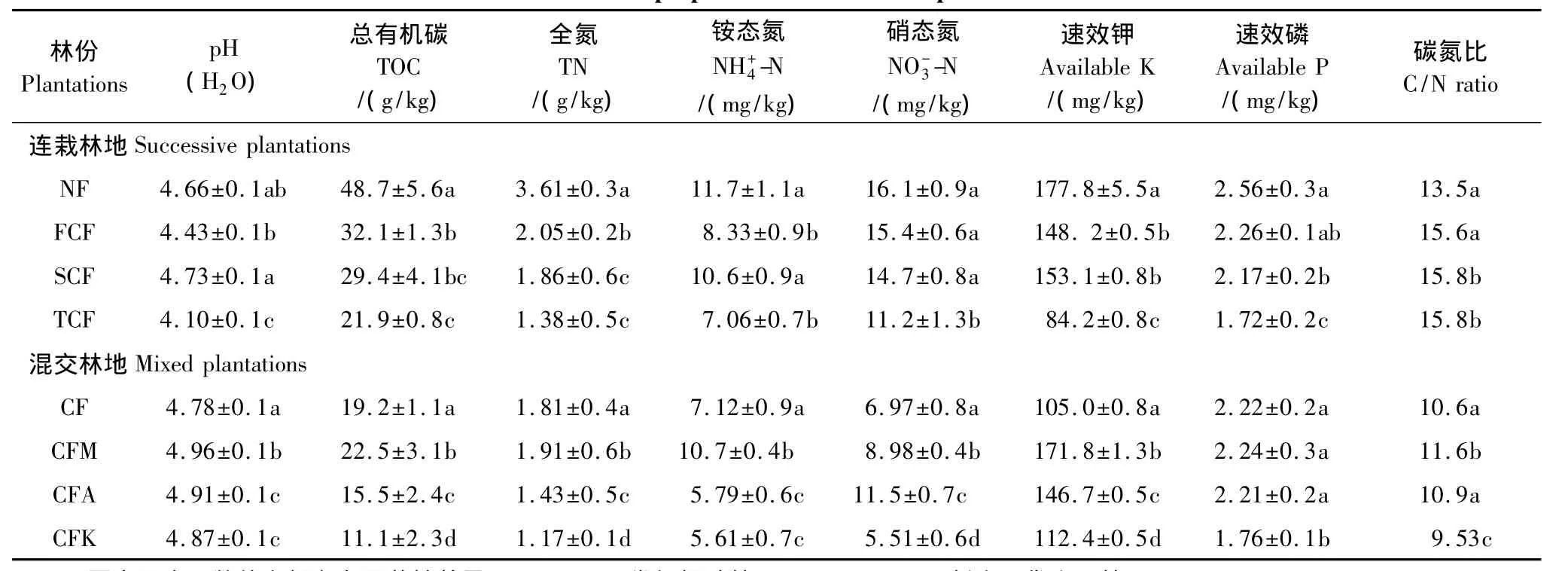
表1 不同杉木人工林土壤性质变化Table 1 Soil properties of the different plantations
运用PCA方法综合分析土壤养分变化,以各主成分特征贡献率为权重,加权计算各林地土壤质量综合主成分值(表2)。主成分值是数值经过标准化后计算的结果,正负不表示实际意义,只表示相对大小。土壤质量综合主成分数值显示,杉木人工林取代自然林导致土壤质量明显降低,并且连栽的造林模式亦导致土壤质量下降,土壤质量变化趋势为:自然林>杉木一代林>杉木二代林>杉木三代林,可见长期单一种植杉木人工林会引起土壤质量衰退(表2,图1)。杉木火力楠混交林土壤质量综合主成分值显著高于杉木纯林及其他两种杉阔混交林,说明杉木与火力楠混交后使土壤质量明显改善;杉木与桤木混交后土壤综合主成分值虽然有所增加,但是却不显著,杉木与刺楸混交后土壤综合主成分值不但没有增加,却显著下降,可见杉木与桤木、刺楸混交并未达到改善杉木人工林土壤质量的目的(表2,图1)。
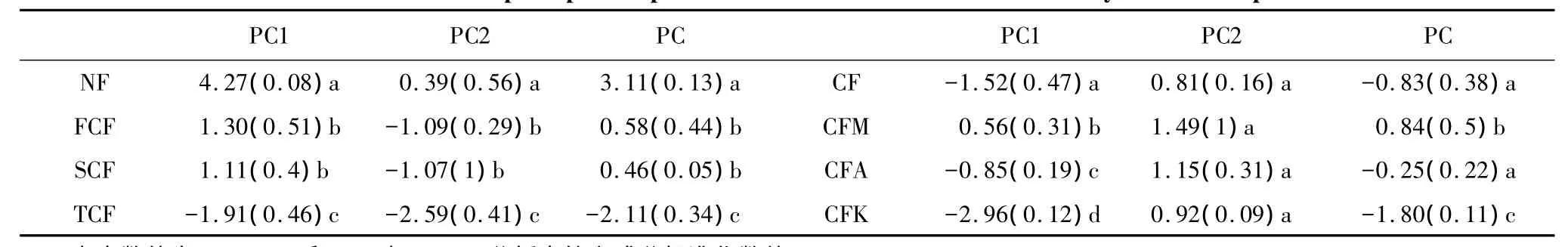
表2 不同杉木人工林土壤质量主成分数值Table 2 The values of the principal components associated with PCA of soil fertility in different plantations
通过主成分分析,将多维的土壤养分变量降维成两个变量进行分析,即第一主成分(PC1)和第二主成分(PC2),其中PC1贡献率达到54.49%,PC2贡献率达到23.22%,二者累计贡献率达到77.71%,因此这两个主成分就能够解释原始变量。表3中列出初始因子在PC1和PC2上的负荷矩阵,其中土壤pH值和碳氮比在第二主成分上有较高的负荷,说明PC2主要表示这两个初始变量的信息;其它初始因子在第一主成分上有较高负荷,说明第一主成分表示了除土壤pH值和碳氮比以外的土壤性质的信息。根据PC1和PC2的标准化数值作图(图1),可以综合直观的分析不同杉木人工林土壤质量变化趋势,避免了采用单纯分析某一土壤理化性质改变而确定森林土壤质量变化趋势的弊端。

表3 主成分分析因子负荷矩阵Table 3 Component matrix of PCA
由图1可知,NF、FCF、SCF、TCF在PC1和PC2上逐渐分离,并且在PC1上的分离较大,说明随着连栽代数的增加杉木人工林土壤质量与自然林之间的差距拉大;FCF、SCF在图中未分离,说明杉木一、二代林土壤质量相似;TCF与FCF、TCF明显分离,可见连栽杉木人工林在多代连栽的情况下土壤质量改变较大,这与综合主成分值分析的土壤质量变化趋势结果相一致。
CFM、CFA、CF和CFK在PC1上逐渐分离,在PC2上分离较小,说明这几种土壤pH值和碳氮比变化较小,而其它养分因子变化较剧烈;CF与CFA在PC1上分离很小,而与其它两种混交林分离较明显,这与表2中的综合主成分值分析相一致,说明杉木桤木混交后土壤质量变化不明显。可见在采用混交模式进行林地土壤质量恢复过程中,杉木与火力楠混交能够明显改善土壤质量。
2.2 土壤细菌群落DGGE分析
应用本实验中的总DNA提取方案,得到供试土壤细菌总DNA片段约20 kb,纯化并稀释后做为模板,采用细菌通用引物GC+341F-907R[16]对16SrRNA基因的V3—V8区进行PCR扩增,得到566 bp片段。此处图省略。
根据PCR产物在DGGE指纹图谱上的条带数目和迁移的距离,16SrDNA序列的PCR扩增与DGGE的结合运用能够从DNA水平区别不同微生物群落结构之间的差异。从图2中可以看出,某些条带为不同杉木人工林土壤所特有;随着杉木人工林取代自然林并不断连载,B5条带逐渐消失,B6、B7逐渐显现;而B6、B7条带随着杉木与阔叶树混交又逐渐减弱,而原来消失的B5条带逐渐恢复,伴随着B1、B3条带的逐渐增强,这说明随着杉木林生态系统的变化,土壤细菌群落结构组成产生了相应改变。利用DGGE图谱的数字化结果计算土壤样品细菌群落的Shannon-Wiener指数(H)、丰富度(S)和均匀度(EH),结果见图3。杉木人工林取代自然林后,随着连栽代数的增加,土壤细菌多样性和丰富度不断降低(P<0.05)。杉木与火力楠、桤木混交后细菌多样性和丰富度较杉木纯林显著提高(P<0.05),而杉木与刺楸混交则造成进一步降低(P<0.05),说明土壤细菌群落结构会随混交阔叶树种的不同而发生变化。

图1 不同杉木人工林土壤质量主成分分析点图Fig.1 Principal component(PC1 × PC2)plots generated from covariance matrix of soil physicochemical characteristics of the different plantations NF:常绿阔叶林Native forest;FCF:杉木一代人工林First-generation C.lanceolata plantation;SCF:杉木二代人工林Second-generation C.lanceolata plantation;TCF:杉木三代人工林 Third-generation C.lanceolata plantation;CF:杉木人工林C.lanceolata plantation;CFM:杉木火力楠混交林 C.lanceolata-M.macclurei mixed plantation;CFA:杉木桤木混交林 C.lanceolata-A.cremastogyne mixed plantation;CFK:杉木刺秋混交林 C.lanceolata-K.septemlobus mixed plantation

图2 土壤细菌16Sr DNA特异片段PCR-DGGE指纹图谱Fig.2 DGGE community fingerprints of 16S r DNA fragment from soil bacteria DNA extracted from soil samples under different plantations
图4 b显示杉木纯林和杉木混交林土壤细菌群落的变化,CF分别与CFM、CFA在第一主成分PC1(贡献率为48.52%)、第二主成分PC2(贡献率为33.70%)上分离,而与CFK在PC1和PC2上分离度都很小,位于同一象限内,说明杉木纯林和杉木刺楸混交林土壤细菌群落结构差异较小,与其他两种混交林差异较大。
如前所述,细菌DGGE图谱条带进行主成分分析,PC1主要表示条带强度大于150的条带信息,将DGGE图谱中这些主要特征条带中的7条切下(B1—B7),经验证后测序,将所得序列登录GenBank,获得登录号为GQ423440—GQ423446。经系统发育分析,结果显示湖南会同地区杉木人工林土壤中细菌的优势种群为αproteobacteria、β-proteobacteria、γ-proteobacteria 和 CFB类群(图5)。
从不同杉木人工林土壤细菌DGGE图谱可看出,当杉木人工林取代自然林后,土壤细菌群落结构受到影响:亲缘关系与 Sphingobacterium sp.、Pedobacter sp.、Burkholderia sp.和Lueifibra arvensicola密切的细菌种群减少;亲缘关系与Pedobacter cryoconitis密切的细菌种群受扰动较大,在杉木人工林土壤中消失;在杉木一、二和三代林土壤中均出现了亲缘关系与Rhodanobacter sp.密切的细菌种群;在连栽杉木三代林土壤中细菌群落改变最大,除与杉木一、二代林变化相同外,还出现了亲缘关系与Xanthomonas sp.密切的细菌种群(图2a,图5)。
杉木与阔叶树混交后,土壤细菌群落结构也发生改变:与杉木纯林土壤细菌群落相比,杉木火力楠混交林和杉木桤木混交林土壤细菌群落多样性和丰度有所提高,与 Burkholderia sp.、Luteifibra arvensicola、Sphingobacterium sp.和Pedobacter cryoconitis亲缘关系密切的细菌种群增加;杉木与刺秋混交后,土壤细菌群落多样性和丰度没有改善,与Sphingobacterium sp.、Pedobacter sp.、Burkholderia sp.和Luteifibra arvensicola亲缘关系密切的细菌群落消失(图2b,图5)。

图3 不同杉木人工林土壤细菌群落基因多样性指数Fig.3 Genetic diversity indices of microbial communities in different plantations
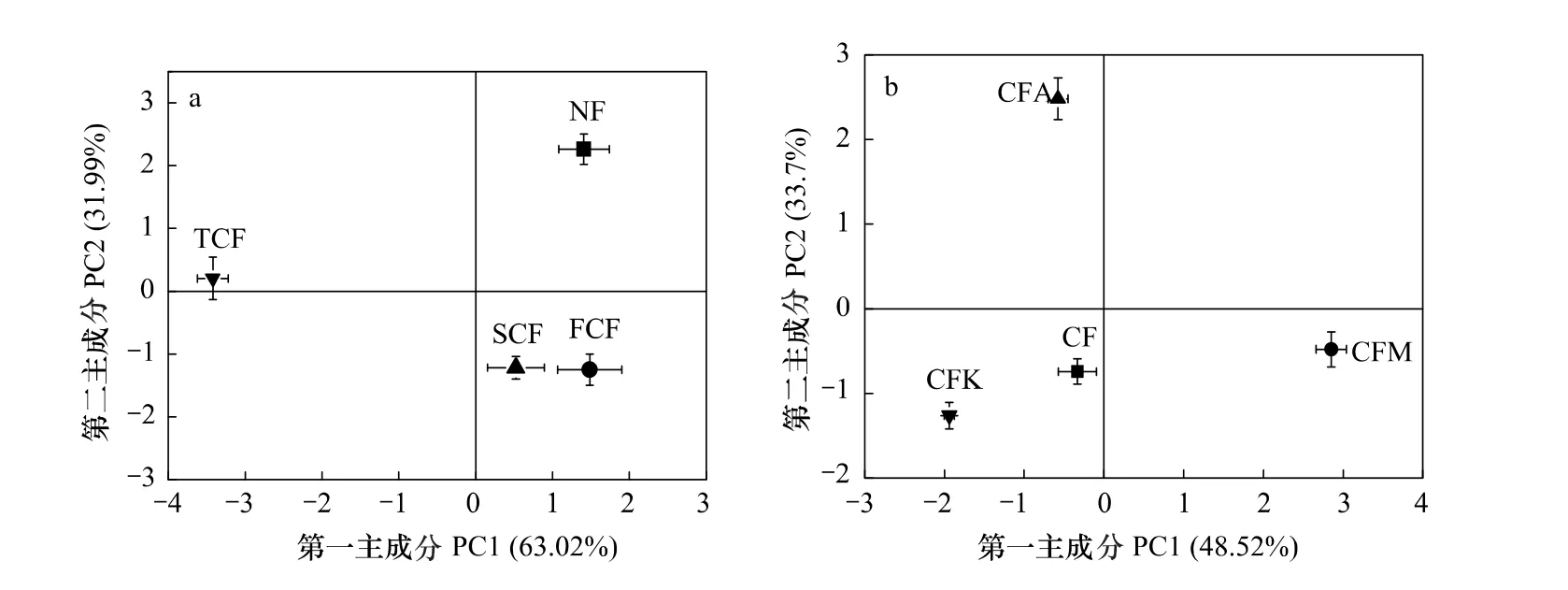
图4 不同杉木人工林土壤细菌DGGE指纹图谱主成分分析Fig.4 Principal component(PC1×PC2)plots generated from covariance matrix of B-DGGE bands obtained from soil samples under different plantations

图5 土壤细菌DGGE指纹图谱16S r DNA系统发育树Fig.5 Phylogenetic tree of all sequences of 16S r DNA from B-DGGE bands

图6 土壤真菌28S r DNA特异片段PCR-DGGE指纹图谱Fig.6 DGGE community fingerprints of 28S r DNA fragment from soil fungi DNA extracted from soil samples under different plantations
2.3 土壤真菌群落DGGE分析
采用真菌通用引物GC+U1-U2[17]对28SrRNA基因部分片段进行PCR扩增,得到260 bp片段。此处图省略。
图6显示不同杉木人工林土壤真菌特异性PCR-DGGE图谱,随着杉木人工林取代自然林并不断连栽,土壤真菌群落结构的变化较明显,尤其是NF与TCF土壤真菌DGGE图谱特征条带的变化;杉木与阔叶树混交后土壤真菌特征条带也发生改变,在CFM图谱中出现条带F1,在CFA、CFK图谱中出现了条带F7,推测这两个条带所代表的真菌类群可能是导致土壤质量变化的主要类群,还需要进一步验证。
图7结果显示,杉木人工林取代自然林后土壤真菌多样性和丰富度有所提高,但FCF、SCF与NF之间土壤真菌多样性指数变化差异没有达到显著性(P>0.05),只有TCF与NF之间达到显著性差异(P<0.05)。随着杉木不断连栽土壤真菌多样性和丰富度呈现提高的趋势,杉木二代林与杉木一、三代林之间差异不显著(P>0.05),杉木一代林与杉木三代林之间差异显著(P<0.05),说明随着杉木不断的连栽土壤真菌群落多样性和丰度提高的幅度也不断增加。杉木与3种阔叶树混交后土壤真菌多样性和丰富度较杉木纯林显著降低(P<0.05),而3种混交林之间土壤真菌多样性和丰度变化不大(P>0.05)。可见,湖南会同地区杉木林土壤真菌多样性和丰度的变化趋势与土壤细菌是完全不同的。
图8a显示连栽杉木人工林土壤真菌群落结构的变化趋势,NF与 FCF、SCF主要在 PC2(贡献率为22.18%)显著分离,在PC1(贡献率为61.53%)分离度很小;NF与TCF在PC1和PC2上均明显分离;FCF和SCF在PC1和PC2上的分离度都很小,而且都与TCF在PC1上明显分离。由于PC1的贡献率远大于PC2,从不同杉木人工林土壤真菌DGGE图谱主成分分析可以看出,NF与FCF、SCF土壤真菌群落结构变化差异较小,而其与TCF之间的变化差异较大,说明随着杉木人工林的不断连栽土壤真菌群落结构变化也加大,这一点与土壤细菌群落结构的变化趋势相似。
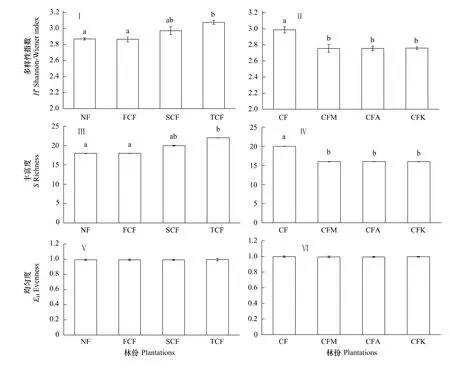
图7 不同杉木人工林土壤真菌群落基因多样性指数Fig.7 Genetic diversity indices of microbial communities in different plantations
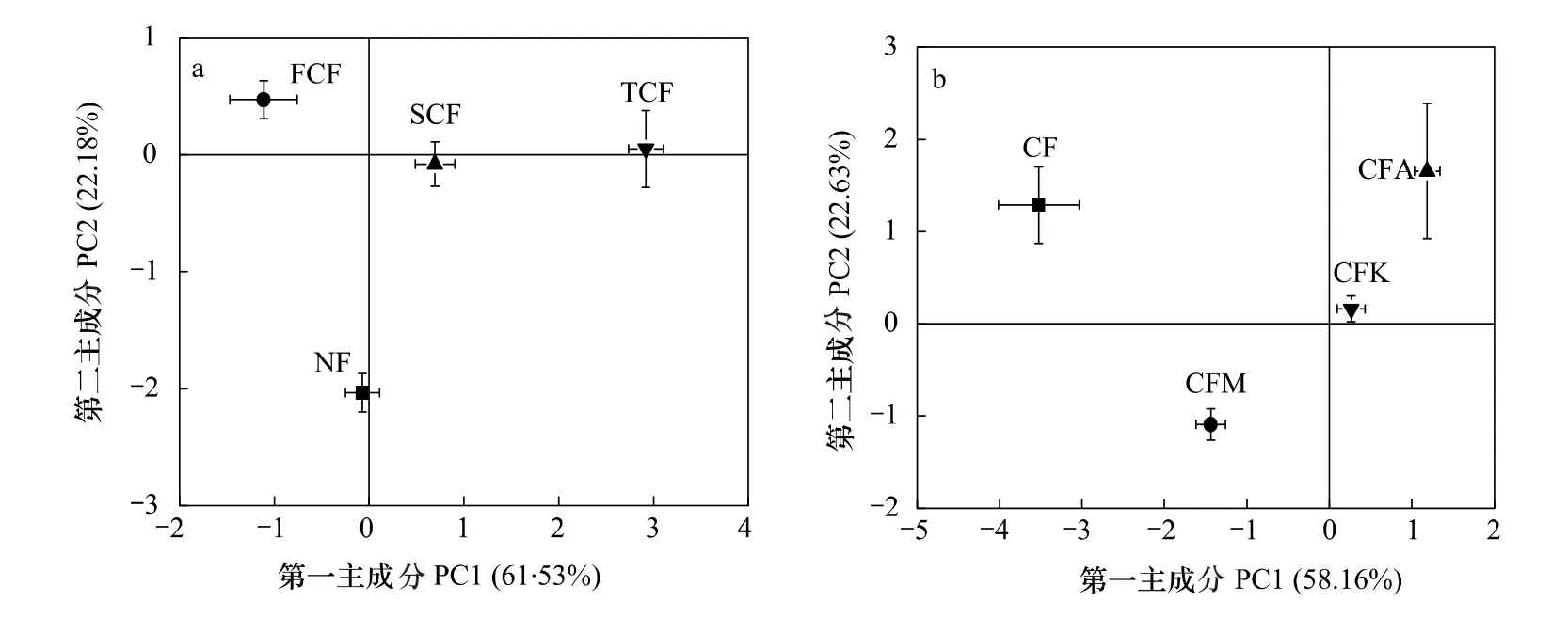
图8 不同杉木人工林土壤真菌DGGE指纹图谱主成分分析Fig.8 Principal component(PC1 × PC2)plots generated from covariance matrix of F-DGGE bands obtained from soil samples under different plantations
图8b显示杉木纯林和杉木混交林土壤真菌群落的变化,CF分别与CFM、CFA、杉木CFK主要在PC1(贡献率为58.16%)上分离,说明杉木纯林与3种杉阔混交林土壤真菌群落结构组成相差很大;3种杉阔混交林主要在PC2(贡献率为22.63%)上分离,在PC1上分离很小,表明3种杉阔混交林土壤真菌群落结构组成相似。
回家后的赛利亚审视自己未来的出路:一方面,她继承了祖母留下的卡拉米洛披肩,看到了自己与他人、家庭、民族之间的联系,这使得她理解了祖母和家人、接纳了自己的民族身份;另一方面,她以一种更加理智、全面的方式重建自己的文化身份,文化身份不再是一个非此即彼的选择,而是一个融合了多重文化的身份重建。
将土壤真菌DGGE图谱中主要特征条带中的10条切下(F1—F10),条带强度均大于100,经验证后测序,将所得序列登录GenBank,获得登录号为GQ423447—GQ423456。经系统发育分析,结果显示湖南会同地区杉木人工林土壤中真菌的优势种群主要是子囊菌和担子菌亚门的种属(图9)。

图9 土壤真菌DGGE指纹图谱28S r DNA系统发育树Fig.9 Phylogenetic tree of all sequences of 28Sr DNA from F-DGGE bands
从不同杉木人工林土壤真菌DGGE图谱中可以看出,当杉木人工林取代自然林后,土壤真菌群落结构受到影响:FCF、SCF与 NF之间土壤真菌群落结构变化不大,一部分种群有减少的趋势,如亲缘关系与Creosphaeria sassafras、Tubeufia paludosa、Serendipita vermifera密切的真菌种群,一部分种群有增加的趋势,如亲缘关系与Pyricularia longispora和Cladosporium cf.subtilissimum密切的微生物种群,但也有一些种群消失,如亲缘关系与Pseudomassaria carolinesis和Sphaerobolus iowensis密切的微生物种群;土壤真菌群落结构在TCF与NF 之间变化较大,亲缘关系与 Pseudomassaria carolinesis、Creosphaeria sassafras、Sphaerobolus iowensis、Pyricularia longispora和Cladosporium cf.subtilissimum密切的真菌种群消失,而亲缘关系与Sclerotinia sp.、Mycosphaerella sp.和Marasmius graminum密切的真菌种群出现(图6a,图9),可见连续单一种植杉木人工林会引起土壤真菌群落剧烈改变。
杉木与阔叶树混交后,土壤真菌群落结构也发生改变:主要表现为某些种群的恢复,如与Creosphaeria sassafras和Sphaerobolus iowensis亲缘关系密切的真菌种群出现,与Mycosphaerella sp.和Marasmius graminum亲缘关系密切的真菌种群消失;大部分共有条带亮度接近于自然林图谱,说明真菌群落结构组成在杉阔混交林土壤中有逐渐接近自然林的趋势(图6b,图9)。
2.4 杉木人工林土壤微生物群落结构变化与土壤质量的关系
表4结果显示,土壤细菌多样性指数变化与大部分土壤化学性质显著相关,其中与全氮、可溶性碳、铵态氮、速效钾和有效磷呈极显著正相关(P<0.01),与土壤pH值和总有机碳呈显著正相关(P<0.05),与土壤质量主成分值极显著正相关(P<0.01)。土壤细菌主成分分析PC1也与土壤质量和大部分土壤化学性质显著正相关。

表4 杉木人工林土壤细菌群落结构变化与土壤化学性质的相关性分析Table 4 Pearson's correlation analyses between the bacterial community and soil properties from all sites
表5结果显示,土壤真菌多样性指数变化与大部分土壤化学性质均无显著相关性(P>0.05),仅仅与土壤碳氮比呈显著正相关,与土壤pH呈显著负相关(P<0.05),这一点与细菌结果明显不同。表示自然林和杉阔混交林的DGGE特征条带以及几种土壤中共有条带的PC1也与大部分土壤性质无显著相关性(P>0.05);然而,表示杉木三代林的DGGE特征条带的PC2与多数土壤性质显著负相关(P<0.05),包括总有机碳、总有机氮、可溶性碳、铵态氮、速效磷以及土壤质量主成分值(PC1和PC),可见PC2表示的条带所代表的真菌种群可能是导致土壤质量变化的关键种群。
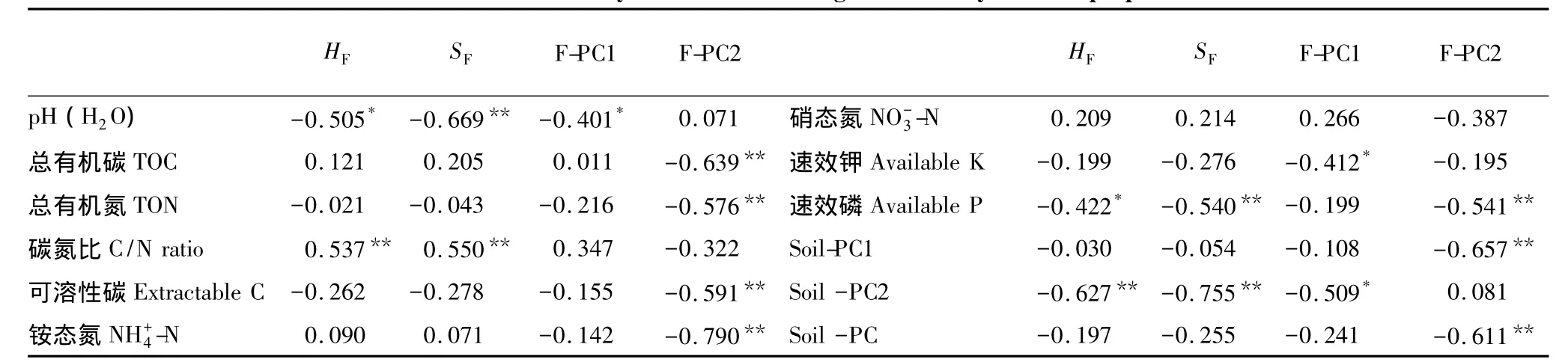
表5 杉木人工林土壤真菌群落结构变化与土壤化学性质的相关性分析Table 5 Pearson's correlation analyses between the fungal community and soil properties from all sites
3 讨论
3.1 杉木人工林土壤质量变化过程中土壤细菌群落变化特征
基于细菌16SrDNA保守特点,DGGE指纹图谱技术目前已经广泛的用于监测细菌生长和分析细菌群落,本文运用该技术结合PCA分析,区别不同杉木林土壤细菌群落结构的变化,并采用多样性指数(H,S和EH)评价不同土壤微生物群落多样性,高的多样性指数数值表明高的微生物群落多样性[19]。本研究表明,连栽杉木人工林土壤细菌群落多样性和丰度显著低于自然林和杉阔混交林(除杉木刺楸混交林外),并且随着连栽代数的增加不断降低。这与以前采用平板分离计数法的分析结果相一致。张其水等报道,杉木一代林土壤细菌数量高于二代、三代林,而且各类型细菌组成都随着杉木连栽代数的增加而发生明显变化[20]。陈楚莹等报道,杉木纯林土壤细菌数量仅为杉木火力楠混交林的60%左右,并认为土壤微生物数量与林分中阔叶树比例呈正相关[5]。
土壤微生物群落结构和多样性会受多种因素的影响,一些为外因,如植被类型、气候条件、土壤类型和人类活动等,另外一些为内因,主要为与土壤微生物生长密切相关的土壤有机质组成和土壤养分等。森林土壤有机质主要来源于植被凋落枝叶、地下凋落物、根系分泌物和土壤生物残体等的分解与周转。土地利用方式和管理措施能够影响土壤有机质的数量和质量,杉木人工林取代天然次生阔叶林后,导致土壤生态系统中凋落物数量减少,种类单一化,进而使土壤有机质的含量明显减少,质量明显下降[21]。本文研究结果表明杉木纯林土壤有机质含量显著低于自然林和杉阔混交林,通过相关性分析发现,土壤有机质的变化与土壤中细菌群落结构及多样性改变具有显著正相关。这一结果表明,森林土壤有机物质的质和量影响生态系统分解者的生长代谢,进而影响土壤中有机质的归还和养分周转。
本研究发现,土壤细菌多样性指数和土壤中总有机氮和速效氮含量显著正相关,这可能与土壤中参与氮素周转的微生物功能群有关。土壤中氮素含量是生物生长的限制因子,许多研究表明,土壤中氮素含量变化会引起土壤微生物生物量、活性和群落组成的变化[22]。Singh报道土壤微生物直接调节土壤氮素的供给,土壤中氨化细菌和硝化细菌的数量及其氨化作用和硝化作用的强弱直接与土壤活性氮素含量相关[23]。因此,在本文基础上还应该对土壤中参与氮循环的微生物功能群进行研究,探究其与土壤养分变化之间的相互作用。
土壤细菌群落组成变化是影响土壤质量和植物生长的重要因素。本研究结果显示,Burkholderia sp.、Sphingobacterium sp.、Xanthomonas sp.和Pedobacter sp.亲缘关系密切的细菌种群在不同杉木人工林土壤中有明显的变化。伯克霍尔德氏菌(Burkholderia sp.)的某些菌株能够产生抗真菌的物质,用于防治多种病原真菌引起的农作物以及森林苗木的根腐、茎腐、猝倒和纹枯等病害[24-25]。此外,有报道表明伯克霍尔德氏菌属的某些菌株具有解磷作用,可提高土壤有效磷含量[26]。土地杆菌属(Pedobacter sp.)的某些菌株能够产生植酸酶,可分解植物种子中的植酸磷,释放出肌醇和无机磷,使土壤中有效磷素增加[27]。本研究发现,DGGE主成分分析PC1与土壤有效磷呈显著正相关,可能是由于PC1代表的土地杆菌属和伯克霍尔德氏菌等解磷细菌数量和组成的改变引起土壤磷素的变化,进而影响其它种属土壤微生物(如参与凋落物分解和氮素循环的微生物)和杉木的生长。另一方面,在南方酸性红壤地区土壤全磷含量比较低,这也在一定程度上限制了土壤解磷细菌的生长,导致土壤有效磷含量降低,使土壤微生物(如参与凋落物分解和氮素循环的微生物)和植物生长受到限制。黄单胞菌属(Xanthomonas sp.)是一类植物致病菌,能够引起植物叶片枯萎,甚至造成系统性侵染,致使植株死亡,尤其在雨季传播力很强[28]。本文研究结果发现,在自然林及杉木一、二代林土壤中与黄单胞菌属亲缘关系密切的条带所代表的种群没有出现,在杉阔混交林土壤中该菌属细菌不占有优势地位,而在杉木三代林及杉木纯林土壤中黄单胞菌属成为优势种群之一,湖南会同地区属于亚热带湿润气候,雨季较长,这种特殊的气候条件能够加速黄单胞菌属的生长和传播,因此推测连栽杉木人工林出现的枝条枯萎、生长缓慢和生产力下降可能与土壤中植物病害菌占优势地位有关,对于是何种原因诱导了连栽杉木林土壤中黄单胞菌属大量繁殖,还有待进一步研究。
3.2 杉木人工林土壤质量变化过程中土壤真菌群落变化特征
本文根据真菌28SrDNA目的片段的DGGE指纹图谱,运用PCA分析不同杉木林土壤真菌群落结构的变化,结果发现其变化趋势与细菌相反,自然林和杉阔混交林土壤真菌多样性指数低于连栽杉木人工林。李延茂等采用可培养技术发现在杉木林随着连栽代数的增加土壤细菌数量下降而土壤真菌数量显著增加[11],然而并没有对这一现象进行解释。本文通过相关性分析发现,土壤pH值分别与土壤细菌、真菌群落结构及多样性指数变化呈显著正相关和负相关。土壤pH值一直被认为是影响土壤微生物群落结构的重要因素,土壤细菌和真菌分别在偏碱性和偏酸性土壤中占据优势地位[29]。土壤pH值能够通过影响土壤基质的组成、化学性质和利用效率而使土壤微生物群落组成和多样性受到干扰。本文研究显示,自然林和杉阔混交林土壤pH值高于连栽杉木人工林,不断连续栽种杉木纯林会导致土壤酸化。与阔叶树相比,针叶树凋落物富含较多的蜡质、树脂和木质素等分解产酸性物质,单一针叶树种的大面积种植可由于其凋落物质和量引起土壤酸化,这在我国南方普遍存在。然而当阔叶树种引入杉木人工林种植管理中,可以扭转该现象的发生。可见,造林管理措施能够通过影响凋落物的组成而引起土壤pH变化,进而改变土壤微生物群落结构组成。
土壤碳氮比是影响土壤微生物群落结构变化的又一重要因子。本研究结果表明土壤真菌群落结构及多样性指数变化与土壤C/N呈显著正相关。采用相同的方法,Yao等研究表明土壤真菌多样性随着土壤C/N增加而变化,并认为高C/N的土壤基质可能富含木质素和多酚类物质,这些物质能够诱导某些真菌生长[30]。此外,采用PFLA方法,Hackl等评价12种森林土壤中真菌多样性和丰度的变化,结果发现针叶树种森林土壤有机质具有高的碳氮比,同样也具有更为丰富的真菌类群,他们推测某些真菌类群适应针叶树森林土壤的高C/N,通过其菌丝转化更多的土壤有机碳[31]。
本研究发现杉木一、二代林与自然林土壤真菌群落结构组成变化不大,但是杉木三代林土壤真菌群落结构变化剧烈,出现了一些特征菌属,其中包括核盘菌属、球壳菌属和小皮伞菌属等,这些菌属的出现可能与该林分土壤质量和生产力下降有关。核盘菌(Sclerotinia sclerotiorum)是一种植物病原菌,由其引起的菌核病是世界性分布的重要病害。自从20世纪70年代,国外就开始报道了该菌属是花旗松(Douglas fir)、冷杉和银杉(Abies amabilis)等经济林木重要致病真菌[32]。球壳菌属(Mycosphaerella sp.)也包含了许多危害严重的植物病原菌,如美洲的松针红斑病菌(Mycosphaerella pini)能够引起针叶树病害[33],Mycosphaerella aleuritidis是我国云南油桐黑斑病的致病菌[34]。据报道小皮伞菌属(Marasmius sp.)主要生长在腐烂的枯枝落叶上,是一类凋落物分解菌属,曾经发现其为我国小兴安岭枫桦红松林凋落物分解菌之一[35]。本文研究发现,小皮伞菌属是杉木三代林土壤真菌的优势种群,这可能与杉木纯林凋落物极难分解,诱导一些木腐真菌的生长有关,但对这一推测还需进一步研究证实。通过统计学分析,本文发现亲缘关系与这些菌属相关的条带在真菌DGGE主成分分析PC2的载荷较大,PC2与土壤质量显著负相关,推测杉木人工林土壤质量衰退,生产力下降可能与植物致病真菌占优势地位有关。
土壤真菌DGGE主成分分析PC1代表自然林和杉阔混交林主要种群信息,其种群数量和组成在杉木人工林取代自然林以及杉木和阔叶树混交这些造林活动过程中均发生了改变,Sphaerobolus sp.是与土壤有机质的分解有关[36],Creosphaeria sp.某些菌株能够产生抗菌物质[37],而有些种属Tubeufia sp.和Serendipita sp.尚未有具体生态功能的报道。它们的变化与本文所研究的多数土壤养分变化并不直接相关,但是这些类群优势地位的丧失和恢复对于维持土壤真菌群落的稳定具有重要的意义,杉木三代林土壤中这些种属真菌受到扰动剧烈,一些种群消失,取而代之的植物致病菌占据优势地位,土壤原有真菌群落结构平衡被破环,同时土壤细菌群落结构也被破坏,严重影响土壤物质周转和养分循环,表4中真菌DGGE主成分分析PC2与土壤总有机碳氮、可溶性碳、铵态氮和有效磷变化显著负相关,证实了上述论述。
目前,对于上述微生物种属在杉木人工林土壤中尚未见报道,本文通过不依赖于培养的分子生物学技术,发现湖南会同地区供试杉木人工林土壤细菌和真菌优势种群,尤其是与土壤养分循环和植物病害有关的微生物种群发生变化,并详细分析了土壤细菌种群变化与土壤化学性质变化的关系。后续研究将对重要的土壤微生物功能群进一步探讨,如参与氮素循环的微生物功能群变化及其与土壤氮素周转之间的关系;参与凋落物分解的微生物功能群种群组成的变化及其与有机质归还之间的关系;拮抗致害真菌的微生物功能群的变化及其与土壤自净功能之间的关系等诸多问题。对这些科学问题的解答能够进一步解释杉木人工林经营引起土壤质量变化的微生物机理,并为制定合理造林管理措施提供理论依据。
致谢:感谢中国科学院会同森林生态实验站陈楚莹、冯宗炜、廖利平和汪思龙营造的杉木实验林,本实验是在他们研究样地的基础上进行的。
[1] Fang Q.Effects of continued plating of Chinese fir on the fertility of soil and the growth of stands.Scientia Silvae Sinicae,1987,23(4):389-397.
[2] Yu X T.A summary of the studies on the plantation productivity and nutrient cycling in Chinese fir plantation ecosystem.Journal of Fujian College of Forestry,1992,12(3):264-276.
[3] Yang C D,Zhang X Q,Jiao R Z,Wei Y R.Variations of chemical properties,biochemical,microoganism activities and function in soil of successive rotation of Chinese fir and their influences on growing.Scientia Silvae Sinicae,1996,32(2):175-181.
[4] Chen C Y,Liao L P,Wang SL.Chinese fir plantation Ecology.Beijing:Science press,2000.
[5] Lejon D P H,Chaussod R,Ranger J,Ranjard L.Microbial community structure and density under different tree species in an acid forest soil(Morvan,France).Microbial Ecology,2005,50(4):614-625.
[6] Zak D R,Holmes W E,White D C,Peacock A D,Tilman D.Plant diversity,soil microbial communities,and ecosystem function:are there any links?Ecology,2003,84(8):2042-2050.
[7] Priha O,Grayston S J,Hiukka R,Pennanen T,Smolander A.Microbial community structure and characteristics of the organic matter in soils under Pinus sylvestris,Picea abies and Betula pendula at two forest sites.Biology and Fertility of Soils,2001,33(1):17-24.
[8] Kirk JL,Beaudette L A,Hart M,Moutoglis P,Klironomos J N,Lee H,Trevors J T.Methods of studying soil microbial diversity.Journal of Microbiological Methods,2004,58(2):169-188.
[9] Leckie SE,Prescott C E,Grayston SJ,Neufeld J D,Mohn W W.Characterization of humus microbial communities in adjacent forest types that differ in nitrogen availability.Microbial Ecology,2004,48(1):29-40.
[10] Chen C Y,Zhang JW,Zhou C L,Zheng H Y.Researches on improving the quality of forest land and the productivity of artificial Cunninghamia lanceolata stands.Chinese Journal of Applied Ecology,1990,1(2):97-106.
[11] Li Y M,Hu JC,Zhang J,Wang SL,Wang SJ.Microbial diversity in continuously planted Chinese fir soil.Chinese Journal of Applied Ecology,2005,16(7):1275-1278.
[12] Liang B C,Mackenzie A F,Schnitzer M,Monreal C M,Voroney P R,Beyaert R P.Management-induced change in labile soil organic matter under continuous corn in eastern Canadian soils.Biology and Fertility of Soils,1997,26(2):88-94.
[13] Liu G S.Standard method of observation and analysis of the Chinese ecosystem research network-analysis of the soil physicochemical characteristics and delineation of the soil profiles.Bei Jing:Standard press.1996.
[14] Zhou JZ.Microarrays for bacterial detection and microbial community analysis.Current Opinion in Microbiology,2003,6(3):288-294.
[15] Wu M N,Zhang H W,Li X Y,Su Z C,Zhang C G.An extraction method of fungal DNA from soils in North China.Chinese Journal of Ecology,2007,26(4):611-616.
[16] Muyzer G,Brinkhoff T,Nübel U,Santegoeds C,Schäfer H,Wawer C.Denaturing gradient gel electrophoresis(DGGE)in microbial ecology//Akkermans A D L,van Elsas J D,de Bruijn F J,eds.Molecular Microbial Ecology Manual.Boston:Kluwer Academic Publishing,2004:743-769.
[17] Sandhu G S,Kline B C,Stockman L,Roberts GD.Molecular probes for diagnosis of fungal infections.Journal of Clinical Microbiology,1995,33(11):2913-2919.
[18] Liu L,Duan Z H,Wang SL,Hu JC,Hu Z G,Zhang Q R,Wang SJ.Effects of Cunninghamia lanceolata plantations at different developmental stages on soil microbial community structure.Chinese Journal of Ecology,2009,28(12):2417-2423.
[19] Xue D,Yao H Y,Huang CY.Genetic diversity of microbial communities in tea orchard soil.Chinese Journal of Applied Ecology,2007,18(4):843-847.
[20] Zhang Q S,Yu X T.Seasonal dynamics of the soil microorganism in the repeated Chinese fir plantation woodlands.Journal of Fujian College of Forestry,1991,11(4):422-427.
[21] Wu W D,Zhang T L,Sun B,Zhao Q G.Degradation and control of soil organic matter and nutrient pool under artificial Chinese fir forest.Acta Pedologica Sinica,2000,37(1):41-49.
[22] Sarathchandra SU,Ghani A,Yeates GW,Burch G,Cox N R.Effect of nitrogen and phosphate fertilizers on microbial and nematode diversity in pasture soils.Soil Biology and Biochemistry,2001,33(7/8):953-964.
[23] Singh J S,Kashyap A K.Contrasting pattern of methanotrophs in dry tropical forest soils:effect of soil nitrogen,carbon and moisture.Microbiological Research,2007,162(3):276-283.
[24] Cartwright D K,Benson D M.Pseudomonas cepacia strain 5.5 B and method of controlling Rhizoctonia solani:United State Patent,5288633.1994-02-22.
[25] Xie G L,Jin Y X,Xu C Y,Ren X P,Yu X F,Mew W T.Bacterial antagonists of rice sheath blight disease in China.Chinese Journal of Biological Control,2003,19(4):166-170.
[26] Wang Y,Yu X M,He CP,Zheng F C.Screening and identification of one strain of phosphate-solubilizing bacteria from the tropical soil and the study on its antagonism.Journal of Anhui Agricultural Sciences,2009,37(18):8347-8349.
[27] Gomez A A,Kelly D E S,Syers J K,Coughlan K J.Measuring sustainability of agricultural systems at the farm level//Doran JW,Jones A J,eds.Methods for Assessing.Madison:Soil Science Society of America Special Publication,1996,49:401-409.
[28] Soustrade I,Gagnevin L,Roumagnac P,Gambin O,Guillaumin D,Jeuffrault E.First report of anthurium blight caused by Xanthomonas axonopodis pv.dieffenbachiae in Reunion Island.Plant Disease,2000,84(12):1343-1343.
[29] Ogilvie L A,Hirsch P R,Johnston A W B.Bacterial diversity of the Broadbalk‘Classical’winter wheat experiment in relation to long-term fertilizer inputs.Microbial Ecology,2008,56(3):525-537.
[30] Yao SR,Merwin I A,Bird G W,Abawi G S,Thies J E.Orchard floor management practices that maintain vegetative or biomass groundcover stimulate soil microbial activity and alter soil microbial community composition.Plant and Soil,2005,271(1/2):377-389.
[31] Hackl E,Pfeffer M,Donat C,Bachmann G,Zechmeister-Boltenstern S.Composition of the microbial communities in the mineral soil under different types of natural forest.Soil Biology and Biochemistry,2005,37(4):661-671.
[32] Berry JA,Dolezal W E,Sayers A C.Remote imaging system for plant diagnosis.USPatent 6014451,2000-01-11.
[33] Xu H G,Qiang S,Han ZM,Guo JY,Huang Z G,Sun H Y,He SP,Ding H,Wu H R,Wan F H.The distribution and introduction pathway of alien invasive species in China.Chinese Biodiversity,2004,12(6):626-638.
[34] Chen P,Liu H P,Wang D M,Bai R L.Dangerousness analysis of Mycosphaerella aleuritidis.forest inventory and planning.Forest Inventory and Planning,2006,31(2):116-118.
[35] Pan X R,Huang Y Q,Liu C Z.Study on decomposition mycoflora in costata birch-Korean pine forest litters.Journal of Northeast Forestry University,1991,19(1):75-82.
[36] Yu SL.A study of function that rot funguses have in the decomposition of organic matter.Journal of Hebei Normal University:Natural Science,2003,27(5):519-522.
[37] Quang D N,Hashimoto T,Fournier J,Stadler M,Radulovi N,Asakawa Y.Sassafrins A D,new antimicrobial azaphilones from the fungus Creosphaeria sassafras.Tetrahedron,2005,61(7):1743-1748.
参考文献:
[1] 方奇.杉木连栽对土壤肥力及其林木生长的影响.林业科学,1987,23(4):389-397.
[2] 俞新妥.杉木人工林地力和养分循环研究进展.福建林学院学报,1992,12(3):264-276.
[3] 杨承栋,张小泉,焦如珍,魏以荣,冯福娟.杉木连栽土壤组成、结构、性质变化及其对林木生长的影响.林业科学,1996,32(2):175-181.
[4] 陈楚莹,廖利平,汪思龙.杉木人工林生态学.北京:科学出版社,2000.
[10] 陈楚莹,张家武,周崇莲,郑洪元.改善杉木人工林的林地质量和提高生产力的研究.应用生态学报,1990,1(2):97-106.
[11] 李延茂,胡江春,张晶,汪思龙,王书锦.杉木连栽土壤微生物多样性的比较研究.应用生态学报,2005,16(7):1275-1278.
[13] 刘光崧.中国生态系统研究网络观测与分析标准方法-土壤理化分析与剖面描述.北京:标准出版社,1996.
[15] 吴敏娜,张惠文,李新宇,苏振成,张成刚.提取北方土壤真菌DNA的一种方法.生态学杂志,2007,26(4):611-616.
[18] 刘丽,段争虎,汪思龙,胡江春,胡治刚,张倩茹,王书锦.不同发育阶段杉木人工林对土壤微生物群落结构的影响.生态学杂志,2009,28(12):2417-2423.
[19] 薛冬,姚槐应,黄昌勇.茶园土壤微生物群落基因多样性.应用生态学报,2007,18(4):843-847.
[20] 张其水,俞新妥.杉木连栽林地土壤微生物的季节动态研究.福建林学院学报,1991,11(4):422-427.
[21] 吴蔚东,张桃林,孙波,赵其国.人工杉木林地有机物和养分库的退化与调控.土壤学报,2000,37(1):41-49.
[25] 谢关林,金扬秀,徐传雨,任小平,余雪芳,Mew W T.我国水稻纹枯病拮抗细菌种类研究.中国生物防治,2003,19(4):166-170.
[26] 王义,余贤美,贺春萍,郑服丛.一株热带土壤解磷细菌的筛选鉴定及拮抗初探.安徽农业科学,2009,37(18):8347-8349.
[33] 徐海根,强胜,韩正敏,郭建英,黄宗国,孙红英,何舜平,丁晖,吴海荣,万方浩.中国外来入侵物种的分布与传入路径分析.生物多样性,2004,12(6):626-638.
[34] 陈鹏,刘宏屏,王达明,白如礼.云南油桐黑斑病危险性分析.林业调查规划,2006,31(2):116-118.
[35] 潘学仁,黄永青,刘传照.枫桦红松林凋落物分解真菌生态群的研究.东北林业大学学报,1991,19(1):75-82.
[36] 于淑玲.腐生真菌在有机质分解过程中的作用研究进展.河北师范大学学报:自然科学版,2003,27(5):519-522.
