长江口及邻近海域秋冬季小型底栖动物类群组成与分布
2013-09-15于婷婷徐奎栋
于婷婷,徐奎栋
(1.中国科学院海洋研究所,青岛 266071;2.中国科学院大学,北京 100049)
长江口是太平洋西岸的第一大河口,是长江径流、沿岸流以及台湾暖流等外海水团交汇的区域,是东海生物营养物质的重要来源地,也是环境最为复杂、生态压力较大的区域之一。小型底栖动物通常是指生活于沉积物中的能通过0.5 mm网筛,但被0.042 mm或0.031 mm网筛所阻留的小型后生动物,主要包括自由生线虫、桡足类、涡虫类、动吻类和多毛类等[1]。它们是底栖微食物网的重要组成部分,在全球生物地化循环中占有重要位置。同时,小型底栖动物作为对环境变化较为敏感的类群,还具有环境指示价值[2]。国际上有关海洋小型底栖动物的研究较为深入。我国的研究主要集中在黄渤海区,对于长江口及东海海域所涉研究较少,且尚无工作涉及该海域冬季的小型底栖动物现存量及分布情况[3-5]。
本研究旨在了解长江口及邻近海域秋冬季小型底栖动物的类群组成、丰度和生物量及分布特征,及其与沉积环境因子的关系。同时,针对目前国内进行线虫生物量估算时普遍采用的0.4μg/个这一系数,在近岸和离岸海域各选取了一个站位,将通过实测线虫的体长和体宽获得的生物量与通过单一系数得到的生物量做了比较,以明确采用0.4μg/个估算生物量可能造成的偏差。
1 材料与方法
1.1 调查海域与站位
2009年11—12月,搭载“科学三号”考察船对长江口及邻近海域(28—33°N,121—126°E)的19个站位进行了小型底栖动物及其沉积环境因子的研究。采样站位见图1。
1.2 样品采集和分析
利用0.1 m2改进型Gray-Ohara箱式采泥器,每个站位采集3箱未受扰动的沉积物样品,用内径23 mm的注射器改造的采样管在每箱沉积物中随机采集一个长度为8 cm的芯样,并按0—2 cm、2—5 cm、5—8 cm分层。各分层样品分别加入等体积的10%福尔马林溶液固定,用于小型底栖动物的分析。同时在其中一箱中另采集一组分层样品备用。此外,以同样方式取另外4个芯样,并按照相应分层合并后,分别装入封口袋,-20℃ 冷冻保存,用于沉积物中叶绿素a(Chl-a)、脱镁叶绿素a(Ph-a)、粒度、有机质(OM)及含水量的分析。
室内小型底栖动物样品经虎红(Rose Bengal)染色,用500μm和31μm孔径套筛过滤后,转入Ludox-TM硅胶液中悬浮离心,然后在解剖镜下按类群分选计数[6]。
在计算小型底栖动物生物量时,为保证数据资料的可比性,线虫个体平均干重采用国内通用的0.4μg/个[3-5]。桡足类参照McIntyre[7]以1.86μg计算。其他类群的平均个体干重依据Widbom[8]给出的参数,即多毛类14μg;双壳类4.2μg;动吻类2.0μg;介形类26μg;端足类15μg;原足类15μg;其它3.5μg。生产量依P=9B估算(P为生产量,B为生物量)。
为准确估算线虫的生物量,在显微镜下实测了31007站位的372条线虫和30001站位的267条线虫的体长(L)和体宽(W),每条线虫的体积(V)通过公式V=530×L×W2[9]计算得出;按照比重为 1.13,干湿比为 1/4[10],获得每个个体的干重=530×L×W2×1.13×0.25,计算得出每个站位的线虫个体平均干重值。然后,将通过所得线虫个体平均干重值估算得出的线虫和小型底栖动物的生物量,与利用0.4μg/个这一系数得出的结果进行比较。
沉积物粒度分析采用Cilas(940L)型激光粒度仪进行测定。有机质测定参照《海洋调查规范》及刘昌岭等[11]改进的方法。有机质含量为有机碳含量乘以系数1.724。叶绿素a和脱镁叶绿素a测定采用湿样法[12]。其它环境资料来自随船温盐深测定仪 (CTD)现场测定。
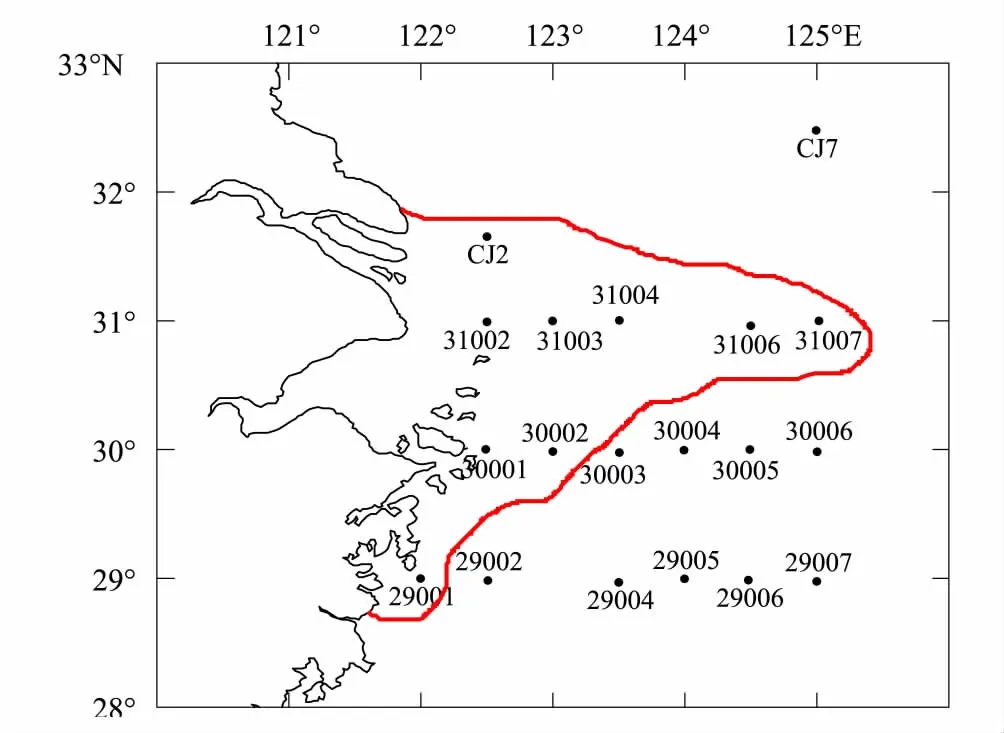
图1 研究海域取样站位图Fig.1 Sampling stations in the Yangtze Estuary and its adjacent waters in the East China Sea
1.3 数据统计分析
小型底栖动物的丰度、生物量与环境因子的相关性,及其环境因子之间的相关性,采用SPSS 16.0软件包中的Spearman相关分析。站位间小型底栖动物丰度和环境因子的相似性分析,采用等级聚类(CLUSTER)和非度量多维标序(MDS)。用BIOENV分析连接环境和生物矩阵,分析环境变量与动物群落的相关性,并用RELATE分析检验相关性是否显著,上述分析采用PRIMER 6软件处理[13]。
2 结果
2.1 沉积环境
2.1.1 水深、底层水温和底层盐度
调查海域由近岸向外海、由北向南逐渐加深(图2)。最深处位于东海的29007(87.3 m)、29006(83.8 m)和29005(82.6 m)站位。水深最浅的29002(12.3 m)和31002(12.9 m)站水温偏低,分别为14.2℃和13.6℃;而深水区底层水温相对较高,如29006和29007站温度为20.9℃,29005站为21.5℃,这可能是由于受黑潮水的影响。底层盐度相对稳定,除近岸的 4 个站位(29001∶25.8,31002∶29.5,30001∶30.1 和 CJ2∶31.2)略低外,其余15个站位盐度波动较小,平均为(33.8±0.3)。
2.1.2 沉积物类型
所涉的19个站位包含5种沉积物类型:(1)砂质(离岸较远的30006站),粉砂-粘土含量为16.5%,中值粒径为2.0;(2)粉砂-砂(覆盖了除近岸外的大部分站位,包括 29007、31003、30002、31006、30005、30004、29006、31004、30003和CJ7等10个站位),粉砂-粘土含量为30.4%—55.9%,中值粒径为2.4—4.7;(3)砂-粘土-粉砂(包括位于南端的29004和29005两站),粉砂-粘土含量为62.2%—65.0%,中值粒径为5.3—5.4;(4)粘土-砂-粉砂(离岸较远的31007站),粉砂-粘土含量为79.2%,中值粒径为6.3;(5)粘土-粉砂(位于近岸的29001、29002、30001、31002和 CJ2等4站),粉砂-粘土含量为97.7%—99.8%,中值粒径为6.6—7.3。调查海域的粉砂-粘土含量由近岸向外海逐渐递减。
2.1.3 含水量和有机质含量
所涉19个站位的平均含水量为(35.3±6.9)%,最高值出现在31002站(50.9%),最低值出现在30005站(26.8%),其分布呈现由近岸向外海迅速降低,继而又逐渐升高的趋势,与粉砂-粘土含量和中值粒径显著正相关(均为P<0.01)。
19个站位的有机质平均含量为(0.8±0.5)%,最高值出现在29006站(2.7%),最低值出现在30005站(0.4%)。有机质含量与含水量呈显著正相关(P<0.01)。
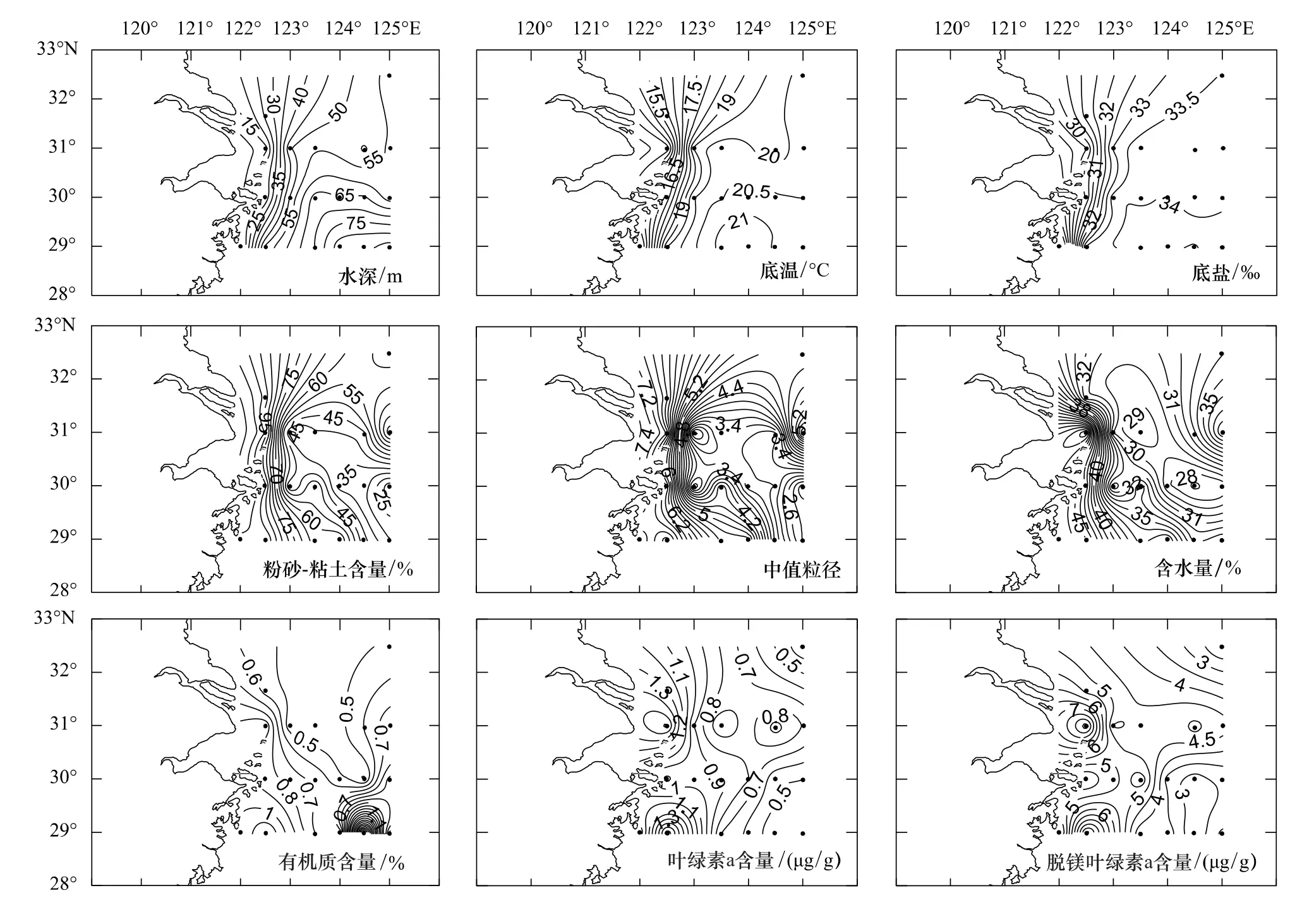
图2 长江口及邻近海域19个采样站位的沉积物环境Fig.2 The benthic environmental variables at 19 stations in the Yangtze Estuary and its adjacent waters
2.1.4 Chl-a和Ph-a含量
沉积物中的Chl-a含量代表初级生产力状况,小型底栖动物食物的来源及环境状况的好坏,Ph-a含量则代表了沉积物中已死亡及沉降藻类的多寡。19个站位沉积物中Chl-a的分布从近岸向外海递减,平均值为(0.9±0.4)μg/g,最大值位于29002站(1.9μg/g),最小值位于 CJ7站(0.3μg/g),与粉砂-粘土含量(P<0.01)、中值粒径(P<0.05)和脱镁叶绿素(P<0.01)呈显著正相关,与水深、底层水温、底层盐度呈显著负相关(均为P<0.01)。Chl-a的含量由表层向底层随着深度的增加而降低,表层(0—2 cm)、次表层(2—5 cm)和底层(5—8 cm)的含量分别为0.99、0.80μg/g和0.77μg/g。
Ph-a的分布也是由近岸向外海递减,平均值为(4.5±1.8)μg/g,最大值位于31002站(8.8μg/g),最小值位于CJ7站(2.0μg/g),与粉砂-粘土含量(P<0.05)和Chl-a(P<0.01)呈显著正相关,与水深和底层水温呈显著负相关(均为P<0.01)。Chl-a和Ph-a在分布上能够较好重合,也是随着深度的增加而降低,表层(0—2 cm)、次表层(2—5 cm)和底层(5—8 cm)中的含量平均为5.61、4.32μg/g和3.66μg/g。
2.1.5 沉积环境因子的CLUSTER聚类分析及MDS标序
综合环境因子各变量,由聚类分析结果和MDS标序图可以看出(图3,图4),在90%相似处,全部19个采样站位可分为两组,经SIMPROF检验,分成两个组的沉积环境具有显著差异(P=0.001)。组Ⅰ包含近岸的CJ2、31002、30001、29001和29002等5个站,其共同特征为水深(平均为24.7 m)较浅,底层水温(16.0℃)和盐度(30.0)较低,而叶绿素a(1.3μg/g)、脱镁叶绿素a含量(0.7μg/g)、粉砂-粘土含量(98.8%)及含水量(43.7%)较高。组Ⅱ包含剩余的14站,其共同特征为水深(平均为64.0 m)较深,底层水温(20.5℃)和盐度(33.8)较高,而叶绿素a(0.7μg/g)、脱镁叶绿素a(3.9μg/g)、粉砂-粘土含量(44.6%)及含水量(32.3%)较低。
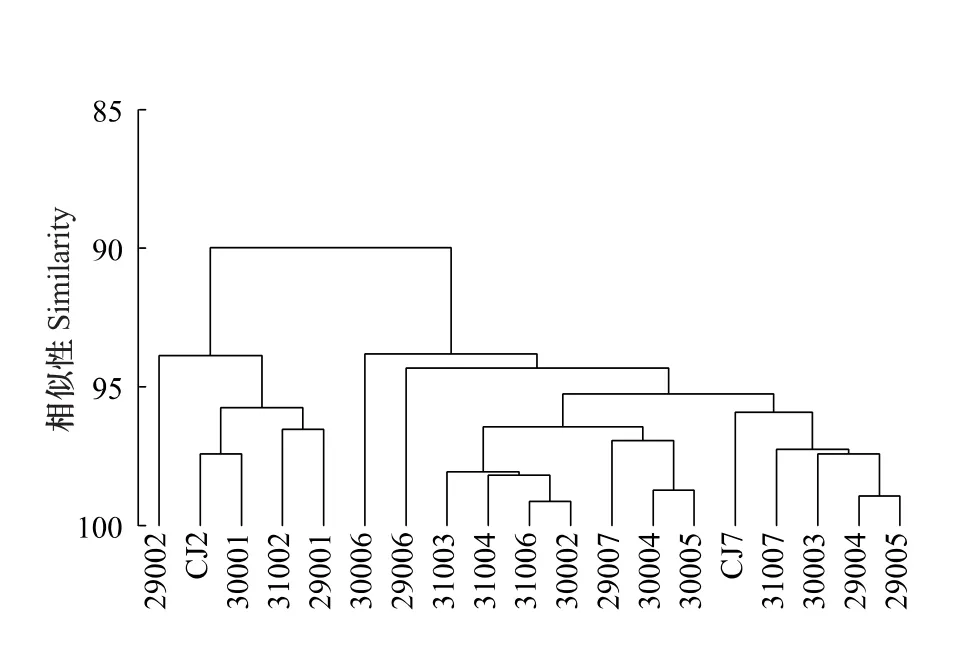
图3 沉积环境因子的CLUSTER聚类分析Fig.3 CLUSTER analysis of benthic environmental variables
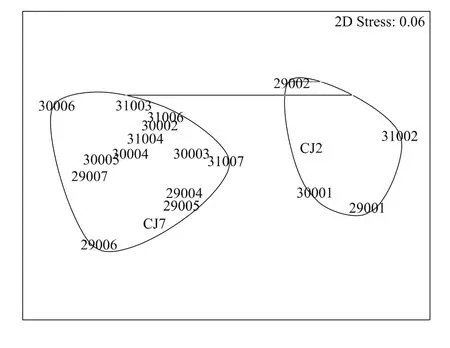
图4 沉积环境因子的MDS标序分析Fig.4 MDSordination of benthic environmental parameters
2.2 小型底栖动物类群组成、现存量和空间分布
2.2.1 小型底栖动物类群组成和现存量
本研究共鉴定出12个小型底栖动物类群(表1),其中海洋线虫在丰度上占绝对优势,平均为(1021±665)个/10 cm2,占总数的94.4%,其次是涡虫类(2.3%)和桡足类(2.0%)。其他在数量上较重要的类群依次是动吻类、多毛类和甲壳类幼体。小型底栖动物的丰度由近岸向外海递减,且北部海区较南部高(图5),平均为(1081±700)个/10 cm2(表1)。最高值位于北部近岸的31002站,丰度为(2739±698)个/10 cm2,其次为近岸的29001和30002站,丰度分别为(2154±555)个/10 cm2和(1906±468)个/10 cm2。最低值位于南端离岸较远的29004站,丰度仅为(145±37)个/10 cm2。
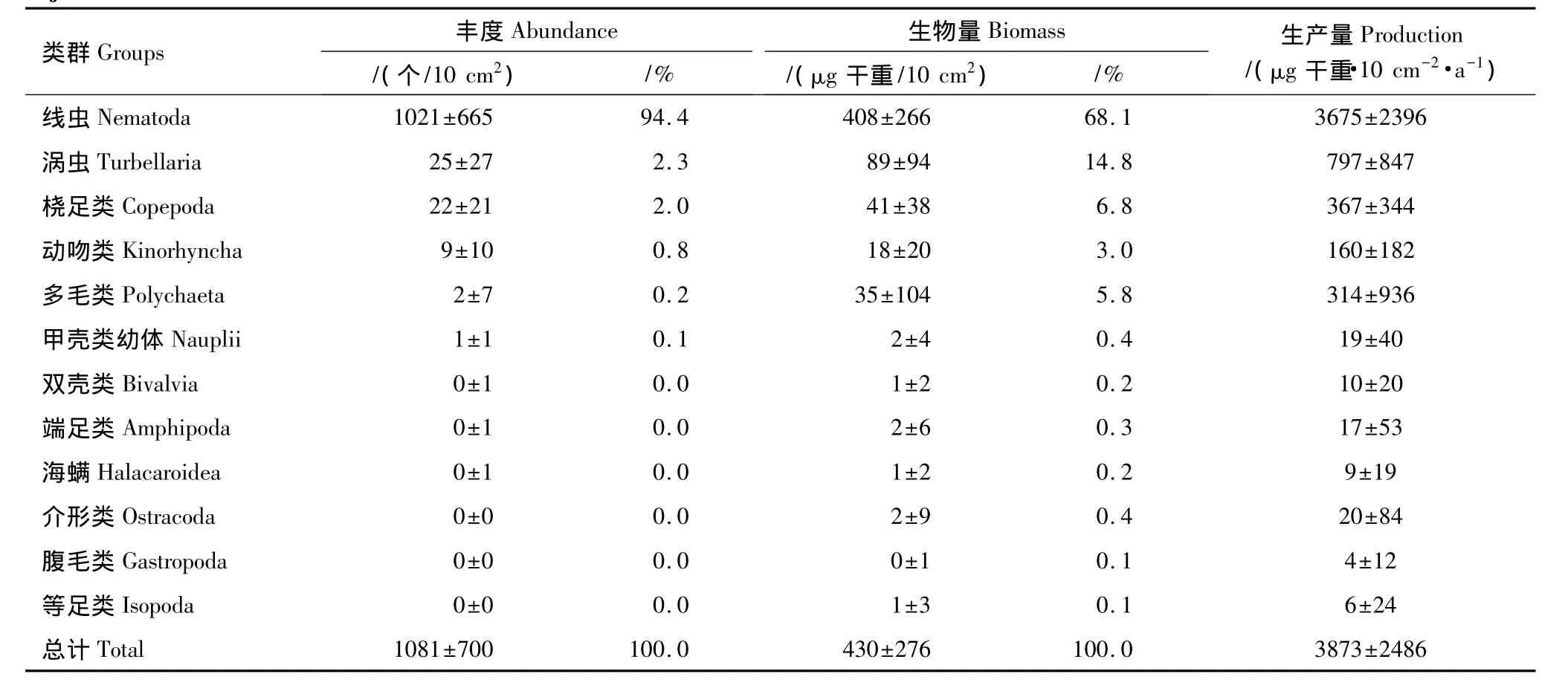
表1 长江口及邻近海域19个研究站位小型底栖动物的平均丰度、生物量和生产量Table 1 Average abundance,biomass and production of meiofaunal groups at 19 sampling stations in the Yangtze Estuary and its adjacent waters
按经验系数估算的19个站位的小型底栖动物的平均生物量和生产量分别为(600±374)μg干重/10 cm2和(5398±3369)μg干重·10 cm-2·a-1。生物量水平分布同丰度类似,北部近岸丰度最高的31002站,其生物量也最高,为(1422±290)μg干重/10 cm2;其次为31004站和30002站,生物量分别为(1072±182)μg干重/10 cm2和(1036±194)μg干重/10 cm2(图5)。在主要类群的贡献上,线虫为最优势类群(68.1%),其次是涡虫类(14.8%)、桡足类(6.8%)和多毛类(5.8%)。
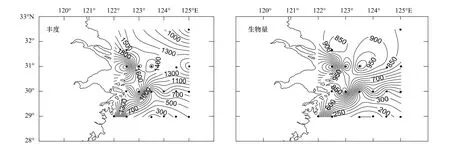
图5 小型底栖动物丰度(个/10 cm2)和生物量(μg干重/10 cm2)水平分布图Fig.5 Horizontal distribution of meiofaunal abundance and biomass
2.2.2 小型底栖动物空间分布
从小型底栖动物及其主要类群线虫、桡足类和涡虫类丰度的水平分布可以看出,小型底栖动物数量的水平分布不均匀,呈镶嵌(或斑块)分布(图6)。
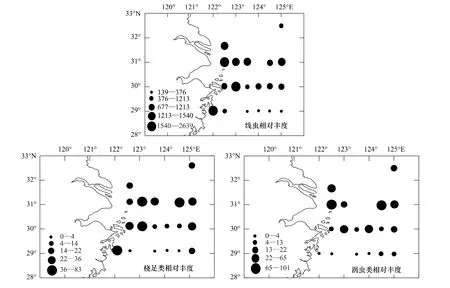
图6 线虫、桡足类、涡虫类的相对丰度Fig.6 Relative abundance of nematodes,copepods and turbellarians
垂直分布上,小型底栖动物主要分布在沉积物表层(0—2 cm),平均丰度为(756±462)个/10 cm2,占总数的70.8%,次表层(2—5 cm)和底层(5—8 cm)中的丰度所占比例分别为19.9%和9.3%。这说明在该海域取芯样0—5 cm的取样效率可达90.7%。不同类群的垂直分布略有不同,69.9%的线虫分布在0—2 cm表层,而涡虫类和桡足类在此表层的比例分别高达86.8%和83.2%。
2.2.3 小型底栖动物丰度的聚类分析
基于Bray-Curtis相似性矩阵进行聚类分析(CLUSTER)和非度量多维标序(MDS)分析的结果具有一致性(图7,图8)。在67%的相似性水平上,19个站位的小型底栖动物群落可以分为3组,经SIMPROF检验,组间小型底栖动物的类群组成和丰度具有显著性差异(P=0.001)。组Ⅰ包含29004和29005站,这两站位于研究海域的最南端,水深较深(76.4 m),沉积物中叶绿素a(0.63μg/g)和脱镁叶绿素a(3.65μg/g)含量较低,小型底栖动物丰度(平均为 187 个/10 cm2)较低;组Ⅱ包含 CJ2、31004、31006、30001、31003、31007、29001、30002和31002站,这些站位位于近岸及受长江口冲淡水的影响,水深较浅(37.0 m),叶绿素a(1.00μg/g)和脱镁叶绿素a(5.05μg/g)含量较高,小型底栖动物丰度(平均为1716个/10 cm2)较高;组Ⅲ包含剩余的29002、29006、30003、29007、CJ7、30005、30004 和30006 站,这些站位的沉积环境介于组1 和组 2 之间,水深为66.9 m,叶绿素a和脱镁叶绿素a含量分别为0.73μg/g和4.01μg/g,小型底栖动物的丰度平均为590个/10 cm2。
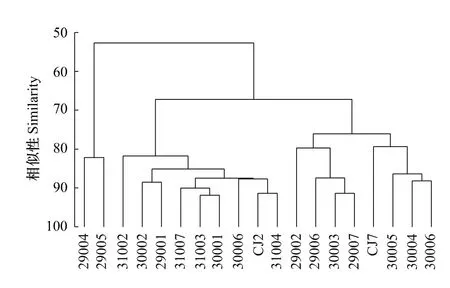
图7 小型底栖动物丰度的CLUSTER聚类分析Fig.7 CLUSTER analysis of meiofaunal abundance
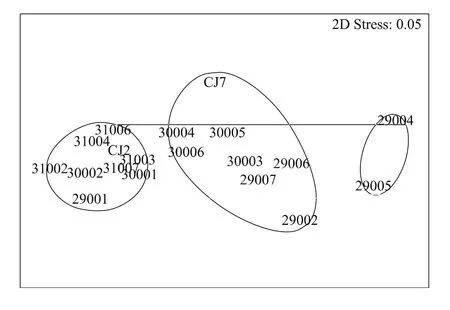
图8 小型底栖动物丰度的MDS标序分析Fig.8 MDS ordination of meiofaunal abundance
鉴于以类群-丰度的分组与以环境因子的分组并不完全匹配,综合考虑这两种分组结果,笔者认为19个站位的小型底栖动物可划分为一个河口群落(图1站位图中实线圈出的站位)和一个离岸近海群落。河口群落处于近岸及受长江口冲淡水影响的站位中,包括 CJ2、31004、31006、30001、31003、31007、29001、30002 和31002站,其沉积物中营养物质丰富,小型底栖动物丰度较高(平均为1716个/10 cm2)。离岸近海群落处于上述站位以外的站位中,包括29004、29005、29002、29006、30003、29007、CJ7、30005、30004 和30006 站,其沉积物相对贫瘠,小型底栖动物丰度相对较低(平均为509个/10 cm2)。在类群组成上,河口群落线虫优势度较高(95%),其次为涡虫(2%)、动吻类(2%)和桡足类(1%);离岸近海群落线虫优势度略低(88%),其次为多毛类(6%)、涡虫(3%)、桡足类(2%)和动吻类(1%)。这是因为线虫相较其他小型底栖动物类群对环境污染具有更高的耐受力,因此,在污染较严重的河口区域,线虫的优势度相较离岸近海的群落略高。
2.3 实测和估算的线虫以及小型底栖动物生物量的比较
通过实测31007和30001两个站位共计639条线虫的体长和体宽,利用体积转化法,计算得出了两站位线虫个体平均干重值。其中,近岸偏南的30001站267条线虫的个体平均干重为0.365μg/个 (0.010—2.843μg/个),离岸偏北的31007站372条线虫的统计结果为0.104μg/个 (0.004—1.870μg/个)。由此可见,不同站位间线虫的个体平均干重值存在较大差异。因此,如果忽略站位间的特异性,在计算生物量时一概采用0.4μg/个这一系数,会对该海域线虫以及小型底栖动物的生物量产生不同程度的高估。当采样站位的实际线虫个体平均干重值与0.4μg/个接近时,直接采用这一系数造成的误差较小(如30001站,估算所得的线虫生物量与是实测的1.09倍);但当两者差别较大时,则误差较大(如31007站,估算所得的线虫生物量是实测的3.85倍)。

表2 两个站位实测和估算所获线虫以及小型底栖动物生物量的比较Table 2 Comparison of nematodes and meiofaunal biomass obtained from biovolume measurements and estimation using 0.4 μg per individual of nematodes at two stations
2.4 小型底栖动物丰度、生物量与沉积环境因子的关系
对小型底栖动物丰度及生物量、线虫丰度、桡足类丰度和涡虫类丰度与水深、底层水温、底层盐度、粉砂-粘土含量、中值粒径、有机质含量、叶绿素a和脱镁叶绿素a含量进行的Spearman相关分析表明,小型底栖动物及线虫的丰度均与叶绿素a含量呈显著正相关,与水深、底层水温和底层盐度呈显著负相关;桡足类丰度与水深和底层水温呈显著负相关;涡虫类丰度与各环境因子均无显著相关;小型底栖动物的生物量与水深、底层水温和底层盐度呈显著负相关(表2)。
用BIOENV分析将环境矩阵与小型底栖动物类群-丰度矩阵相连接,并用RELATE分析检验相关系数的显著性,结果显示与小型底栖动物类群组成及丰度相关性最高的环境因子组合为水深和脱镁叶绿素a含量(r=0.361,P=0.003)。
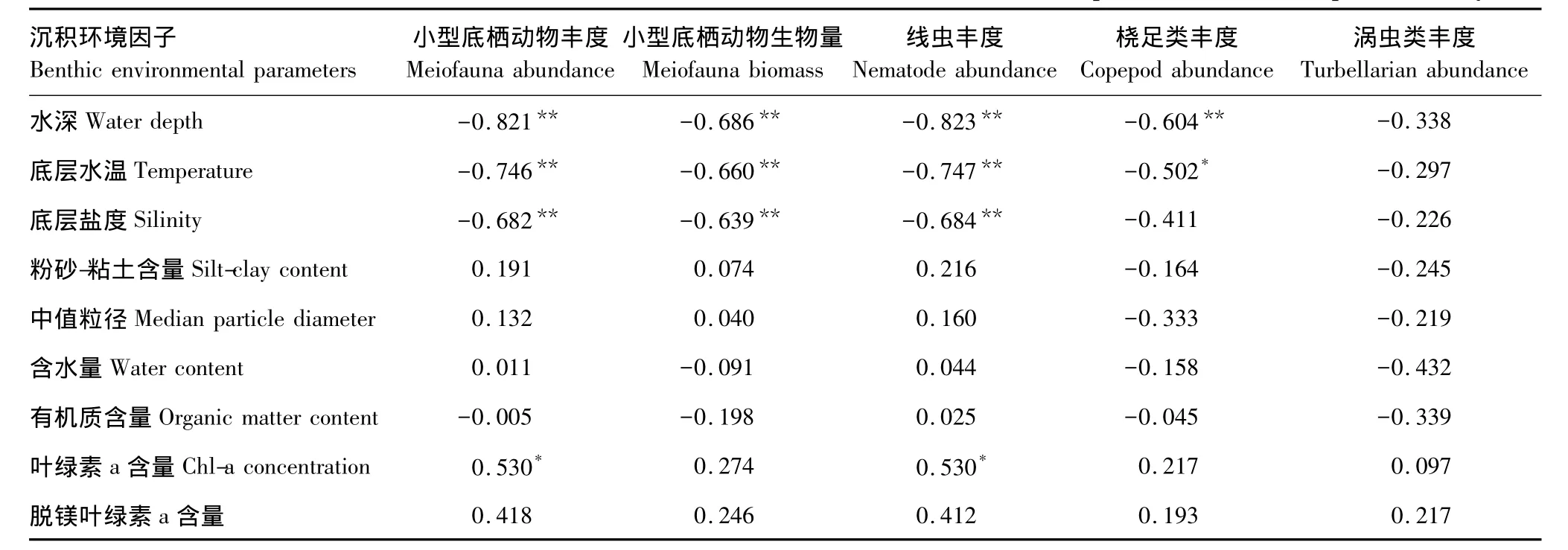
表3 研究站位小型底栖动物丰度、生物量与沉积环境因子的Spearman相关分析Table 3 Relative coefficient between meiofaunal abundance,biomass and benthic environmental parameters based on Spearman analysis
3 讨论
3.1 线虫个体平均干重的测算
目前国内在计算线虫生物量时大都采用0.4μg/个这一系数,本研究为与国内已有的文献数据做比较,同样采用了这一系数进行估算。由于线虫的个体平均干重受到种类、幼体数量、季节和研究海域等多种因素的影响,因此要得到较为精确的线虫个体平均干重值,必须进行体积的实测,以尽量减少估计的误差。本文通过对线虫的体长(L)和体宽(W)的实际测量,利用生物体积计算得出两个站位(31007和30001)的线虫个体平均干重分别为0.104μg/个和0.365μg/个。同样地,黄勇①黄勇,2005.南黄海小型底栖生物生态学和海洋线虫分类学研究.青岛:中国海洋大学博士学位论文,69.对采自南黄海1382条线虫的实测获得的个体平均干重为0.261μg/个,也低于国内广泛采用的0.4μg/个。可见,不同海域或者同一海域的不同站位间,线虫个体干重的平均值存在较大差异,而不同季节还因线虫繁殖阶段的不同造成个体大小的差异,因此,简单地采用0.4μg/个这一系数会对该海域的实际生物量造成不同程度的高估。
由于线虫的丰度在小型底栖动物群落中所占比例极高(约90%),对其生物量估算的准确性直接影响了对小型底栖动物生物量估计的可靠性。无疑,对各采样站位的线虫个体平均干重进行实测是得到较为准确的线虫生物量的必要手段,而由此带来的工作量十分巨大。因此,为了能够快捷且真实地反映研究海域的线虫生物量,应加强对不同海域、不同季节的线虫个体平均干重值的测算,并探索其时空分布模式、影响因子和变化规律。
3.2 长江口冲淡水及黑潮暖流对小型底栖动物分布的影响
长江口及邻近的东海海域由于受长江冲淡水、黑潮暖流及沿岸流等的综合影响,沉积环境因子在时空上波动较大,造成小型底栖动物的类群组成和分布上的一些特性。本研究海域小型底栖动物丰度的水平分布大致呈现出以往所观察到的“北高南低,近岸高外围低”的趋势,但又有其独特性。具体表现为在3100断面中离岸较远的站位(31004、31006和31007站)出现较高的丰度值,这些站位恰好处于长江口冲淡水向东海的扩展范围内。与相邻站位的比较发现,31004、31006和31007站的底层水温、底层盐度和沉积物中叶绿素a含量皆因长江口冲淡水的影响而变化较大。聚类分析也表明近岸与受长江口冲淡水影响的站位具有较高的相似性。结合环境因子各变量、小型底栖动物丰度分布以及相关分析结果可以看出,长江口及邻近海域小型底栖动物丰度的水平分布明显受到长江口冲淡水的影响,表现为长江口冲淡水向东海的扩展范围内,小型底栖动物的丰度较相邻的东海离岸海域明显增加。这是因为长江冲淡水带来丰富的陆源营养物质,为小型底栖动物提供了丰富的食物,而粘土-粉砂质沉积物类型也为小型底栖动物尤其是线虫提供了良好的栖息环境,二者相辅相成。
另外,通过比较离岸站位的小型底栖动物丰度值,发现在3100、3000和2900断面,每个断面中离岸最远站位的小型底栖动物丰度值均高于离岸次远站位(如31007>31006,30006>30005,29007>29006)。结合黑潮路径可以看出,每个断面中离岸最远站位相较离岸次远站位受黑潮的影响更大,即离岸较远的站位受长江冲淡水影响小,而受黑潮暖流的影响较大,黑潮暖流高温高盐的特征使其流经海域更加适合小型底栖动物的生长繁殖,造成这些站位的小型底栖动物丰度较高。
在小型底栖动物的类群组成上,本研究与国内长江口和其他海域的研究结果相比具有相似性,同时也有其独特性。和绝大多数研究一样,线虫在小型底栖动物的丰度组成上占绝对优势(94.4%)。但不同的是,多数研究显示丰度高居第2位的是桡足类,而本研究发现涡虫类所占比例略高于桡足类(分别为2.3%和2.0%)。分析该海域桡足类丰度相对较低的原因可能是长江口环境污染较重,底栖桡足类相较其他类群对环境污染更为敏感,导致其数量降低[14]。此外,本调查时间正值秋冬季,沉积物中叶绿素a含量(0.9μg/g)较低,略高于2007年4—5月对同一海域的测量结果(0.5μg/g),但明显低于2003年6月(2.5μg/g);沉积物中的叶绿素a含量是底栖生产力的主要指标,底栖桡足类多以底栖微藻为食,藻类量少可能对桡足类造成食物限制,从而导致其数量较少。
本研究与我国其他海域的调查结果相比,在东海离岸未受长江口冲淡水影响的海域,小型底栖动物的丰度仅高于台湾海峡[15],但低于南海的研究结果[16];而在东海近岸及受长江口冲淡水影响的海域,小型底栖动物丰度较高,接近于南黄海[17]和胶州湾[18],但低于北黄海[17]和渤海[19]。与长江口同类研究相比,小型底栖
动物丰度平均为1081个/10 cm2,接近于2007年4—5月 (1117个/10 cm2)[3],但明显低于2003年6月的结果(1971个/10 cm2)[4]。究其原因,可能与沉积物中叶绿素a含量的多寡密切相关。与本研究一样,华尔[4]、张志南[5]、Liu[20]、张艳[21]等的研究结果也显示,小型底栖动物丰度与沉积物中叶绿素 a 含量呈显著正相关。在垂直分布上,本研究发现70.8%的小型底栖动物和69.9%的海洋线虫分布于沉积物0—2 cm表层,均高于2007年4—5月(65%,64%)和2003年6月(54%,54%)的研究结果,这可能是由于采样站位(本研究采样站位分布更为广泛,而后两者特别是2003年6月的采样站位大多集中于近岸)和季节的不同所致。
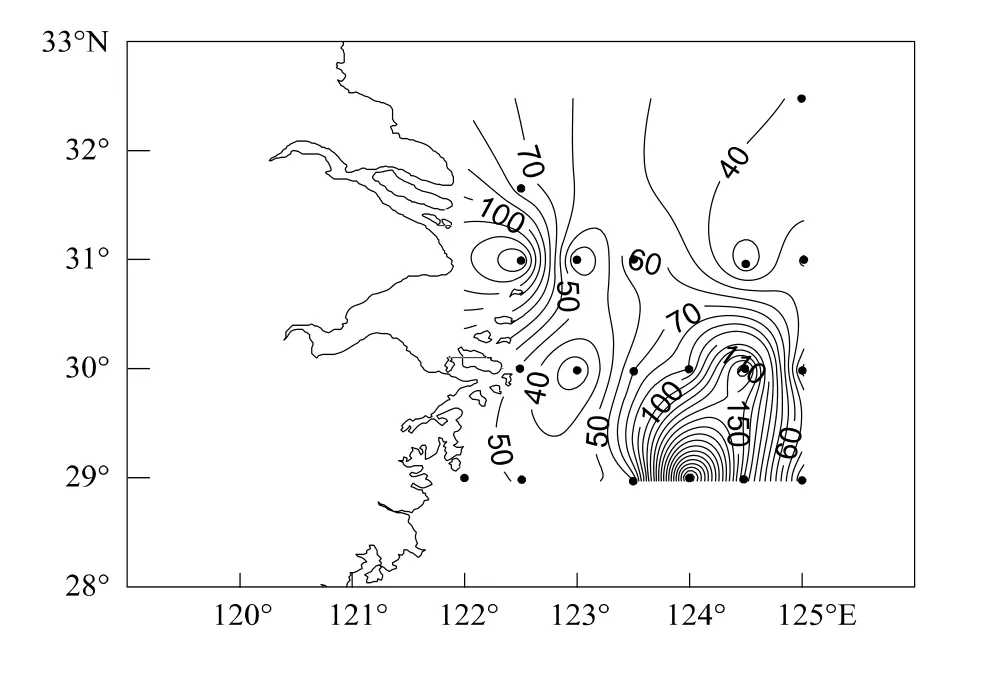
图9 线虫与桡足类丰度比值(N/C)Fig.9 Ratio of nematodes to copepods in abundance(N/C)
3.3 海洋线虫与桡足类数量之比(N/C)在环境监测中的应用
由于海洋线虫和桡足类对适宜环境的要求和对有机质污染的耐受力不同,因此可将二者的数量之比(N/C)作为指示海洋环境富营养化的指标。一般认为N/C比值小于50时环境质量正常,50—100属于富营养化,大于100则属于有机质污染。这一简单的数量比值尽管存在一些争议,但仍成功地应用于许多海域的环境评价[14,22-24]。
据《2009年中国海洋环境质量公报》,东海严重污染的海域主要集中在长江口、杭州湾、象山港和乐清湾海域。本研究所得N/C比值在长江口及周边海域由近岸向外海递减(图9),与该海域的环境质量状况基本吻合,其中近岸的31002站N/C比值达142,与该站位及周边所遭受的较重污染吻合。另外,CJ2和29001站的N/C比值均大于50,也是通常富营养化较重的站位,其他站位的N/C比值均接近或小于50。然而在离岸较远的一些站位(如29005、29006和30005)的N/C比值却离奇增大,这与该海域的环境质量状况并不相符。在自然状态下,线虫和底栖桡足类的丰度与沉积物类型、有机质含量、食物来源、季节和自身繁殖等因素有关,其各自数值的大小随着时间和空间的变化波动[25]。其中,沉积物类型的影响可能更为显著,通常底栖线虫在泥质或泥沙质沉积物中数量更大,而底栖桡足类则喜栖沙质沉积物,因此将两者数量之比用于反映环境的有机污染状况存在很大的不确定性。
综上所述,N/C比值可大致反映海域的环境质量状况,可作为环境监测的一个参考指标。但需要特别指出的是,该比值易受沉积物类型等因素的交互影响而造成估计偏差,故利用N/C比值进行环境质量评价时,需结合沉积环境因子和小型底栖动物群落组成来具体分析。致谢:中国科学院海洋研究所“2009年秋季中国近海海洋科学考察开放共享航次”提供水文数据,底栖生物组全体成员对采样提供帮助,孟昭翠在数据统计分析中给予帮助,特此致谢。
[1] Zhang Z N,Zhou H.Some progress on the study of meiofauna.Periodical of Ocean University of China,2004,34(5):799-806.
[2] Coull B C.Role of meiofauna in estuarine soft-bottom habitat.Australian Journal of Ecology,1999,24(4):327-343.
[3] Wang X G,Wang C S,Zhang D S,Hong L S,Yang D.Abundance and biomass of meiofauna in the Changjiang Estuary and its adjacent continental shelf waters in spring,2007.Acta Ecologica Sinica,2010,30(17):4717-4727.
[4] Hua E,Zhang Z N,Zhang Y.Abundance and biomass of meiobenthos in the Changjiang(Yangtze River)estuary and its adjacent waters.Acta Ecologica Sinica,2005,25(9):2234-2242.
[5] Zhang Z N,Lin K X,Zhou H,Han J,Wang R Z,Tian SY.Abundance and biomass of meiobenthos in autumn and spring in the East China Sea and the Yellow Sea.Acta Ecologica Sinica,2004,24(5):997-1005.
[6] Pfannkuche O,Thiel H.Sample processing//Heggins R P,Thiel H,eds.Introduction to the Study of Meiofauna.Washington DC:Smithsonian Institution Press,1988:134-145.
[7] McIntyre A D.The meiofauna and macrofauna of some tropical beaches.Journal of Zoology,1968,156(3):377-392.
[8] Widbom B.Determination of average individual dry weights and ash-free dry weights in different sieve fractions of marine meiofauna.Marine Biology,1984,84(1):101-108.
[9] Nozais C,Perissinotto R,Tita G.Seasonal dynamics of meiofauna in a South African temporarily open/closed estuary(Mdloti Estuary,Indian Ocean).Estuar,Coastal and Shelf Science,2005,62(1/2):325-338.
[10] Wieser W.Benthic studies in Buzzards Bay.II.The meiofauna.Limnology and Oceanography,1960,5(2):121-137.
[11] Liu C L,Zhu Z G,He X L,Zhang B,Xia N.Rapid determination of organic carbon in marine sediment samples by potassium dichromate oxidation-ferrous sulphate titrimetry.Rock and Mineral Analysis,2007,26(3):205-208.
[12] Wang R.Correction of the formula to convert fluorescence measurement to phaeophorbide a concentration in acidification method.Marine Sciences,1986,10(5):1-5.
[13] Zhou H,Zhang Z N.Rationale of the multivariate statistical software PRIMER and its application in benthic community ecology.Journal of Ocean University of Qingdao,2003,33(1):58-64.
[14] Raffaelli D G,Mason C F.Pollution monitoring with meiofauna,using the ratio of nematodes to copepods.Marine Pollution Bulletin,1981,12(5):158-163.
[15] Fang SH,Lv X M,Zhang Y P,Cai L Z,Hong H S.Distribution abundance of meiobenthos in the Taiwan Strait.Acta Oceanologica Sinica,2000,22(6):136-140.
[16] Du Y F,Xu K D,Meng Z C,Wang JD.Spatial distribution of meiofauna in relation to environmental factors in the South China sea.Oceanologia et Limnologia Sinica,2010,41(2):199-207.
[17] Wang JD,Lei Y L,Xu K D,Du Y F.An invastigation on the biomass,abundance and distribution of meiofauna under the cold water mass and its surrounding areas of the Yellow sea.Oceanologia et Limnologia Sinica,2011,42(3):359-366.
[18] Zhang ZN,Zhou H,Yu Z S,Han J.Abundance and biomass of the benthic meiofauna in the northern soft bottom of the Jiaozhou bay.Oceanologia et Limnologia Sinica,2001,32(3):139-147.
[19] Mu F H,Zhang Z N,Guo Y Q.Abundance and biomass of the benthic meiofauna in the Bohai sea.Journal of Ocean University of Qingdao,2001,31(6):897-905.
[20] Liu X S,Zhang Z N,Huang Y.Sublittoral meiofauna with particular reference to nematodes in the southern Yellow Sea,China.Estuarine,Coastal and Shelf Science,2007,71(3/4):616-628.
[21] Zhang Y.A study on seasonal variation of abundance and biomass of meiofauna at the typical station in Jiaozhou bay.Chinese Agricultural Science Bulletin,2009,25(17):296-301.
[22] Coull B C,Hicks G R F,Wells JB J.Nematode/copepod ratios for monitoring pollution:a rebuttal.Marine Pollution Bulletin,1981,12(11):378-381.
[23] Raffaelli D.The behaviour of the nematode/copepod ratio in organic pollution studies.Marine Environmental Research,1987,23(2):135-152.
[24] Warwick R M.The nematode/copepod ratio and its use in pollution ecology.Marine Pollution Bulletin,1981,12(10):329-333.
[25] Guo Y Q,Zhang Z N,Mu F H.The study on the ratio of abundance of nematodes to that of copepods in the Bohai sea.Marine Sciences,2002,26(12):27-31.
参考文献:
[1] 张志南,周红.国际小型底栖生物研究的某些进展.中国海洋大学学报:自然科学版,2004,34(5):799-806.
[3] 王小谷,王春生,张东声,洪丽莎,杨丹.长江口及其陆架春季小型底栖生物丰度和生物量.生态学报,2010,30(17):4717-4727.
[4] 华尔,张志南,张艳.长江口及邻近海域小型底栖生物丰度和生物量.生态学报,2005,25(9):2234-2242.
[5] 张志南,林岿旋,周红,韩洁,王睿照,田胜艳.东、黄海春秋季小型底栖生物丰度和生物量研究.生态学报,2004,24(5):997-1005.
[11] 刘昌岭,朱志刚,贺行良,张波,夏宁.重铬酸钾氧化-硫酸亚铁滴定法快速测定海洋沉积物中有机碳.岩矿测试,2007,26(3):205-208.
[12] 王荣.荧光法测定浮游植物色素计算公式的修正.海洋科学,1986,10(3):1-5.
[13] 周红,张志南.大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用.青岛海洋大学学报:自然科学版,2003,33(1):58-64.
[15] 方少华,吕小梅,张跃平,蔡立哲,洪华生.台湾海峡小型底栖生物数量的量分布.海洋学报,2000,22(6):136-140.
[16] 杜永芬,徐奎栋,孟昭翠,王家栋.南海小型底栖动物生态学的初步研究.海洋与湖沼,2010,41(2):199-207.
[17] 王家栋,类彦立,徐奎栋,杜永芬.黄海冷水团及周边海域夏初小型底栖动物现存量及空间分布研究.海洋与湖沼,2011,42(3):359-366.
[18] 张志南,周红,于子山,韩洁.胶州湾小型底栖生物的丰度和生物量.海洋与湖沼,2001,32(2):139-147.
[19] 慕芳红,张志南,郭玉清.渤海小型底栖生物的丰度和生物量.青岛海洋大学学报,2001,31(6):897-905.
[21] 张艳.胶州湾典型站位小型底栖生物丰度和生物量的季节变化研究.中国农学通报,2009,25(17):296-301.
[25] 郭玉清,张志南,慕芳红.渤海海洋线虫与底栖桡足类数量之比的应用研究.海洋科学,2002,26(12):27-31.
