普伐他汀减轻大鼠急性心肌梗死后瞬时外向钾电流的表达
2013-09-15杨海燕张玉方
杨海燕,佘 强,张玉方
(1.重庆市第三人民医院老年心血管科,重庆400014;2.重庆医科大学附属第二医院心血管内科,重庆400016;3.重庆市江北区第一人民医院药剂科,重庆400020)
急性心肌梗死(acute myocardial infarction,AMI)后心肌细胞膜离子通道的异常活动,形成电重构,可能是导致AMI后出现心律失常的原因。抗心律失常药物的应用减少了心律失常的发生,但同时又有致心律失常的潜在风险,这就需要新的更安全的抗心律失常药物。他汀类药物目前研究较多,它具有抗心律失常作用[1],尚未见报道其有致心律失常的作用,但其抗心律失常的机制尚不明确。瞬时外向钾电流(transient outward potassium current,Ito)在心肌动作电位的快速复极I期中起重要作用,目前认为大鼠Ito主要由Kv1.4、Kv4.2及Kv4.3编码;研究发现,在大鼠AMI后,心室肌细胞Ito电流密度下降[2],但尚无各时间点对比的报道。本研究观察大鼠AMI模型不同时间点Ito各基因表达的变化,及普伐他汀对AMI后Ito表达的影响,为AMI后心律失常的药物治疗提供新的研究方向。
1 材料与方法
1.1 动物模型的建立及分组
1.1.1 大鼠AMI模型的建立:SPF级雄性SD大鼠,体质量200~250 g,由重庆医科大学动物实验中心[SCXK(渝)2007-0001]提供,采用常规方法建立大鼠AMI模型[3],假手术大鼠为前降支只穿线不打结。取成功手术大鼠20只,随机分为4组,每组5只。其中4组分别为手术后24 h组、手术后1周组、手术后4周组、手术后4周加普伐他汀治疗组(20 mg/kg每天灌胃1次,药物购自上海三共制药有限公司)及假手术组。后者15只,在前述3个时间点取心脏标本,每组5只。除普伐他汀组外其余各组均以等量0.9%氯化钠注射液灌胃。
1.1.2 采集心脏标本:在10%水合氯醛(0.3 mL/100 g)麻醉下迅速处死大鼠,取右室游离壁,在0.9%氯化钠及0.1%DEPC水中清洗,置于液氮中保存。
1.2 Real-time PCR法检测Kv1.4、Kv4.2及Kv4.3 mRNA
1.2.1 引物设计:使用Primer Premier 5.0软件设计特异性引物。kv1.4上游引物5'-GAATGACACCT CGGCACCC-3',下游引物 5'-AAACTCAAAGGAAAA CCACACG-3',长度106 bp;kv4.2上游引物5'-CTT CTGCTTGGATACCGCC-3',下游引物5'-AGCCCAAT GTAATAGGGTAGGAT-3',长度144 bp;Kv4.3 上游引物 5'-TGCCTGGGAGCAAGGAACT-3',下游引物5'-CACTGCGGATGAAGCGGTA-3', 长 度 144 bp。β-actin上游引物 5'-CCCATCTATGAGGGTTACGC-3',下游引物 5'-TTTAATGTCACGCACGATTTC-3',长度150 bp。
1.2.2 Kv1.4、Kv4.2及Kv4.3 mRNA相对表达量的检测:取右室心肌组织50~100 mg,采用Trizol试剂提取总RNA,取5 μL RNA模板行反转录成cDNA(反应条件:25℃ 10 min,40℃ 60 min,70℃ 10 min)。扩增目的基因和管家基因(反应参数:93℃ 2 min,93 ℃ 5 s,60 ℃ 20 s,72 ℃ 20 s,40 cycles),其产物进行梯度稀释用于标准曲线绘制,按照ShineSYBR Real time qPCR Mastermix试剂盒(上海闪晶生物公司)说明书进行荧光定量扩增目的基因和管家基因,扩增条件为94 ℃ 4 min,94 ℃ 15 s,60 ℃ 25 s,72 ℃ 25 s,40个循环。根据Ct值读出起始模板量后计算出目的基因的相对拷贝数。
1.3 Westernblot法检测 Kv1.4、Kv4.2及 Kv4.3蛋白
取右室心肌组织约100 mg,按100 mg/mL加入RIPA全蛋白提取液(上海申能博彩公司),加入10 μL PMSF,冰上匀浆30 min,4 ℃ 12 000 r/min离心30 min,取上清液20 μL BCA测定蛋白浓度。其余上清液加入等量2×上样缓冲液,于70℃加热10 min,以10%SDS-PAGE凝胶电泳分离蛋白,电转移蛋白至PVDF膜上,5%脱脂奶粉封闭,室温孵育2 h,加入一抗(兔抗大鼠 Kv1.4、Kv4.3和 Kv4.2,0.8 mg/mL),37℃、60 r/min摇动90 min,弃去一抗,用Tris-HCl缓冲盐溶液洗涤3次,加入二抗(辣根过氧化物酶标记的羊抗兔抗体,1∶1 000)37℃孵育1 h,弃去二抗,再用Tris-HCl缓冲盐溶液洗涤3次。增强化学发光(ECL)显影,置于凝胶图像分析系统分析条带吸光度值。
1.4 统计学分析
2 结果
2.1 Kv1.4、Kv4.2及Kv4.3 mRNA的表达
假手术组各时间点右室心肌Kv1.4、Kv4.2及Kv4.3 mRNA及蛋白质表达无明显差异。AMI后24 h,Kv1.4 mRNA表达开始增高,1周组、4周组与24 h组比较无明显差异;Kv4.2 mRNA表达在AMI后24 h开始降低,4周组更低,1周组较24 h组比较无明显差异;Kv4.3 mRNA表达在AMI后各时间点均降低,24 h组最低,1周组与4周组比较无明显差异,具体数据见表1。
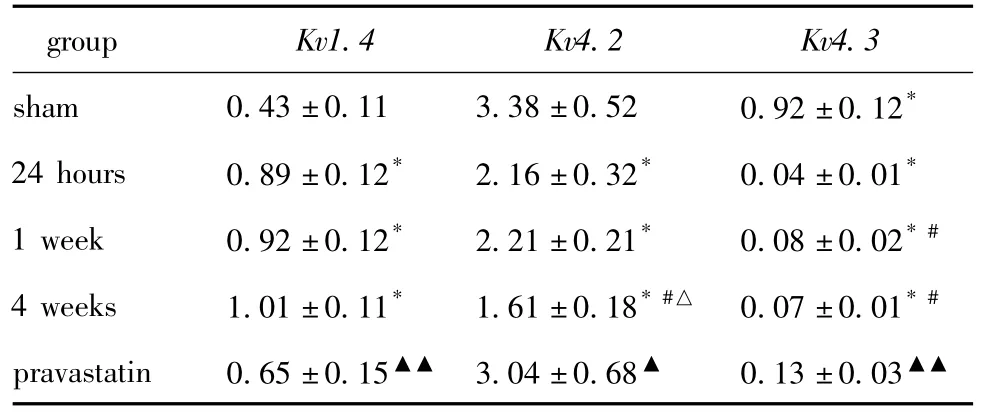
表1 各组mRNA表达水平Table 1 mRNA expression of each group(n=5)
2.2 Kv1.4、Kv4.2及Kv4.3蛋白质的表达
Kv1.4蛋白质表达在AMI后24 h开始增高,1周组、4周组与24 h组比较无明显差异,普伐他汀组与4周组比较表达降低;而Kv4.2及Kv4.3蛋白质在AMI后24 h开始降低,具体数据见表2,图1。

表2 各组蛋白质表达水平Table 2 Protein expression of each group(n=5)
2.3 普伐他汀组与 4周组 Kv1.4、Kv4.2、Kv4.3 mRNA及蛋白质表达水平的比较
普伐他汀组Kv1.4 mRNA及蛋白质表达水平较4周组降低,而Kv4.2、Kv4.3 mRNA及蛋白质表达水平较4周组增高,具体数据见表1,表2及图1。

图1 各组Kv1.4、Kv4.2、Kv4.3蛋白质表达Fig 1 Protein expression changes of Kv1.4,Kv4.2,Kv4.3
3 讨论
Ito是控制心室肌细胞动作电位时程的主要电流[4]。Ito有两种成分:慢成分(Kv1.4基因编码)及快成分(Kv4.2、Kv4.3基因编码)两种。Ito在心脏中的分布具有明显的组织特异性,心尖部大于基底部,心外膜大于心内膜,研究发现药物对Ito影响程度也和组织分布有关[5-6]。本研究选用大鼠右室心肌,其原因是在左室AMI后,右室代偿功能起着重要作用,也同样存在基因表达的变化,右室相对远离梗死区域,可以避免取材时组织缺血本身对Ito表达的影响,而且右室游离壁壁薄,量相对较少,检测时使用了全部右室标本,避免了Ito组织特异性分布对结果的影响。
AMI后心肌细胞的丢失引起心室重构,Ito电流下降,心肌细胞复极不均一,导致心律失常的发生[7]。研究发现犬及大鼠 AMI后 Ito电流密度下降,Kv1.4表达增高,而 Kv4.2及 Kv4.3表达降低[8-9],但未见 AMI后各时间点变化趋势的报道。本文报道了大鼠AMI后 Kv1.4、Kv4.2及Kv4.3表达的变化趋势,为AMI后Ito研究的时间点选取提供依据。血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)水平及AngⅡ1型受体、肿瘤坏死因子(tumor necrosis factor,TNF)、血浆游离脂肪酸的变化可以影响Ito的表达[10-11],目前认为 AMI后 Ito表达变化的机制可能与AMI后循环及心肌局部AngⅡ增高及TNF表达增加所致。
他汀类药物能抑制心肌梗死后心肌局部AngⅡ产生,使AngⅡ1型受体活性下调,抑制TNF的表达及抗心律失常等作用,抗心律失常的机制尚不明确。有报道阿托伐他汀可阻止Ito在单纯缺血时持续减小的趋势[12]。本研究发现,普伐他汀能抑制 AMI后Kv1.4表达增高及Kv4.2、Kv4.3表达降低,其机制可能是他汀类药物抑制心肌局部AngⅡ产生、下调AngⅡ1型受体活性、抑制TNF的表达使Kv4.3及Kv4.2 mRNA表达增加,从而反转AMI后心肌细胞Ito的减少,减少AMI后复极不均一性,发挥AMI后抗心律失常的作用,但本实验未同时进行心肌局部AngⅡ、AngⅡ1型受体活性及TNF的表达的检测,其机制尚需进一步证实。
[1]Vedre A,Gurm H,Froehlich J,et al.Impact of prior statin therapy on arrhythmic events in patients with acute coronary syndromes(from the Global Registry of Acute Coronary Events[GRACE])[J].Am J Cardiol,2009,104:1613 -1617.
[2]Wen D,Penelope A,Boyden.Diverse phenotypes of outward currents in cells that have survived in the 5-day-infarcted heart[J].Am J Physiol Heart Circ Physiol,2005,289:667-673.
[3]刘开宇,田海,孙露,等.标准化大鼠心肌梗死模型的制作[J].哈尔滨医科大学学报,2007,41:531-534.
[4]Scholz E,Welke F,Joss N,et al.Central role of PKCα in isoenzyme-selective regulation of cardiac transient outward current Ito and Kv4.3 channels[J].J Mol Cell Cardiol,2011,51:722 -729.
[5]Calloe K,Nof E,Jespersen T,et al.Comparison of the effects of a transient outward potassium channel activator on currents recorded from atrial and ventricular cardiomyocytes[J].J Cardiovasc Electrophysiol,2011,22:1057 -1066.
[6]Su F,Shi M,Yan Z,et al.Simvastatin modulates remodeling of Kv4.3 expression in rat hypertrophied cardiomyocytes[J].Int J Biol Sci,2012,8:236 - 248.
[7]Zhang L,Xu C,Hong Y,et al.Propranolol regulates cardiac transient outward potassium channel in rat myocardium via cAMP/PKA after short-term but not after long-term ischemia[J].NaunynScmied Arch Pharmacol,2010,382:63-71.
[8]Wen Dun,Penelope A.Boyden.Diverse phenotypes of outward currents in cells that have survived in the 5-day-infarcted heart[J].Am J Physiol Heart Circ Physiol,2005,289:667-673.
[9]Wickenden,Alan D,Roger Kaprielian,et al.The thyroid hormone analog DITPA restores Ito in rats after myocardial infarction[J].Am J Physiol Heart Circ Physiol,2000,278:1105-1116.
[10]Ozgen N,Lu Z,Boink GJ,et al.Microtubules and angiotensinⅡreceptors contribute to modulation of repolarization induced by ventricular pacing[J].Heart Rhythm,2012,11:1865 -1872.
[11]向玉鸾,何莉,余强.盐酸曲美他嗪对大鼠缺血心室肌Ito通道仪亚单位表达影响的研究[J].重庆医科大学学报,2010,35:1779 -1781.
[12]赵青,李洪仕,万征,等.阿托伐他汀对大鼠模拟缺血左室瞬时外向钾电流的作用[J].中国心脏起搏与心电生理杂志,2011,25:426-430.
