MG132对肿瘤恶病质小鼠骨骼肌消耗及TRAF6表达的影响
2013-09-15张刘平郑曰勇周小雨
张刘平,唐 华,郑曰勇,周小雨,朱 萌,寇 耀
(重庆医科大学附属第一医院胃肠外科,重庆400016)
恶病质在肿瘤患者中非常普遍,约80%的癌症晚期患者都会出现恶病质状态,且在肿瘤引起的死亡患者中占约占30%[1],但是目前临床缺乏有效治疗方法。骨骼肌消耗是肿瘤恶病质最突出的特征,导致患者活动减少,生命质量降低,生存时间缩短[2]。肿瘤坏死因子受体相关因子6(TRAF6)是肿瘤坏死因子(tumor necrosis factor,TNF)超家族和Toll样/白细胞介素-1受体(toll sample/interleukin-1 receptor,TIR)超家族重要的接头分子,最近研究显示,TRAF6可以通过调节蛋白降解的自噬溶酶体途径(autophagy-lysosome pathway,ALP)和泛素蛋白酶体途径(ubiquitin-proteasome pathway,UPP),在饥饿、糖尿病、去神经和肿瘤等引起的骨骼肌消耗中起到重要的调节作用[3-5]。Beclin-1是ALP标志性因子[6],而UPP又是以 MuRF1和 MAFbx表达增高为特征[7]。蛋白酶体抑制剂MG132能够抑制TRAF6的表达[8],故本研究采用MG132治疗肿瘤恶病质小鼠,观察其对骨骼肌组织的消耗、TRAF6、Beclin-1、MuRF1和MAFbx基因表达的影响。
1 材料与方法
1.1 实验材料
SPF级BALB/c小鼠,雄性,6~8周龄,体质量20~24 g,重庆医科大学实验动物中心提供(合格证号:SCXK渝20020001);小鼠结肠腺癌 Colon26(C26)细胞系由重庆医科大学病理教研室惠赠;MG132、MuRF1和 MAFbx一抗(Santa cruz公司);TRAF6一抗(Epitomics公司);Beclin1一抗(Proteintech公司);β-actin和二抗(凯基生物公司);Western blot相关试剂盒(碧云天生物有限公司);RTPCR相关试剂盒(TaKaRa公司);引物(上海生物工程技术有限公司)。
1.2 分组及建模
24只小鼠随机分为对照组(HC),恶病质组(CC),MG132治疗组(MG)。适应性喂养1周后,取小鼠结肠腺癌C26细胞0.1 mL(约1×106个/只)接种于后两组小鼠右侧腋窝皮下。荷瘤小鼠平均体质量开始显著下降,并出现自发性活动减少、虚弱、精神不振等表现,即进入恶病质期。
1.3 治疗和监测
每天定时监测小鼠体质量、毛发、精神状态。从接种后第12天荷瘤小鼠进入恶病质起,给MG组每天腹腔注射0.1 mg/kg的MG132,HC和CC组给予等量0.9%氯化钠注射液,治疗7 d。于相同时间段采用ZH-ZFT型自发活动实验视频分析系统记录小鼠第1天、第12天和第19天1 h内自发性活动总路程。第19天脱颈椎处死小鼠,称量肿瘤、左侧腓肠肌质量,小鼠去瘤体质量等于终末体质量减去肿瘤质量。
1.4 腓肠肌纤维横切面积
腓肠肌组织常规制片,HE染色后,200倍光镜下摄像,采用Image Pro Plus 6.0软件测量各组200个腓肠肌纤维横切面积。
1.5 RT-PCR检测
提取腓肠肌RNA,测浓度和完整性后反转录合成cDNA。所需的引物见表1。使用SYBR Green Reahime PCR Master Mix试剂盒以合成的cDNA为模板进行PCR反应,反应体系:cDNA 2 μL,上下游引物各0.8 μL,染料混合液10 μL,加去离子水至20 μL;反应条件为:95℃预变性1 min;95℃变性5 s,58 ℃ 退火15 s,72 ℃ 延伸15 s,共 40 个循环。根据2-ΔΔct公式计算目的产物mRNA的相对转录水平。实验重复3次。
1.6 Western blot检测
提取腓肠肌组织蛋白、测浓度、转膜、封闭、然后与相应 TRAF6、Beclin1、MAFbx 和 MuRF1、β-actin抗体孵育过夜、洗膜、再与相应二抗孵育、再洗膜、显影。将目标蛋白与内参β-actin吸光度值的比值作为目标蛋白的相对表达水平。实验重复3次。

表1 引物序列及产物长度Table 1 Primer sequence and product length
1.7 统计学分析
2 结果
2.1 小鼠一般状况
从接种第5天开始CC和MG组小鼠皮下均可触及肿瘤结节,第12天出现体质量显著下降(P<0.05),并出现自发性活动减少(P<0.05)、毛发变暗无光泽、虚弱、精神不振等恶病质症状,第19天与CC组相比,MG组小鼠终末去瘤体质量增加(P<0.05)、自发性活动总路程增加(P<0.05)(图1,2)。

图2 不同时间点各组小鼠1 h自发性活动总路程Fig 2 Total distances of spontaneous activity within one hour for different group of mice at different time points
2.2 腓肠肌重量和横切面积
与HC组比较,CC和MG组小鼠的腓肠肌组织重量均降低(P<0.05)、腓肠肌横切面积减小(P<0.05)。与CC组比较,MG组小鼠腓肠肌组织重量增长了31.6%(P<0.05),腓肠肌横切面积增长了32.6%(P <0.05)(表2,图3)。

表2 MG132对各组小鼠腓肠肌重量和横切面积的影响Table 2 Effect of MG132 on the weight and crosscut area of gastrocnemius muscle(x ± s,n=8)
2.3 小鼠腓肠肌 TRAF6、Beclin1、MAFbx和MuRF1 mRNA表达水平
与HC组比较,CC和MG组小鼠的腓肠肌组织TRAF6、Beclin1、MAFbx和 MuRF1的 mRNA 表达水平均升高(P<0.05)。与CC组比较,MG组小鼠腓肠肌组织 TRAF6、Beclin1、MAFbx和 MuRF1的mRNA表达水平分别降低了56.3%、65.8%、54.5%和57.3%(均P <0.05)(图4)。
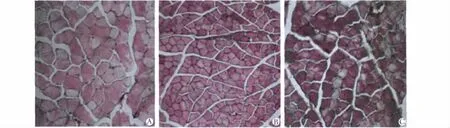
图3 各组小鼠腓肠肌组织横切面HE染色Fig 3 Fiber cross-section of gastrocnemius muscle in each group mice by HE staining(×200)
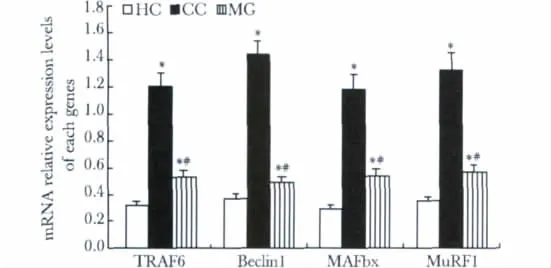
图4 各组小鼠腓肠肌TRAF6、Beclin1、MAFbx和MuRF1 mRNA相对表达水平Fig 4 MRNA relative expression levels of TRAF6,Beclin1,MAFbx and MuRF1 in gastrocnemius muscle of different groups of mice(x ± s,n=3)
2.4 小鼠腓肠肌 TRAF6、Beclin1、MAFbx和MuRF1蛋白表达水平
蛋白表达水平与mRNA表达水平趋势相同,与HC组比较,CC和MG组小鼠的腓肠肌组织TRAF6、Beclin1、MAFbx和MuRF1的蛋白表达水平均升高(P<0.05)。与CC组比较,MG组小鼠腓肠肌组织TRAF6、Beclin1、MAFbx和MuRF1的蛋白表达水平分别降低了54.0%(0.872±0.072 vs 0.401±0.028,P <0.05)、59.2%(0.901±0.081 vs 0.368±0.022,P <0.05)、49.9%(0.866±0.079 vs 0.434±0.037,P<0.05)和48.6%(0.799±0.073 vs 0.411±0.031,P <0.05)(图5)。
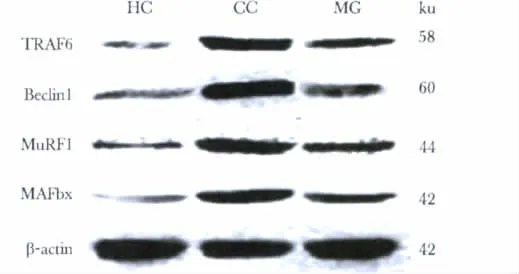
图5 各组小鼠腓肠肌TRAF6、Beclin1、MAFbx和MuRF1蛋白表达水平Fig 5 Protein levels of TRAF6,Beclin1,MAFbx and MuRF1 in gastrocnemius muscle of different groups of mice(x ± s,n=3)
3 讨论
肿瘤恶病质是以传统的营养支持不能被完全逆转的进行性骨骼肌组织减少,并导致进一步功能损害为特征的多因子综合征[9]。肌肉消耗和恶病质是导致癌症患者死亡的直接原因,有效地阻止或逆转骨骼肌消耗是肿瘤恶病质治疗的重要组成部分。
TRAF6是 TRAFs家族7个密切相关蛋白(TRAF1-7)的一种,因其特殊的结构域而位于TNF和TLR两大超家族诱导的信号汇合的中心点,广泛参与炎性反应、骨代谢、乳腺发育、淋巴结的形成、细胞增殖和胚胎发育等。最新研究显示,TRAF6在饥饿、糖尿病、去神经和肿瘤等引起的骨骼肌消耗中也发挥重要作用[3-5]。蛋白酶体抑制剂成为目前研究的热点[10],而MG132是一种有效的、可逆的醛基肽类特异性26S蛋白酶体抑制剂,能够抑制TRAF6的表达[8]。本实验发现,与 CC组比较,经 MG132治疗后小鼠去瘤体质量增加,自发性活动量提高,腓肠肌重量和横切面积均增长,同时TRAF6的mRNA和蛋白表达水平均减低,推测MG132改善骨骼肌消耗可能与抑制TRAF6有关。
蛋白质的降解目前主要有3条途径:自噬溶酶体途径(ALP)、泛素蛋白酶体途径(UPP)和钙依赖蛋白酶途径,而ALP和UPP是机体修复或消除异常蛋白质的两种最主要的途径。UPP在肿瘤恶病质肌肉蛋白质的降解中起至关重要的作用,该途径以两个E3泛素连接酶MuRF1和MAFbx表达增高为特征,抑制MuRF1或MAFbx的表达能改善肿瘤恶病质肌肉萎缩和蛋白降解[7]。ALP在骨骼肌的肌原纤维蛋白质水解中所起的重要作用又是以Beclin1表达增高为特征[6]。进一步证据表明,在不同的萎缩条件下,这两条途径是通过一种协调的方式来增加蛋白质的降解。TRAF6可调控NF-κB,AP-1和(PI3K)/Akt等多条信号通路[5,11],最终抑制 UPS 和ALP途径,在肿瘤恶病质引起的骨骼肌消耗中发挥作用[5]。本实验也发现,随着TRAF6表达的减少,Beclin1、MAFbx和 MuRF1的 mRNA和蛋白表达水平也降低,推测MG132可能抑制腓肠肌TRAF6的表达,阻断ALP和UPP途径,对肿瘤恶病质骨骼肌消耗起到保护作用,但是MG132是如何抑制TRAF6的表达,且具体通过哪些信号通路降低Beclin1、MAFbx和MuRF1的表达仍需进一步的研究。
[1] Tisdale MJ.Mechanisms of cancer cachexia[J].Physiol Rev,2009,89:381 -410.
[2] Dodson S,Baracos VE,Jatoi A,et al.Muscle wasting in cancer cachexia:clinical implications,diagnosis,and emerging treatment strategies[J].Annu Rev Med,2011,62:265-279.
[3]Paul PK,Bhatnagar S,Mishra V,et al.The E3 Ubiquitin Ligase TRAF6 Intercedes in Starvation-Induced Skeletal Muscle Atrophy through Multiple Mechanisms[J].Mol Cell Biol,2012,32:1248 -1259.
[4]Kumar A,Bhatnagar S,Paul PK.TWEAK and TRAF6 regulate skeletal muscle atrophy[J].Curr Opin Clin Nutr Metab Care,2012,15:233 -239.
[5]Paul PK,Gupta SK,Bhatnagar S,et al.Targeted ablation of TRAF6 inhibits skeletal muscle wasting in mice[J].J Cell Biol,2010,191:1395 -1411.
[6] Sandri M.Autophagy in skeletal muscle[J].FEBS Lett,2010,584:1411 -1416.
[7]Melstrom LG,Melstrom KA Jr,Ding XZ,et al.Mechanisms of skeletal muscle degradation and its therapy in cancer cachexia[J].Histol Histopathol,2007,22:805 -814.
[8]Xu G,Wen H,Zhou H,et al.Involvement of IRAKs and TRAFs in anti-β2GPI/β2GPI-induced tissue factor expression in THP-1 cells[J].Thromb Haemost,2011,106:1158-1169.
[9]Fearon K,Strasser F,Anker SD,et al.Definition and classification of cancer cachexia:an international consensus[J].Lancet Oncol,2011,12:489 -495.
[10]龙志敏,赵蕾,骆世芳,等.蛋白酶体抑制剂处理神经细胞系后Nicastrin的表达变化及其与Aβ的关系[J].基础医学与临床,2011,31,475 -479.
[11]张文,张烜,曾小峰,等.TRAF6在B淋巴瘤细胞系NF-κB和AP-1信号传导通路中的作用[J].基础医学与临床,2009,29,716 -720.
