一株南海珊瑚细菌L-4抗肿瘤活性次生代谢产物研究*
2013-09-15姚俊华雷玲芳陈小洁黄兆胜张翠仙
郭 琼,王 剑,姚俊华,雷玲芳,陈小洁,邓 芸,黄兆胜,张翠仙
(1.广州中医药大学中药学院,广东广州 510006;2.广州中医药大学基础医学院,广东广州 510006;3.中山大学分析测试中心,广东广州 510275)
海洋微生物由于长期生长于高盐、高压、低温和寡营养的特殊生境中,导致其产生结构独特、新颖并具有高活性、高药效的先导化合物。海洋微生物不仅具有环境友好、可持续发展的特点,同时也是新颖结构天然产物和活性天然产物的重要来源[1-8]。本课题组在研究海洋微生物混合共培养过程中细菌对真菌次生代谢产物的影响时,发现海洋珊瑚内生细菌L-4使真菌菌落生长增快;相反内生细菌B-2使真菌生长延迟,甚至死亡。同时通过TLC分析发现混合培养时产生此二者微生物单独培养时所不产生的物质。同时抗肿瘤活性研究表明,L-4和B-2均具有抗肿瘤活性。基于此,为了阐明混合培养时可能的代谢机制和发现抗肿瘤活性药物先导化合物,首先对L-4的次生代谢产物进行研究,初步从其发酵液中分离得到8个单体化合物,采用现代波谱技术和物理常数对照确定其结果依次为:环 (色 -丙)二肽 (1)、环 (甘 -酪)二肽 (2)、环 (丙-酪)二肽 (3)、环 (缬-酪)二肽 (4)、环 (甘-苯丙)二肽 (5)、环(甘-脯)二肽 (6)、环 (丙 -缬)二肽 (7)、和环 (甘-丙)二肽 (8)。所有化合物首次从南海珊瑚内生细菌中分离得到,且均为环二肽类化合物。
环二肽 (cyclic dipeptides)又名2,5-二氧哌嗪 (2,5-dioxopiperazines)或2,5-二酮哌嗪 (2,5-diketopiperazines),由两个氨基酸通过肽键环合形成,是自然界中最小的环肽。目前自然界中存在的环二肽一般由α-L-氨基酸形成相对稳定的六元环。此类物质研究表明具有抑菌、抗肿瘤、心脑血管系统、神经保护及脱瘾解毒方面具有重要的生理活性[9],但能否在抗生素、抗肿瘤剂、抗凝血剂、神经保护剂、益智剂以及脱瘾剂等药物的研发中具有一定的应用价值,仍有待深入研究。
1 实验部分
1.1 仪器与试剂
AVANCE AV 400核磁共振仪 (瑞士Bruker公司),内标为 TMS,溶剂为氘代吡啶 (Pyr-d5);DSQ质谱仪 (美国Thermo);制备型HPLC色谱柱(大连依利特):Kromasil 100-5-18-C18柱 (10 mm×250 mm,5 μm),葡萄糖、蛋白胨、酵母粉、蔗糖为生化试剂,购于广东环凯微生物科技有限公司。石油醚、乙酸乙酯、甲醇、氯仿等为市售AR试剂。制备液相中甲醇为色谱级 (Merk公司)。
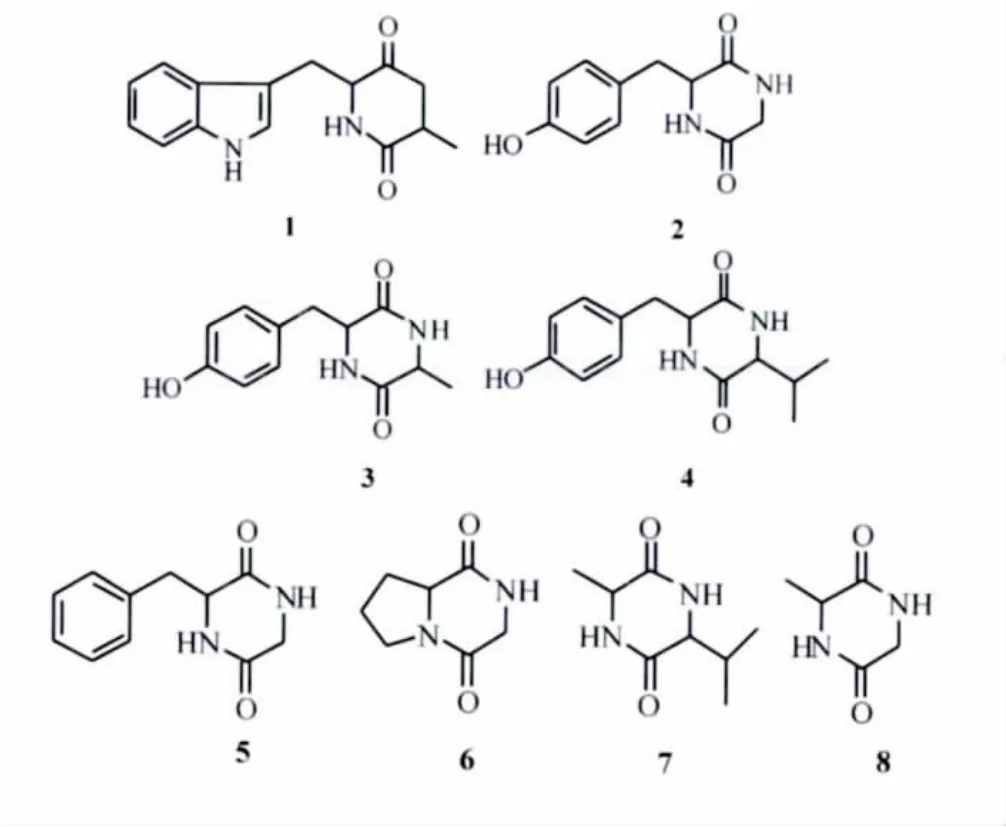
图1 珊瑚内生细菌L-4中的环二肽结构1,2,3,4,5,6,7,8Fig.1 Structures of compounds 1,2,3,4,5,6,7,8 from coral-derived bacteria L - 4
实验用微生物L-4和B-2由海南大学提供(种属鉴定中,样品编号L-4,B-2保存于广州中医药大学中药学院海洋微生物实验室)。
1.2 提取分离
内生细菌L-4在马铃薯培养基 (马铃薯200 g,葡萄糖10 g,蔗糖20 g,蛋白胨2 g,人工海水100 mL,容至1 L,自然pH)中28℃下摇瓶培养2 d,加入5 mL甲醇停止发酵,共发酵200 L。发酵液高速离心得菌丝体和上清液。上清液浓缩后依次用乙酸乙酯 (EtOAc)、正丁醇 (n-BuOH)萃取。乙酸乙酯萃取液减压浓缩,得黄褐色浸膏(53 g)。将乙酸乙酯浸膏 (53 g)经硅胶 (200~300目;60 g)拌样,装柱硅胶 (200~300目;500 g)进行正相硅胶柱层析,采用极性逐渐增大的石油醚-乙酸乙酯体系 (V(PE)∶V(EtOAc)=10∶0、9∶1、8∶2、7∶3、6∶4、1∶1、4∶6、3∶7、2∶8、1∶9、0∶10)进行洗脱,TLC 跟踪并合并流分,共得16个流份。具体分离见分离流程图 (图2)。
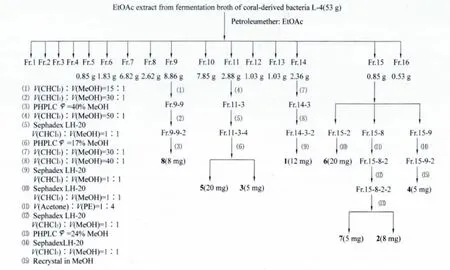
图2 化合物1,2,3,4,5,6,7,8分离流程图Fig.2 Separation process of EtOAc fraction from coral-derived bacteria L - 4
1.3 化合物的物理常数和波谱数据
化合物1:淡黄色粉末,φ=10%香草醛显色剂显紫红色。分子式 C14H15N3O2。ESI-MSm/z:256 [M-H]-。1H NMR(400 MHz,Pyr-d5) δH:11.79(1H,s),9.03(1H,br s),8.91(1H,br s),8.45(1H,d,8.0),7.53(1H,d,8.0),7.45(1H,s),7.23(1H,q,8.0),7.20(1H,q,7.2),4.66(1H,m),4.18(1H,m),3.69(2H,m),1.17(3H,d,6.8);13C NMR(100 MHz,Pyrd5)δC:169.8(CH),168.9(C),138.1(CH),129.3(CH),126.0(CH),122.4(CH),120.3(CH),120.0(CH),112.5(CH),110.6(CH),57.4(CH),51.8(CH2),31.7(CH2),21.1(CH3)。
化合物2:白色粉末。碘熏显色。分子式C11H12N2O3。ESI-MSm/z:219 [M-H]-。1H NMR(400 MHz,Pyr-d5)δH:11.36(1H,br s),9.26(1H,s),8.97(1H,s),7.38(2H,d,8.4),7.08(2H,d,8.4),4.57(1H,m),3.93(1H,dd,16.8,3.2),3.53(1H,d,16.8),3.44(1H,dd,16.2,5.6),3.24(1H,dd,13.5,4.2);13C NMR(100 MHz,Pyr-d5)δC:168.5(C),166.7(C),157.9(C),131.9(2 × CH),126.6(CH),116.0(2 ×CH),57.3(CH),44.8(CH2),39.8(CH2)。
化合物3:白色粉末,易溶于甲醇。碘熏显色。分子式 C12H14N2O3。ESI-MSm/z:233 [MH]-。1H NMR(400 MHz,Pyr-d5)δH:11.32(1H,br s),9.10(1H,s),9.07(1H,s),7.40(2H,d,8.4),7.10(2H,d,8.4),4.60(1H,m),4.20(1H,m),3.51(1H,dd,16.0,5.2),3.30(1H,dd,13.4,4.2),1.30(3H,d,7.2);13C NMR(100 MHz,Pyr-d5)δC:169.8(C),168.8(C),154.5(C),132.8(2 × CH),129.3(CH),115.6(2 ×CH),60.3(CH),54.7(CH2),37.4(CH2),17.0(CH3)。
化合物4:白色粉末,易溶于甲醇。碘熏显色。分子式 C14H18N2O3。ESI-MSm/z:261 [MH]-。1H NMR(400 MHz,Pyr-d5)δH:11.26(1H,br s),9.05(1H,s),9.01(1H,s),7.38(2H,d,8.0),7.10(2H,d,8.2),4.60(1H,m),4.07(1H,m),3.49(1H,dd,16.2,5.4),3.37(1H,dd,13.4,4.2),2.42(1H,m),1.12(3H,d,7.2),0.97(3H,d,6.8);13C NMR(100 MHz,Pyr-d5)δC:169.1(C),168.6(C),158.9(C),132.7(2 × CH),128.5(CH),117.2(2 × CH),62.0(CH),58.3(CH),41.3(CH),33.6(CH2),20.2(CH3),18.2(CH3)。
化合物5:白色粉末 (甲醇)。碘熏显色。分子式 C11H12N2O2。ESI-MSm/z:203 [M-H]-。1H NMR(400 MHz,Pyr-d5)δH:9.29(1H,s),9.01(1H,s),7.24 ~7.45(2H,m),7.26 ~7.19(3H,m),4.59(1H,m),3.96(1H,dd,17.2,3.2),3.50(1H,d,17.2),3.45(1H,dd,13.2,5.6),3.29(1H,dd,13.2,4.4);13C NMR(100 MHz,Pyr-d5)δC:168.4(C),166.7(C),136.9(C),130.7(2 × CH),128.7(CH),127.2(2 × CH),57.3(CH),45.0(CH2),40.8(CH2)。
化合物6:无色透明方型结晶 (甲醇),θmp205~208℃。茚三酮试剂不显色,高锰酸钾试剂显亮黄色斑点。分子式C7H10N2O2。ESI-MSm/z:153 [M-H]-。1H NMR(400 MHz,Pyr-d5) δH:9.12(1H,s),4.17(2H,br t,16.2),4.09(1H,td,16.0,4.4),3.60(1H,dt,8.2,3.2,11.2),3.45(1H,td,10.0,3.2),2.26(1H,m),2.09(1H,m),1.68(1H,m),1.62(1H,m);13C NMR(100 MHz,Pyr-d5)δC:171.3(C),165.6(C),60.2(CH),48.2(CH2),46.6(CH2),30.11(CH2),23.8(CH2)。
化合物7:白色粉末,易溶于甲醇。TLC呈:254 nm下无暗斑,香草醛浓硫酸不显色,茚三酮显色阴性。分子式 C8H14N2O2。ESI-MSm/z:169[M-H]-。1H NMR(400 MHz,Pyr-d5)δH:9.18(1H,s),8.90(1H,s),4.34(1H,q,6.4),4.15(1H,m,),2.65(1H,m),1.68(3H,d,7.2),1.16(3H,d,6.8),1.11(3H,d,6.8);13C NMR(100MHz,Pyr-d5)δC:169.7(C),167.8(C),60.9(CH),51.1(CH),32.1(CH),21.0(CH3),19.1(CH3),17.0(CH3)。
化合物8:白色粉末,茚三酮显色阴性。分子式 C5H8N2O2。ESI-MSm/z:127 [M-H]-。1H NMR(400 MHz,Pyr-d5)δH:9.27(1H,s),9.06(1H,s),4.25(1H,q,6.8,),4.24(2H,br s),1.62(3H,d,7.8)。13C NMR(100 MHz,Pyr-d5)δC:170.8(C),168.1(C),51.9(CH),46.7(CH2),20.3(CH3)。
2 结果与讨论
化合物1淡黄色粉末,φ=10%香草醛显色剂显紫红色。1H NMR 中 δH9.03(1H,br s)和 8.91(1H,br s)为氨基上的活泼氢信号,同时13C NMR谱中δC169.8(s),168.9(s)为两个酰胺羰基碳信号,δH4.66(1H,m)和4.18(1H,m)为氮杂环中叔碳上的质子信号,推测1可能为环二肽类化合物。其中 δH11.79(1H,br s)、8.45(1H,d,8.0)、7.53(1H,d,8.0)、7.45(1H,s)、7.23(1H,q,8.0)、7.20(1H,q,7.2)、δH4.66(1H,m)及3.69(2H,m)推断结构中有色氨酸片段,结合 δH4.18(1H,m)及1.17(3H,d,6.8)推断可能有丙氨酸片段。将化合物1的NMR数据与文献 [10-11]环 (色-丙)二肽对照,基本一致,确定1为环 (色-丙)二肽 (cyclo(Trp-Ala))。
化合物2白色粉末,碘熏显色。1H NMR中:δH9.26(1H,s)和8.97(1H,s)为2个氨基上的氢信号;同时13C NMR 中 δC168.5(s),166.7(s)为两个酰胺羰基碳信号,说明该化合物可能是一个环二肽类物质。δH7.38(2H,d,8.4)和 7.08(2H,d,8.4)为典型对位取代芳环上的质子信号,以及 δC157.9(s)、131.9(d)、126.6(s)、116.0(d)信号与酪氨酸的碳信号接近,同时δH3.44(1H,dd,16.2,5.6)和 3.24(1H,dd,13.5,4.2)为1个亚甲基上的2个质子信号,且这2个质子信号化学环境不同,结合δH4.57(1H,m)及δC57.3(d)、44.8(d),可推断该化合物含酪氨酸残基。δH3.93(1H,dd,16.8,3.2)、3.53(1H,d,16.8)和 δC166.7(s)、39.8(t)提示该化合物含甘氨酸残基,由于有芳环支链的环二肽可能存在折叠构象[12],折叠构象使甘氨酸片段的亚甲基质子受苯环的屏蔽影响,化学位移向高场偏移。将化合物2的NMR数据与文献 [13]环 (甘-酪)二肽对照,基本一致,确定2为环 (甘-酪)二肽 (cyclo(Gly-Tyr))。
化合物3,白色粉末,碘熏显色。1H NMR谱中:δH9.10(1H,s)和9.07(1H,s)为2个氨基上的氢信号;同时13C NMR谱中 δC169.8(s),168.8(s)为两个酰胺羰基碳信号,说明为环二肽类物质。δH7.40(2H,d,8.4)和7.10(2H,d,8.4)为典型对位取代芳环上的质子信号,以及δC154.5(s)、132.8(s)、129.3(s)、115.6(s)信号与酪氨酸的碳信号接近,同时δH3.51(1H,dd,16.0,5.2)和3.30(1H,dd,13.4,4.2)为1个亚甲基上的2个质子信号,且这2个质子信号化学环境不同,结合 δH4.60(1H,m)及 δC60.3(d)、37.4(d),可推断该化合物含苯丙氨酸残基。δH4.20(1H,m)和 1.30(3 H,d,7.2)及δC54.7(d)、20.3(q,C -3)暗示结构中存在丙氨酸残基。将其 NMR数据与文献 [14-15]环(丙-酪)二肽对照,基本一致,确定3为环 (丙-酪)二肽 (cyclo(Ala-Tyr))。
化合物4,白色粉末,易溶于甲醇。1H NMR中:δH9.05(1H,s)和9.01(1H,s)为2个氨基上的氢信号;同时13C NMR中δC169.1(s),168.9(s)为两个酰胺羰基碳信号,说明其为环二肽类物质。δH7.38(2H,d,8.04)和 7.10(2H,d,8.2)为典型对位取代芳环上的质子信号,以及δC158.9(s)、132.7(d)、128.5(s)、117.2(d)信号与酪氨酸残基信号相似,同时δH3.49(1H,dd,16.2,5.4)和 3.37(1H,dd,13.4,4.2)为 1 个亚甲基上的2个质子信号,且此二质子信号化学环境不同,结合 δH4.60(1H,m)及 δC58.3(d)、41.3(d),可推断该化合物含苯丙氨酸残基。δH2.42(1H,m)、1.12(3H,d,7.2)、0.97(3H,d,6.8)显示结构中含异丙基片段,结合δH4.07(1H,m)说明结构中含缬氨酸残基。将其NMR数据与文献 [16-17]环 (缬-酪)二肽对照,基本一致,确定4为环 (缬-酪)二肽(cyclo(Val-Tyr))。
化合物5,白色粉末,碘熏显色。1H NMR中:δH9.29(1H,s)和9.01(1H,s)为2个氨基上氢信号,13C NMR 中 δC168.4(s),166.7(s)为两个酰胺羰基碳信号,说明该化合物亦为环二肽类化合物。δH7.24 ~ 7.45(2H,m),7.26 ~ 7.19(3H,m)为典型单取代芳环上的质子信号,同时δC168.4(s),136.9(s),130.7(d,2C),128.7(d,2C),127.2(d)碳信号与苯丙氨酸的碳信号接近,δH3.45(1H,dd,13.2,5.6)及3.29(1H,dd,13.2,4.4)为1个亚甲基上的2个质子信号,且这2个质子信号化学环境不同,结合 δH4.59(1H,m)及δC57.3(d),40.8(t)可推断化合物含苯丙氨酸残基;δH3.96(1H,dd,17.2,3.2)、3.50(1H,d,17.2)和 δC166.7(s),45.0(d),提示该化合物含甘氨酸残基。将化合物5的NMR数据与文献 [18-19]环 (甘-苯丙)对照,基本一致,确定5为环 (甘 -苯丙)二肽 (cyclo(Gly-Phe))。
化合物6,无色透明方型结晶,θmp205~208℃。茚三酮试剂不显色,高锰酸钾试剂显亮黄色斑点。ESI-MSm/z153 [M-H]-提示相对分子质量为154。1HNMR 谱中:δH9.12(1H,brs)为甘氨酸活泼氨基氢信号 (N-H),δH3.60(1H,dt,8.2,3.2,11.2)、3.45(1H,td,10.0,3.2)、2.26(m,1H)、2.09(1H,m)、1.68(1H,m)、1.62(1H,m)和 δC171.3(s)、60.2(d)、46.6(t)、30.1(t)、23.9(t)为脯氨酸残基信号,δH4.09(1H,td,16.0,4.4)和4.17(2H,br t,16.2)及δC165.6(s)和48.2(t)暗示结构中有甘氨酸片断。将化合物6的NMR数据与文献环 (甘-脯)二肽对照[19-21],基本一致,确定 6为环 (甘 -脯)二肽 (cyclo(Gly-Pro))。
化合物7,白色粉末,香草醛浓硫酸不显色,茚三酮显色阴性。1H NMR中 δH9.18(1H,s)和8.90(1H,s)为两个氨基活波氢信号,δH2.65(1H,m)、1.16(3H,d,6.80)、1.11(3H,d,6.80)显示结构中含异丙基片段,结合 δH4.15(1H,dd,6.80,13.50)说明结构中含缬氨酸残基。δH4.34(1H,q,6.4)和 1.68(3H,d,7.2)显示结构中含丙氨酸残基。将化合物7的NMR数据与文献 [19,22-23]环 (丙-缬)二肽对照,基本一致,确定7为环 (丙 -缬)二肽 (cyclo(Ala-Val))。
化合物8,白色粉末,茚三酮显色阴性,薄层原位酸水解后茚三酮显色阳性,提示为环肽类成分。ESI-MSm/z127[M-H]-提示相对分子质量为128。1H NMR δH9.27(1H,s),9.06(1H,s)说明存在活波的氨基质子信息;δH4.00(1H,q,6.8)和1.62(3 H,d,6.6)及 δC51.93(d)、20.26(q)暗示结构中存在丙氨酸残基。δH3.91(2H,br s)和13C NMR中δC46.7(t)暗示存在甘氨酸残基。将其NMR数据与文献 [24-25]环 (甘 -丙)二肽对照,基本一致,确定8为环 (甘-丙)二肽 (cyclo(Gly-Ala))。
致谢:感谢广州中医药大学中药学院2009级本科生蔡剑雄、梁敏、李玉婷、张海霞、曾婷在微生物实验中的帮助;感谢中山大学分析测试中心关山越老师的测试支持。
[1]MAYER A M S,RODRÍGUEZ A D,BERLINCK R G S,et al.Marine pharmacology in 2007 - 8:Marine compounds with antibacterial,anticoagulant,antifungal,antiinflammatory,antimalarial,antiprotozoal,antituberculosis,and antiviral activities;affecting the immune and nervous system,and other miscellaneous mechanisms of action[J].Comparative Biochemistry and Physiology Part C:Toxicology& Pharmacology,2011,153(2):191-222.
[2]MAYER A M S,RODRÍGUEZ A D,BERLINCK R G S,et al.Marine pharmacology in 2005 - 6:Marine compounds with anthelmintic,antibacterial,anticoagulant,antifungal,anti-inflammatory,antimalarial,antiprotozo-al,antituberculosis,and antiviral activities;affecting the cardiovascular,immune and nervous systems,and other miscellaneous mechanisms of action[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2009,1790(5):283-307.
[3]MAYER A M S,GUSTAFSON K R.Marine pharmacology in 2005 - 6:Anti-tumour and cytotoxic compounds[J].European J Cancer,2008,44:2357 -2387.
[4]MAYER A M S,GUSTAFSON K R.Marine Pharmacology in 2003 - 4:Antitumor and Cytotoxic Compounds[J].European J Cancer,2006,42(14):2241 -2270.
[5]BLUT J W,COPP B R,KEYZERS R A,et al.Marine natural products[J].Nat Prod Rep,2013,30:237 -323.
[6]BLUT J W,COPP B R,KEYZERS R A,et al.Marine natural products[J].Nat Prod Rep,2012,29:144 -222.
[7]BLUT J W,COPP B R,MUNRO M H G,et al.Marine natural products[J].Nat Prod Rep,2011,28:196 -289.
[8]BLUT J W,COPP B R,MUNRO M H G,et al.marine natural products[J].Nat Prod Rep,2010,27:165 -237.
[9]杨子娟,向兰,邢杰,等.环二肽的研究进展[J].现代药物与临床,2009,24(2):73-81.
[10]孟旭鹏,田黎,林文瀚,等.海洋细菌Roseobactersp.发酵液中化学成分的研究[J].中国海洋药物杂志,2009,28(2):6-10.
[11]SIEMION Z IGNACY,KONOPINSKA D.Folded conformation in the ground and excited states of cyclicdipeptides containing at ryptophyl residue[J].Roczniki Chemii,1975,49(4):781.
[12]KENNETHD D K,DAVID H M.Conformations of cyclic peptides.the folding of cyclic dipeptides containing an aromatic sidechain[J].J.Am Chem Soc,1967,89(24):6193- 6200.
[13]MITOVA M,TOMMONARO G,HENTSCHEL U,et al.Exocellular cyclic dipeptides from a ruegeria strain associated with cell cultures ofSuberites domuncula[J].Mar Biotechnol,2004,6(1):95 -103.
[14]XING J,YANG Z J,LÜ B B,et al.Rapid screening for cyclo-dopa and diket opiperazine alkaloids in crude extracts ofPortulaca oleraceaL.using liquid chromatography/tandem mass spectrometry[J].Rapid Commu Mass Spectrom,2008,22(9):1415-1422.
[15]李厚金,林永成,刘晓红,等.红树林内源真菌2524号的肽类成分[J].中山大学学报:自然科学版,2002,41(1):110-112.
[16]胡永美,汪豪,叶文才,等.繁缕中的水溶性化学成分[J].中国药科大学学报,2005,36(6):523-525.
[17]朱峰,林永成,周世宁,等.南海红树林内源真菌2534号代谢产物的研究[J].中山大学学报:自然科学版,2003,42(1):52-54.
[18]吴雄宇,林永成,冯爽,等.南海红树林内生真菌1356#代谢产物的研究[J].热带海洋学报,2001,20(4):80- 85.
[19]王彧博,郑立,李文,等.海洋细菌NJ6-3-1次级代谢产物化学成分的分离与鉴定[J].沈阳药科大学学报,2010,27(5):345-349.
[20]赵文英,朱庆书,顾谦群.海洋来源真菌烟曲霉(Aspergillus fumigatus)次级代谢产物研究(Ⅱ)[J].青岛科技大学学报:自然科学版,2007,28(5):390-393.
[21]GAO H,HONG K,ZHANG X,et al.New sterylesters of fatty acids from the mangrove fungusAspergillus awamori[J].Helv Chim Acta,2007,90(6):1165 -1178.
[22]ZHAO W Y,ZHU T J,FAN G T,et al.Three new dioxopierazine metabolites from a marine-derived fungus,Aspergillus fumigatusFres[J].Nat Prod Res,Part A:Structure and Synthesis,2010,24(10):953 -957.
[23]尹文清,林永成,周世宁,等.南海海洋真菌2516号中的环肽成分[J].中山大学学报:自然科学版,2002,41(4):56-58.
[24]刘睿,朱天骄,朱伟明,等.海洋放线菌S1001中抗肿瘤活性成分的研究[J].中国抗生素杂志,2006,31(1):36-38.
[25]高昊,陈国栋,唐金山,等.海洋细菌Bacillussp.次生代谢产物的分离与鉴定[J].沈阳药科大学学报,2010,21(7):69-74.
