孔圣枕中丹对自发性高血压大鼠前额叶皮质及纹状体TH、DAT、DRD1、DRD2蛋白和基因表达的影响
2013-09-14陈晓刚谭丽丽赖东兰许双虹李宜瑞
陈晓刚 谭丽丽 赖东兰 许双虹 李宜瑞
1.广州中医药大学第一附属医院儿科,广东广州 510405;2.广州市第八人民医院儿科,广东广州 510060
注意缺陷多动障碍(attentiondeficithyperactivitydisorder,ADHD),是以注意力不集中、多动、冲动等为主要表现的常见儿童行为障碍,严重危害儿童的身心健康。以哌甲酯为代表的中枢兴奋剂虽是目前治疗ADHD的首选,但也存在不良反应较多、管理困难等诸多问题[1]。大量临床实践发现,中医药治疗ADHD具备独特优势[2-3]。本研究检测了孔圣枕中丹煎剂对ADHD动物模型——自发性高血压大鼠(spontaneous hypertensive rat,SHR)前额叶皮质及纹状体(含伏核)中的酪氨酸羟化酶(TH)、多巴胺转运体(DAT)、多巴胺D1受体(DRD1)、多巴胺D2受体(DRD2)的基因和蛋白表达的影响,并与盐酸哌甲酯对照,现报道如下:
1 材料与方法
1.1 实验动物
SPF级雄性8周龄的SHR大鼠36只,体重240~300 g,由四川省医学科学院四川省人民医院实验动物研究所生产供应部提供[许可证号:SCXK(111)2008-16]。
1.2 主要仪器与试剂
DAB显色试剂盒,SA1022兔IgG试剂盒,鼠IgG试剂盒,大鼠IgG试剂盒,原位杂交试剂盒(博士德生物技术有限公司);TH 抗体:兔抗(Miliproe抗体公司);DAT 抗体:大鼠抗体(abcam抗体公司);DRD1抗体:兔抗(abcam抗体公司);DRD2抗体:小鼠抗体(Santa抗体公司)。显微镜(日本OLYMPUS公司CHK2-F-GS型),离心机(上海安亭TGL-16G型),电热恒温水箱(广州东方YH140-1型)。
1.3 孔圣枕中丹煎剂的制备
孔圣枕中丹方由龙骨、龟板、远志、石菖蒲4味中药组成(比例 4∶2∶1∶2),广州中医药大学第一附属医院门诊部药房提供生药,制成水煎剂,并配成含生药约1.154 g/mL的溶液,充分搅匀,贮于4℃冰箱备用。盐酸哌甲酯(苏州医药集团有限公司)终浓度为0.24 g/L。
1.4 实验动物分组及处理
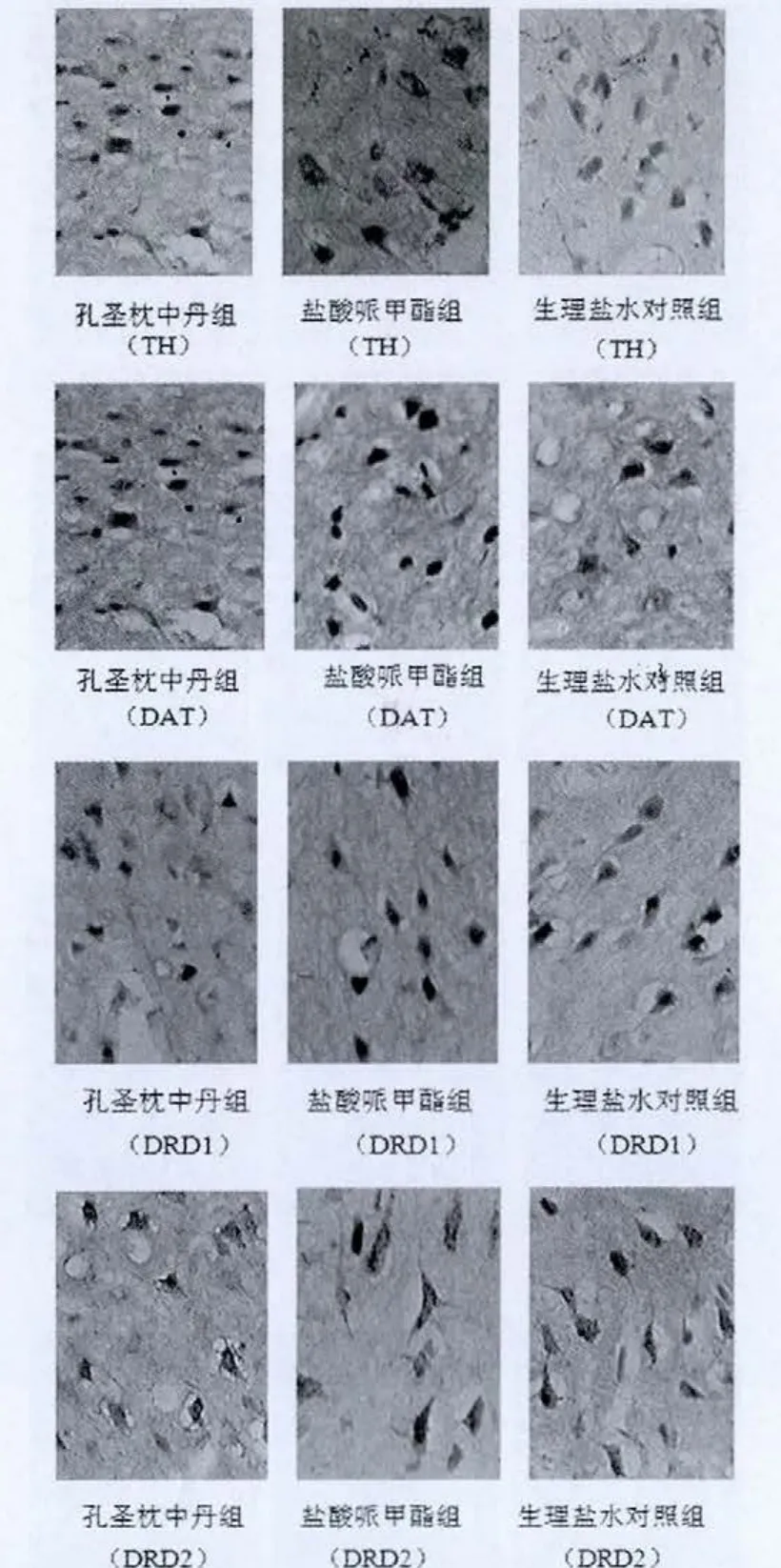
图1 免疫组化法检测三组自发性高血压大鼠前额叶皮质TH、DAT、DRD1、DRD2 的表达(ABC 法,200×)
所有大鼠随机分为三组(孔圣枕中丹组、盐酸哌甲酯组及生理盐水对照组),每组12只(其中6只用于免疫组化实验,6只用于原位杂交实验)。称重,编号,用灌胃针分别对三组大鼠进行灌胃,其中,孔圣枕中丹灌药量:7.2 g/kg;盐酸哌甲酯灌药量:1.5 mg/kg(均稀释为25 mL/kg后灌服),生理盐水对照组灌服生理盐水25 mL/kg。灌药28 d后称重,进行相应的实验处理。
1.5 取材
各组大鼠在实验第29天上午8∶00取材。以3.5%浓度的水合氯醛,麻醉处理大鼠;开胸暴露心脏,左心室心尖插入灌注针头,剪开右心耳,生理盐水快速灌注后,换4%多聚甲醛的PBS缓冲液缓慢灌注固定;取相应脑组织并放于4%多聚甲醛溶液中固定,30%蔗糖溶液脱水;冰冻切片机切片后,置于-20℃冰箱备用。
1.6 免疫组织化学法
选择冰冻切片,每组各6张,主要步骤如下:灭活内源性酶,滴加5%BSA封闭液,分别滴加一抗(250倍稀释的DRD1,50倍稀释DRD2,50倍稀释 DAT以及 500倍稀释TH抗体),37℃水浴箱孵育1 h后,滴加生物素化二抗,孵育 20 min,SABC,37℃水浴箱放置 20 min,DAB 显色,苏木素复染,脱水,二甲苯透明,封片。光镜下观察结果并拍片。免疫组化结果以单个视野下平均光密度IOD(X)表示。
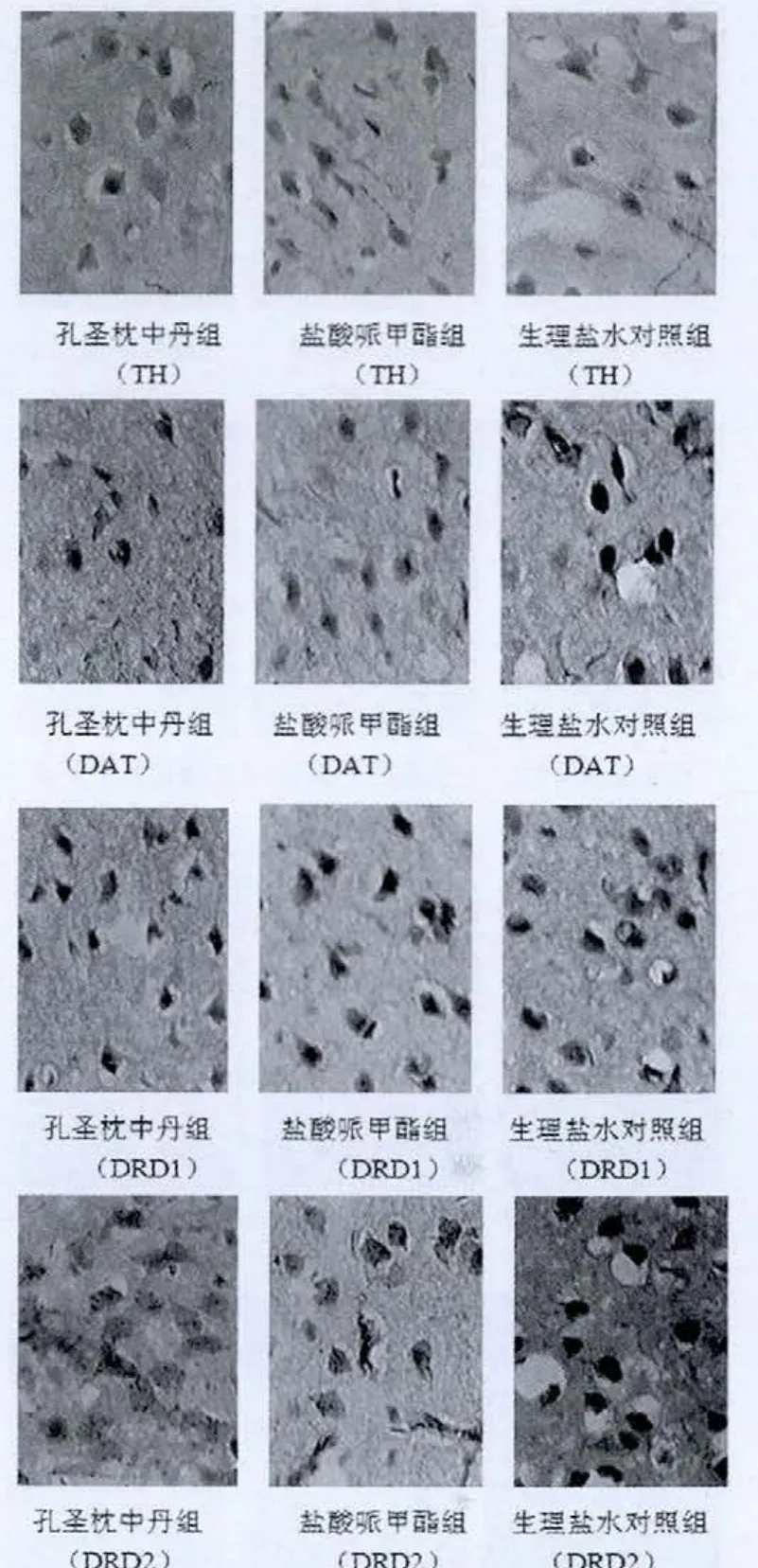
图2 免疫组化法检测三组自发性高血压大鼠纹状体TH、DAT、DRD1、DRD2 的表达(ABC 法,200×)
表1 免疫组化法检测三组自发性高血压大鼠前额叶皮质TH、DAT、DRD1、DRD2 的表达(±s,n=6)

表1 免疫组化法检测三组自发性高血压大鼠前额叶皮质TH、DAT、DRD1、DRD2 的表达(±s,n=6)
注:与生理盐水对照组比较,*P<0.05;与盐酸哌甲酯组比较,#P<0.05;TH:酪氨酸羟化酶;DAT:多巴胺转运体;DRD1:多巴胺D1受体;DRD2:多巴胺D2受体
孔圣枕中丹组盐酸哌甲酯组生理盐水对照组10.10±3.25*#7.78±2.73*4.79±2.53 9.06±1.81*#14.20±1.19*17.57±3.74组别 TH DAT 14.67±1.49*11.45±1.42*18.06±2.20 DRD1 14.83±1.84*11.01±1.03*17.83±3.36 DRD2
表2 免疫组化法检测三组自发性高血压大鼠纹状体TH、DAT、DRD1、DRD2 的表达(±s,n=6)
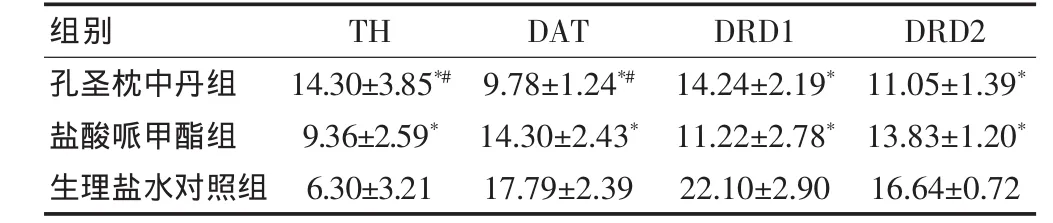
表2 免疫组化法检测三组自发性高血压大鼠纹状体TH、DAT、DRD1、DRD2 的表达(±s,n=6)
注:与生理盐水对照组比较,*P<0.05;与盐酸哌甲酯组比较,#P<0.05;TH:酪氨酸羟化酶;DAT:多巴胺转运体;DRD1:多巴胺D1受体;DRD2:多巴胺D2受体
孔圣枕中丹组盐酸哌甲酯组生理盐水对照组14.30±3.85*#9.36±2.59*6.30±3.21 9.78±1.24*#14.30±2.43*17.79±2.39组别 TH DAT 14.24±2.19*11.22±2.78*22.10±2.90 DRD1 11.05±1.39*13.83±1.20*16.64±0.72 DRD2

图3 原位杂交法检测3组自发性高血压大鼠前额叶皮质TH、DAT、DRD1、DRD2 的表达(ABC 法,×200)
1.7 原位杂交法
选择冰冻切片,每组各6张,主要步骤如下:30%H2O2和纯甲醇混合液(1︰50,含 0.1%DEPC),室温固定 30 min;胃蛋白酶消化,暴露mRNA核酸片段,后固定,预杂交,杂交,杂交后洗涤,滴加封闭液,滴加生物素化鼠抗地高辛标记,SABC,DAB显色,苏木素轻度复染、饱和,酒精脱水,二甲苯透明,封片。光镜下观察结果并拍片。原位杂交结果以单个视野下平均光密度IOD(X)表示。
1.8 统计学方法
采用SSPS 18.0统计软件进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化法检测结果
免疫组化法检测三组SHR大鼠前额叶皮质及纹状体TH、DAT、DRD1、DRD2 的表达(图1、2),采用 Imaga-Pro-Plus 6.0软件分析,结果以单个视野下平均光密度IOD(X)来表示(表1、2)。
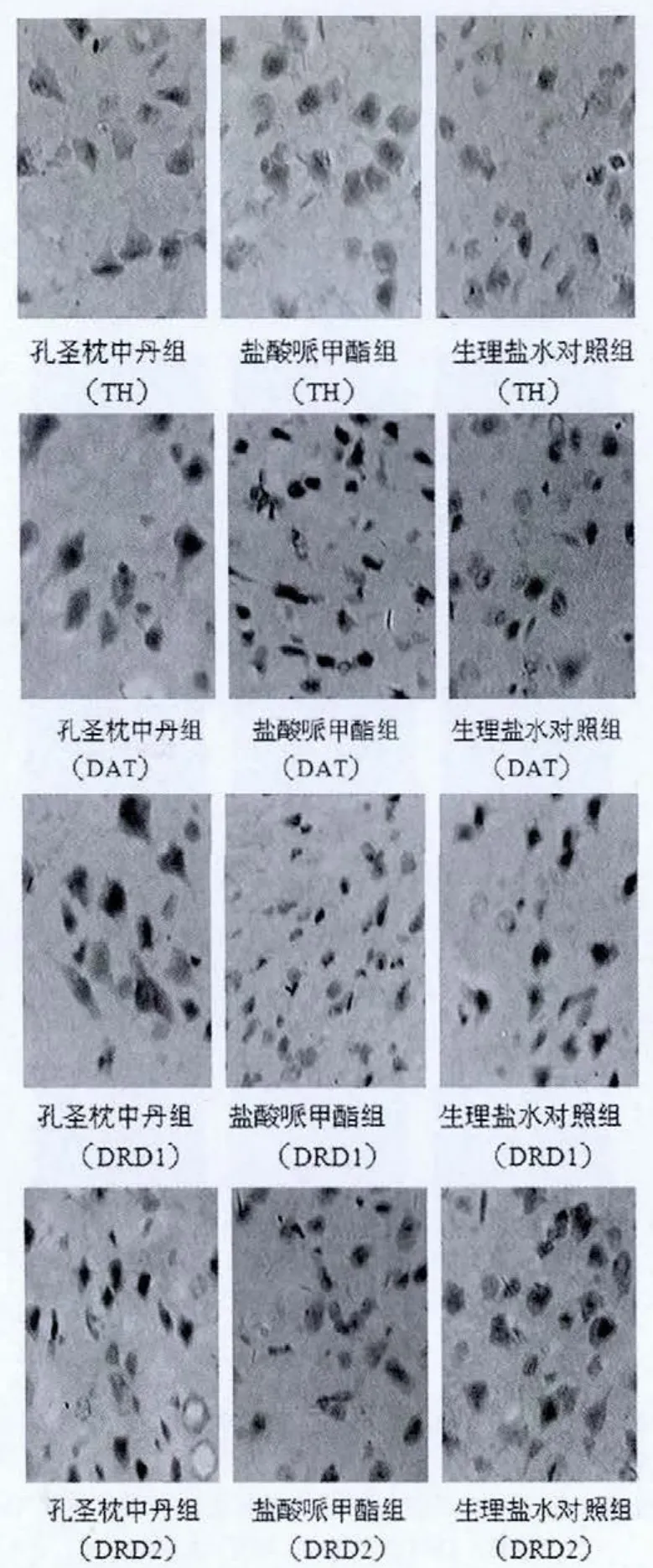
图4 原位杂交法检测3组自发性高血压大鼠纹状体TH、DAT、DRD1、DRD2 的表达(ABC 法,×200)
结果表明:在SHR大鼠的前额叶皮质及纹状体,TH的蛋白表达,孔圣枕中丹组高于盐酸哌甲酯组,盐酸哌甲酯组又高于生理盐水对照组;DAT的蛋白表达,孔圣枕中丹组低于盐酸哌甲酯组,盐酸哌甲酯组又低于生理盐水对照组;DRD1和DRD2的蛋白表达,孔圣枕中丹组和盐酸哌甲酯组均低于生理盐水对照组。
2.2 原位杂交法检测结果
原位杂交法检测三组SHR大鼠前额叶皮质及纹状体TH、DAT、DRD1、DRD2 的表达(图3、4),采用 Imaga-Pro-Plus 6.0软件分析,结果以单个视野下平均光密度IOD(X)来表示(表3、4)。
与免疫组化实验相似:在SHR大鼠的前额叶皮质及纹状体,TH的基因表达,孔圣枕中丹组高于盐酸哌甲酯组,盐酸哌甲酯组又高于生理盐水对照组;DAT的基因表达,孔圣枕中丹组低于盐酸哌甲酯组,盐酸哌甲酯组又低于生理盐水对照组;DRD1和DRD2的基因表达,孔圣枕中丹组和盐酸哌甲酯组均低于生理盐水对照组。
表3 原位杂交法检测三组自发性高血压大鼠前额叶皮质TH、DAT、DRD1、DRD2 的表达(±s,n=6)
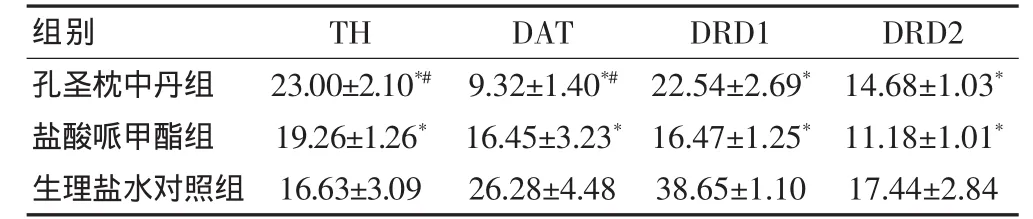
表3 原位杂交法检测三组自发性高血压大鼠前额叶皮质TH、DAT、DRD1、DRD2 的表达(±s,n=6)
注:与生理盐水对照组比较,*P<0.05;与盐酸哌甲酯组比较,#P<0.05;TH:酪氨酸羟化酶;DAT:多巴胺转运体;DRD1:多巴胺D1受体;DRD2:多巴胺D2受体
孔圣枕中丹组盐酸哌甲酯组生理盐水对照组23.00±2.10*#19.26±1.26*16.63±3.09 9.32±1.40*#16.45±3.23*26.28±4.48组别 TH DAT 22.54±2.69*16.47±1.25*38.65±1.10 DRD1 14.68±1.03*11.18±1.01*17.44±2.84 DRD2
表4 原位杂交法检测3组自发性高血压大鼠纹状体TH、DAT、DRD1、DRD2 的表达(±s,n=6)
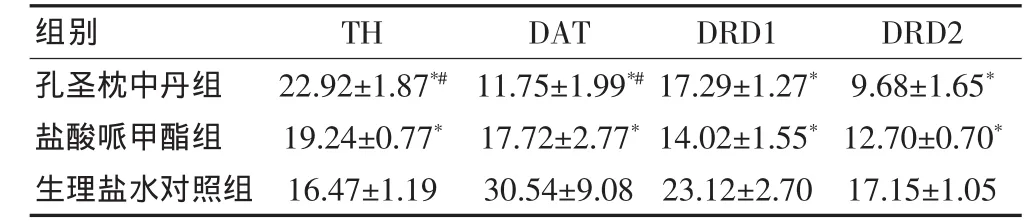
表4 原位杂交法检测3组自发性高血压大鼠纹状体TH、DAT、DRD1、DRD2 的表达(±s,n=6)
注:与生理盐水对照组比较,*P<0.05;与盐酸哌甲酯组比较,#P<0.05;TH:酪氨酸羟化酶;DAT:多巴胺转运体;DRD1:多巴胺D1受体;DRD2:多巴胺D2受体
孔圣枕中丹组盐酸哌甲酯组生理盐水对照组22.92±1.87*#19.24±0.77*16.47±1.19 11.75±1.99*#17.72±2.77*30.54±9.08组别 TH DAT 17.29±1.27*14.02±1.55*23.12±2.70 DRD1 9.68±1.65*12.70±0.70*17.15±1.05 DRD2
3 讨论
迄今为止,脑内多巴胺(DA)功能缺陷是注意缺陷多动障碍(ADHD)发病机制中最有力假说[4],其中DA对前额叶皮质-纹状体环路的调控尤为重要,这已得到分子遗传学和功能脑成像技术等研究结果的证实[5-6];神经药理的研究也发现,中枢兴奋剂能阻滞突触前膜上DAT对DA的重摄取作用,从而提高突触间隙中的DA浓度,并可能促进突触前的DA释放[7]。
自20世纪80年代以来,国内中医药界的学者开始应用中医药治疗ADHD。多家报道都肯定了中医药治疗ADHD的功效。大多数学者认为ADHD的病机特点是阳动有余而阴静不足,其中肾阴不足,肝阳偏旺为本病最常见证型[8]。既往的文献研究结果提示,由唐代著名医家孙思邈所创制的孔圣枕中丹是治疗ADHD的基本方剂之一,该方由龟板、龙骨、石菖蒲、远志四味药组成,方中龟板、龙骨补肾镇肝、潜阳安神,远志交通心肾、强志聪明,石菖蒲散肝舒脾、开窍宁神,诸药合用,肾阴既补,肝阳得潜,心神安宁,阴阳平和。各地学者的临床研究都充分肯定了其疗效[9]。
本项研究结果发现,在灌服孔圣枕中丹煎液后,SHR大鼠前额叶皮质和纹状体(含伏核)中DAT的蛋白表达和基因表达均降低,说明孔圣枕中丹下调了脑内DAT的表达,这可能意味着减少了突触前膜对DA的重摄取作用,从而增加突触间隙中的DA浓度。另一方面,SHR大鼠在灌服孔圣枕中丹煎液后,其前额叶皮质和纹状体(含伏核)中的TH蛋白和基因表达上调,鉴于TH是合成包括DA在内的儿茶酚胺(CA)的限速酶,提示孔圣枕中丹可能也促进了脑内的DA合成。这些都有利于改善脑内DA的信号传导。
研究结果还发现,孔圣枕中丹下调了SHR大鼠前额叶皮质和纹状体中DRD1的蛋白和基因表达。既往研究发现,实验大鼠在前额叶皮质定位注入DA的D1受体激动剂Bromocriptine后,其注意缺陷得到显著改善;相反,注入D1受体拮抗药SCH23390则出现障碍[10]。有趣的是,激动DRD1改善注意缺陷的效应呈倒“U”型,提示只有适宜水平的刺激效应最大,过高或过低反而加重注意缺陷;哌甲酯被发现能下调突触后DRD1水平,使DA对DRD1的刺激处于合适水平[11]。所以,笔者推测,孔圣枕中丹下调DRD1可能主要是其提高了突触间隙DA含量后的负反馈作用结果。此外,SHR大鼠在灌服孔圣枕中丹煎液后,前额叶皮质和纹状体中DRD2含量也下降。迄今为止,DRD2在ADHD发病中的作用尚不清楚,但有分子遗传学上的研究结果提示其与ADHD的相关性[12]。不过本研究初步认为,孔圣枕中丹下调DRD2的作用可能与对DRD1的作用类似,也是提高突触间隙DA含量的负反馈调节所致,这需要进一步的实验证实。
[1]Antshel KM,Hargrave TM,Simonescu M,et al.Advances in understanding and treating ADHD[J].BMC Med,2011,9:72.
[2]陈晓刚,谭丽丽,许双虹,等.益智宁治疗儿童注意缺陷多动障碍远期疗效观察[J].新中医,2012,44(7):104-105.
[3]张弛,班慧慧,琚伟.中西医治疗ADHD研究进展[J].河南中医,2013,33(4):628-632.
[4]Wu J,Xiao H,Sun H,et al.Role of dopamine receptors in ADHD:a systematic meta-analysis[J].Mol Neurobiol,2012,45(3):605-620.
[5]Elia J,Sackett J,Turner T,et al.Attention-deficit/hyperactivity disorder genomics:update for clinicians[J].Curr Psychiatry Rep,2012,14(5):579-589.
[6]Zimmer L.Positron emission tomography neuroimaging for a better understanding of the biology of ADHD[J].Neuropharmacology,2009,57(7-8):601-607.
[7]Dopheide JA,Pliszka SR.Attention-deficit-hyperactivity disorder:an update[J].Pharmacotherapy,2009,29(6):656-679.
[8]冷方南,凌耀星,彭国忱,等.儿童多动症临床治疗学(修订版)[M].北京:人民军医出版社,2010:277.
[9]唐彦.中药复方治疗儿童多动症的用药规律研究[J].河北中医,2009,31(5):769-770.
[10]Granon S,Passetti F,Thomas KL,et al.Enhanced and impaired attentional performance after infusion of D1 dopaminergic receptor agents into rat prefrontal cortex[J].J Neurosci,2000,20(3):1208-1215.
[11]Vijayraghavan S,Wang M,Birnbaum SG,et al.Inverted-U dopamine D1 receptor actions on prefrontal neurons engaged in working memory[J].Nat Neurosci,2007,10(3):376-384.
[12]Paclt I,Drtilkova I,Kopeckova M,et al.The association between TaqI A polymorphism of ANKK1(DRD2)gene and ADHD in the Czech boys aged between 6 and 13 years[J].Neuro Endocrinol Lett,2010,31(1):131-136.
