脂多糖诱导膀胱癌细胞释放HMGB1及其机制研究
2013-09-14陈国千
陈 文 李 蕾 陈国千
南京医科大学附属无锡市人民医院检验科,江苏无锡 214023
膀胱癌是我国泌尿系统最常见的恶性肿瘤,其绝大多数为移行细胞癌。膀胱癌目前以手术治疗为主,但五年生存率低。慢性感染和炎症被认为是肿瘤发生、发展极为重要的原因之一。高迁移率族蛋白B1(HMGB1)作为一种核内DNA结合蛋白,可以分泌到胞外并介导炎性反应,是一种重要的晚期促炎症因子[1]。研究显示,HMGB1的高表达与肿瘤细胞增殖、浸润、转移以及患者预后等关系密切[2]。最近研究表明,HMGB1在膀胱癌组织中高表达,且与肿瘤的分级、分期及患者预后相关[3-4]。脂多糖(LPS)可以诱导单核细胞、巨噬细胞等主动释放HMGB1到胞外[5-6]。LPS对膀胱癌细胞诱导HMGB1释放作用尚未见研究报道,本研究旨在观察LPS对膀胱癌细胞释放HMGB1的影响,并探讨其相关信号通路机制,为阐明疾病治疗新途径提供依据。
1 材料与方法
1.1 材料
人膀胱移行细胞癌细胞株T24购自中国科学院细胞库;RPMI-1640培养液、OPTI-MEM I培养液购自美国Gibco公司;LPS、LY294002 购自美国 Sigma公司,HMGB1 ELISA试剂盒购自日本Shino-Test公司;Trizol、 逆转录试剂盒及实时荧光定量PCR试剂盒购自日本TaKaRa公司。HMGB1、GAPDH引物由日本TaKaRa公司合成。
1.2 细胞培养
使用含 10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素、2 mmol/L谷氨酰胺的RPMI-1640培养液,将人膀胱癌细胞株T24置于5%CO2培养箱中培养,至细胞达到对数生长期时,换用无血清OPTI-MEM I培养液。首先经预实验筛选出LPS的合适浓度和LY294002的不同浓度及检测培养上清液中HMGB1含量的最佳时间。选择100 μg/L LPS为作用浓度。只加OPTI-MEM I培养液组为对照组,加含100 μg/L LPS培养液组为LPS诱导组,并于LPS诱导6、12、18、24 h检测培养上清液中HMGB1浓度和细胞HMGB1 mRNA表达水平。加100 μg/L LPS及不同浓度LY294002组为LY294002干预组,LY294002预处理时于100 μg/L LPS诱导前1 h加入培养细胞,干预24 h后,收集细胞培养液,然后离心取上清液检测HMGB1含量。每组实验均重复3次。
1.3 HMGB1浓度测定
采用酶联免疫吸附试验(ELISA)检测细胞培养上清液中HMGB1浓度。按试剂盒说明书进行实验。
1.4 HMGB1 mRNA测定
根据Trizol试剂盒说明书提取细胞总RNA,用紫外分光光度计测定其浓度和纯度。按照逆转录试剂盒说明书逆转录成cDNA,以cDNA为模板进行PCR扩增。HMGB1上游引物:TTGTCGGGAGGAGCATAA,下游引物:GGGCGATACTCAGAGCAGAA,扩增产物长度为267 bp。内参为3-磷酸甘油醛脱氢酶 (GAPDH),上游引物:AACGGATTTGGTCGTATTG,下游引物:GGAAGATGGTGATGGGATT,扩增产物长度为208 bp。PCR循环参数为95℃预变性30 s,95℃变性5 s,60℃退火/延伸20 s,循环40次。以目的基因HMGB1和内参GAPDH的Ct值之差(△Ct)作为评价目的基因mRNA相对表达水平的指标。目的基因mRNA的相对量按公式:目的基因=2-△△Ct计算。
1.5 统计学方法
采用统计软件SPSS 18.0对实验数据进行分析,计量资料数据以均数±标准差(±s)表示,组间比较采用双侧t检验分析。以P<0.05为差异有统计学意义。
2 结果
2.1 LPS对膀胱癌细胞HMGB1释放的影响
膀胱癌细胞T24经100 μg/L LPS诱导12、18、24 h后,培养上清液中HMGB1含量均高于各自对照组(P<0.05或 P<0.01),分别为对照组的 1.9、3.5、4.2 倍,见表1。
表1 不同细胞培养时间下脂多糖对膀胱癌细胞培养上清液中HMGB1 含量的影响(μg/L,±s,n=3)
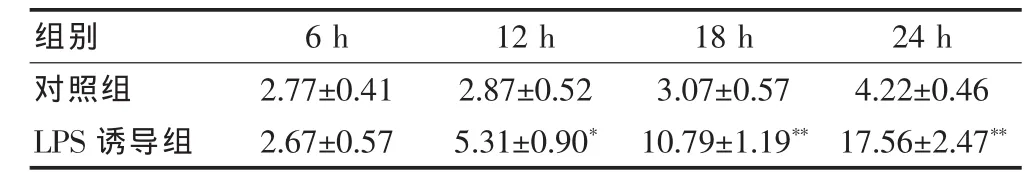
表1 不同细胞培养时间下脂多糖对膀胱癌细胞培养上清液中HMGB1 含量的影响(μg/L,±s,n=3)
注:与对照组比较,*P<0.05,**P<0.01
对照组LPS诱导组2.77±0.41 2.67±0.57 2.87±0.52 5.31±0.90*组别 6 h 12 h 3.07±0.57 10.79±1.19**4.22±0.46 17.56±2.47**18 h 24 h
2.2 LPS对膀胱癌细胞HMGB1 mRNA表达的影响
膀胱癌细胞 T24 经 100 μg/L LPS 诱导 12、18、24 h后,细胞HMGB1 mRNA表达水平均高于各自对照组(P<0.05或 P<0.01),分别为对照组的 2.2、2.3、3.2倍。见表2。
2.3 PI3K/AKT信号通路抑制剂对LPS诱导膀胱癌细胞HMGB1释放的抑制作用
PI3K/AKT信号通路抑制剂20、40μmol/L LY294002对LPS诱导24 h的膀胱癌细胞T24释放HMGB1均显示明显的抑制作用(P<0.01)。40 μmol/L 的 LY294002抑制作用强于 20 μmol/L(P<0.05)。10 μmol/L的LY294002对LPS诱导的膀胱癌细胞释放HMGB1未起抑制作用(P>0.05)。见图1。
表2 不同细胞培养时间下脂多糖对膀胱癌细胞高迁移率族蛋白B1 mRNA 表达的影响(△Ct,±s,n=3)

表2 不同细胞培养时间下脂多糖对膀胱癌细胞高迁移率族蛋白B1 mRNA 表达的影响(△Ct,±s,n=3)
注:与对照组比较,*P<0.05,**P<0.01
对照组LPS诱导组4.29±0.56 3.97±0.49 4.56±0.57 3.41±0.37*组别 6 h 12 h 4.28±0.46 3.08±0.32*4.30±0.45 2.60±0.35**18 h 24 h
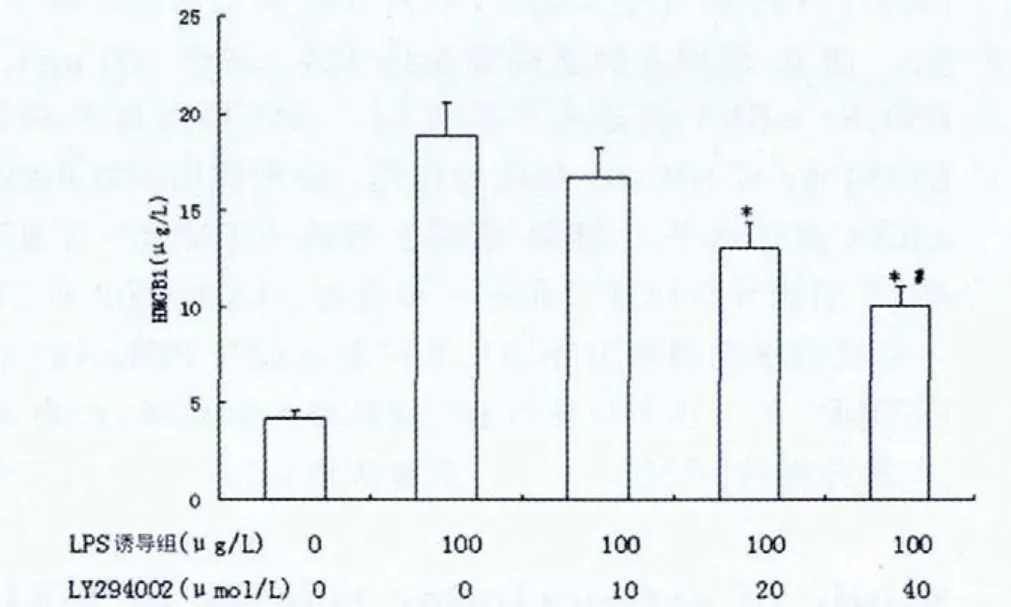
图1 磷脂酰肌醇3-激酶/蛋白激酶B信号通路抑制剂对脂多糖诱导膀胱癌细胞释放HMGB1的影响(n=3)
3 讨论
HMGB1是普遍存在于真核细胞核内重要的非组蛋白染色体结合蛋白,因其在聚丙烯酰胺凝胶电泳中迁移速度快而被命名。HMGB1过去被认为是染色质的结构成分,功能局限在核内,主要参与稳定核小体结构、促进基因转录、参与DNA复制及调节类固醇激素等活动。1999年,Wang等[1]首次发现HMGB1可以介导炎性反应,是一种重要的晚期炎症介质。
HMGB1可以在细胞因子如白细胞介素-1(IL-1)、肿瘤坏死因子-α(TNF-α)、LPS等因素刺激下,由单核细胞、巨噬细胞等主动分泌;也可由坏死细胞或受损细胞被动释放。HMGB1参与许多疾病的病理过程,如脓毒症、肿瘤等[2,7]。研究表明,HMGB1在肝癌、结肠癌、肺癌等人类恶性肿瘤中呈高表达,并与肿瘤的进展及患者预后等相关[2]。HMGB1在膀胱癌中的研究极少,最新研究发现,HMGB1在膀胱癌组织中高表达,且与肿瘤的分级、分期及患者预后有关[3]。但HMGB1在膀胱癌中的具体分子作用机制尚未见研究报道。
本研究以LPS作为刺激因素,探讨其对膀胱癌细胞T24 HMGB1释放的影响。应用台盼蓝染色法检测到100 μg/L LPS诱导24 h后,各组膀胱癌细胞存活率均在95%以上,因而排除了细胞通过坏死损伤发生的HMGBl被动释放。本研究显示,膀胱癌细胞经缺氧诱导12 h后,培养上清液中HMGB1蛋白含量较常氧对照组升高,并呈时间依赖性,24 h达到峰值。本研究亦测定了细胞HMGB1基因表达水平,实验结果显示,LPS诱导12 h时细胞HMGB1基因水平已显示增高,提示LPS诱导的HMGB1释放增加受转录水平调控。
磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/AKT)通路作为细胞内重要的信号转导通路之一,在细胞的生长、存活、增殖、凋亡、血管生成、自吞噬等过程中发挥着极其重要的生物学功能[8-11]。有研究显示,PI3K/AKT通路活性改变与肿瘤的发生和发展密切相关。本研究应用PI3K特异性抑制剂LY294002进行细胞实验,结果显示干预LY294002对LPS诱导24 h的膀胱癌细胞释放HMGB1具有抑制作用。40 μmol/L 的 LY294002抑制作用强于 20 μmol/L。10 μmol/L的LY294002对LPS诱导的膀胱癌细胞释放HMGB1没有影响。提示胞内PI3K/AKT信号通路参与LPS诱导膀胱癌细胞HMGB1的释放,可为膀胱癌的临床治疗提供新的靶点和策略,为抗肿瘤药物的开发提供新的研究方向。HMGB1介导炎性反应还可能涉及其他途径及细胞因子的作用,Chen等[5]研究表明,LPS诱导的巨噬细胞HMGB1释放与CD14、TNF依赖途径有关;杨岚等[12]报道LPS诱导肥大细胞HMGB1释放涉及MAPK通路。LPS诱导的膀胱癌细胞HMGB1释放是否还涉及其他信号通路有待深入研究。
[1]Wang H,Bloom O,Zhang M,et al.HMG-1 as a late mediator of endotoxin lethality in mice[J].Science, 1999,285(5425):248-251.
[2]Ellerman JE,Brown CK,de Vera M,et al.Masquerader: high mobility group box-1 and cancer[J].Clin Cancer Res,2007,13(10):2836-2848.
[3]Yang GL,Zhang LH,Bo JJ,et al.Increased expression of HMGB1 is associated with poor prognosis in human bladder cancer[J].J Surg Oncol,2012,106(1):57-61.
[4]Wang W,Jiang H,Zhu H,et al.Overexpression of high mobility group box 1 and 2 is associated with the progression and angiogenesis of human bladder carcinoma[J].Oncol Lett,2013,5(3):884-888.
[5]ChenG,LiJ,OchaniM,etal.Bacterial endotoxin stimulates macrophages to release HMGB1 partly through CD14-and TNF-dependent mechanisms[J].J Leukoc Biol,2004,76(5):994-1001.
[6]Kim JH,Kim SJ,Lee IS,et al.Bacterial endotoxin induces the release of high mobility group box 1 via the IFN-beta signaling pathway[J].J Immunol,2009,182(4):2458-2466.
[7]Wang H,Yang H,Tracey KJ.Extracellular role of HMGB1 in inflammation and sepsis[J].J Intern Med,2004,255(3):320-331.
[8]Xu W,Chen GS,Shao Y,et al.Gastrin acting on the cholecystokinin2 receptor induces cyclooxygenase-2 expression through JAK2/STAT3/PI3K/Akt pathway in human gastric cancer cells [J].Cancer Lett,2013,332(1):11-18.
[9]左丽萍,陈素钻,俞晶,等.PI3K/Akt信号通路抑制剂对食管癌细胞EC109 中 FR 和 hnRNP-E1 表达的影响[J].广东医学,2012,33(19):2871-2873.
[10]Sun X,Gao X,Zhou L,et al.PDGF-BB-induced MT1-MMP expression regulates proliferation and invasion of mesenchymal stem cells in 3-dimensional collagen via MEK/ERK1/2 and PI3K/AKT signaling[J].Cell Signal,2013,25(5):1279-1287.
[11]Rodon J,Dienstmann R,Serra V,et al.Development of PI3K inhibitors:lessons learned from early clinical trials[J].Nat Rev Clin Oncol,2013,10(3):143-153.
[12]杨岚,李蕾,邵俊良,等.脂多糖诱导肥大细胞释放HMGB1研究[J].南京医科大学学报:自然科学版,2010,30(7):919-922.
