辛伐他汀治疗激素性股骨头坏死患者的效果观察及对循环内皮祖细胞功能的影响
2013-09-14刘俊峰黄军华张平方
张 辉 刘俊峰 黄军华 张平方
华北油田总医院骨科,河北任丘 062552
股骨头坏死是骨科较为常见的一种疾病,发病机制较为复杂。在我国由于存在广泛的糖皮质激素不合理应用,激素性股骨头坏死的发病率尤为突出。有研究显示,在长期大剂量激素的应用会造成股骨头局部血管通透性改变以及血管活性物质异常分泌,进而引起血流减缓、血管内皮细胞损伤及微血栓形成,最终导致局部骨组织正常结构的破坏,并且其范围和严重程度与血管内皮的损伤程度具有明显的相关性[1]。而在维持血管内皮的正常结构和功能中也发挥着至关重要的作用的内皮祖细胞(endothelial progenitor cell,EPC),其数量和功能的下调参与了该疾病的进程。由于辛伐他汀能够显著改善EPC的功能状态,本研究采用辛伐他汀对激素性股骨头坏死患者进行治疗,并对其循环EPC数量和功能进行了检测,现报道如下:
1 资料与方法
1.1 一般资料
选择华北油田总医院(以下简称“我院”)骨科2010年2月~2012年10月诊治的激素性股骨头坏死患者24例,随机分为治疗组及对照组,每组各12例。所有入选病例均符合股骨头坏死诊断标准[2]。另选择我院健康体检者12例为正常组。各组性别、年龄等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究经我院伦理委员会审批通过,所有研究对象均签署知情同意书。
1.2 主要试剂
内皮细胞培养基EGM-2(瑞士Lonza公司);FITC标记的血凝素(FITC-lectin,美国 Sigma公司);DiI标记的乙酰化低密度脂蛋白 (DiI-acLDL,美国Molecular Probes公司);噻唑蓝(MTT,美国 Duchfo公司);纤维连结蛋白(fibronectin,美国 Hematological Technologies公司);淋巴细胞分离液(天津TBD公司)。
1.3 研究方法
1.3.1 治疗方法及疗效评价 对照组患者予避免负重及相应的功能锻炼,并以常规剂量规律的服用肠溶性阿司匹林和地巴唑。治疗组患者在此基础上予口服辛伐他汀(山东罗欣药业股份有限公司,国药准字H20065119)进行治疗,0.01 g/d,连续应用12周。治疗前后分别对两组患者进行Harris评分以评价各组的临床疗效。
1.3.2 循环EPC体外培养及鉴定[3]所有患者治疗前后于清晨空腹采集静脉血20 mL,经过密度梯度离心分离收集单个核细胞。磷酸盐缓冲液(PBS)洗涤离心后,以EGM-2培养基重悬细胞并调整密度为1×107个/mL,将其接种至包被有纤连蛋白的24孔板中,于5%CO2、37℃培养箱内常规培养。第3天以PBS洗去未贴壁细胞,更换培养液继续培养,并予隔日半量换液。第7天加入终浓度0.005 g/L的DiI-acLDL继续培养4 h,2%多聚甲醛固定后,加入0.005 g/L的FITC-lectin于37℃孵育1 h,PBS洗涤后于荧光显微镜下进行观察荧光表达情况,双荧光阳性的细胞被认为是EPC。
1.3.3 细胞增殖能力检测 细胞培养第7天时以0.25%胰蛋白酶消化细胞制备单细胞悬液并调整密度为1×105个/mL,加入 96 孔板中(0.2 mL/孔),在 5%CO2、37℃培养 92 h 后加入 5 g/L 四甲基偶氮唑盐(MTT)(20 μL/孔)。培养 4 h 后吸弃培养基,并加入100 μL二甲基亚砜(DMSO)振荡溶解后用酶标仪检测其570 nm处的吸光度(A值)。
1.3.4 黏附能力检测 细胞培养第7天时以0.25%胰蛋白酶消化细胞制备单细胞悬液并调整密度为5×104个/mL,将其加入包被纤维连结蛋白的24孔板中(1 mL/孔),常规培养30 min后PBS冲洗3遍,200×相差显微镜下选取3个不同视野对贴壁细胞进行计数,取平均值。
1.3.5 细胞迁移能力检测 细胞培养第7天时以0.25%胰蛋白酶消化细胞,用0.1%血清浓度、无细胞因子的EGM-2培养基调整密度为5×104个/mL,加入24孔板插入式培养皿(0.2 mL/孔),在24孔板中加入EGM-2完全培养基(0.6 mL/孔),并将插入式培养皿置于其中。常规培养24 h后取出培养皿去除内层细胞,1%多聚甲醛固定外层细胞并行结晶紫染色,200×相差显微镜下选取3个不同视野对细胞进行计数,取平均值。
1.4 统计学方法
采用统计软件SPSS 13.0对数据进行分析,正态分布计量资料以均数±标准差(±s)表示,两独立样本的计量资料采用t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 疗效评价
治疗前治疗组 Harris评分为(76.32±3.97)分,对照组为(78.29±4.13)分,差异无统计学意义(t=0.263,P>0.05)。经辛伐他汀治疗 12周后,治疗组 Harris评分[(93.47±4.06)分]较对照组[(87.63±3.59)分]有明显的增高,差异有统计学意义(t=1.427,P<0.05)。
2.2 EPC培养及鉴定
外周血单个核细胞体外培养7 d后可以呈短梭状的细胞生成,具有典型EPC的形态特征,并且这些细胞同时具有摄取DiI-acLDL和结合FITC-lectin的能力,经Image J软件进行图像叠加后该类细胞呈现出双阳性的黄色荧光(图1)。
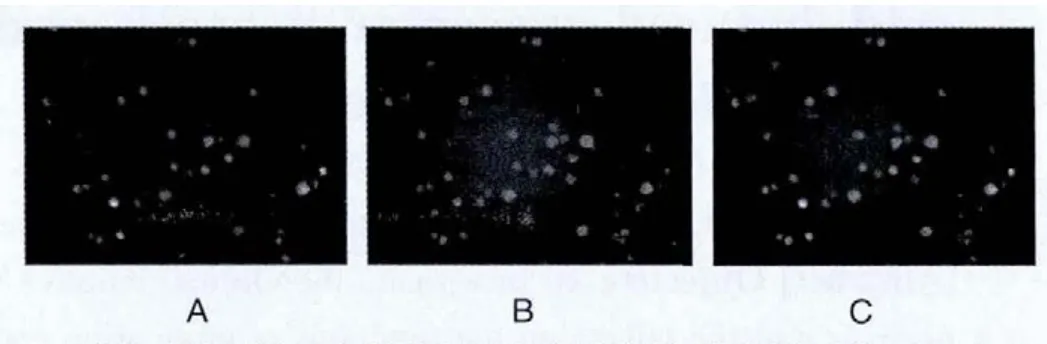
图1 EPC的免疫荧光鉴定
2.3 EPC增殖能力的变化
MTT实验显示,正常组循环EPC在570 nm处的吸光度为(0.76±0.13),而治疗组及对照组分别为(0.52±0.14)和(0.53±0.17),均低于正常组,差异均有高度统计学意义(t=5.73、4.95,均P<0.01),且治疗组与对照组之间差异无统计学意义(t=0.34,P>0.05)。在治疗12周后,治疗组患者EPC的体外增殖能力显示,其在570 nm处的吸光度为(0.72±0.15),明显高于对照组(0.62±0.11),二者差异有高度统计学意义(t=4.76,P<0.01)。
2.4 EPC黏附能力的变化
正常组EPC在体外培养30 min后的贴壁细胞数为(13.42±3.15)个/HPF,而治疗组与对照组分别为(5.93±1.67)个/HPF 和(5.67±1.58)个/HPF,均少于正常组,差异均有统计学意义(t=4.68、4.37,均 P<0.01),且治疗组与对照组之间差异无统计学意义 (t=0.24,P>0.05)。在治疗12周后,治疗组患者EPC的体外黏附能力显示,其贴壁细胞数为(11.93±3.45)个/HPF,明显多于对照组[(8.51±3.63)个/HPF],差异有高度统计学意义(t=3.26,P<0.01)。
2.5 EPC迁移能力的变化
正常组EPC在24孔插入式培养皿内培养24 h后,迁移至皿外层的细胞数量为(13.62±3.73)个/HPF,而治疗组与对照组分别为(6.28±1.53)个/HPF 和(6.64±1.75)个/HPF,均少于正常组,差异均有高度统计学意义(t=4.32、4.66,均P<0.01),且治疗组与对照组之间差异无统计学意义(t=0.22,P>0.05)。在治疗12周后,治疗组患者EPC的体外迁移能力显示,其迁移至皿外侧的细胞数为 (10.56±3.09)个/HPF,明显多于对照组[(7.48±3.13)个/HPF],差异有高度统计学意义(t=3.37,P<0.01)。
3 讨论
尽管糖皮质激素的应用可以引起骨质疏松的发生已经得到广泛的认可,然而对于激素性股骨头坏死的发病机制却尚无定论。近年来,有研究显示,股骨头局部毛细血管密度的增加可以显著的降低股骨头缺血性坏死的发生[4],由此有学者认为,血管性因素有可能在股骨头坏死的病理生理机制中起到了关键性的作用[5]。作为血管内皮细胞前体的EPC主要定居于骨髓,仅有极少量存在于外周血中,它不仅参与了血管生成及再生,同时在特定的状态下,可以迁移并归巢至发生损伤的血管部位,在血管损伤后的修复中发挥着至关重要的作用[6],其数量及功能的变化对于血管相关性疾病的评估亦具有一定的价值。
相关的研究显示,在激素的长期使用可以在体内通过多种途径对EPC的数量和功能产生影响[7]。一方面激素可以对血管内皮产生的直接损伤作用,导致内皮细胞的损伤和凋亡,另一方面激素的使用可以显著降低体内一氧化氮及血管内皮生长因子等血管活性物质合成,进而使EPC的增殖、迁移能力和血管生成能力减低[8-9]。诸多方面因素共同作用的结果将有可能导致在激素长期应用过程中循环EPC数量和功能的改变,进而造成股骨头局部由于血管数量及功能的异常而发生骨细胞的营养状态受到抑制而产生凋亡甚至坏死。本研究对激素性股骨头坏死患者的循环EPC包括增殖、黏附、迁移能力在内的各项功能指标进行了检测。结果显示与正常人群相比,激素性股骨头坏死患者循环EPC的体外功能指标存在不同程度的下调。由此推测,在激素长期大量应用的过程中,由于其对血管内皮细胞的损害导致股骨头局部微血管内皮细胞的坏死脱落,而在血管损伤修复中起到关键性作用的EPC由于多种细胞因子的分泌受到抑制而使其数量减少,且严重影响了其功能的有效发挥,最终使得受损的血管内皮不能得到及时有效的修复而发生舒张功能受损,甚而造成局部微血栓的形成及血管的闭塞,从而影响股骨头局部的正常血液供应而导致骨质的广泛性破坏和结构的改变。
辛伐他汀具有调节内皮细胞功能、抑制平滑肌细胞增殖、抗炎、抗氧化等非调脂作用,作为临床广泛应用的高效降脂药物广泛地应用于多种心血管疾病。同时近年来其特有的改善EPC功能的作用也越来越受到人们的广泛关注,研究显示,他汀类药物能够促进EPC的动员、迁移及分化,有利于改善EPC的功能,促进缺血区域的血管新生[10]。并且其对激素性股骨头坏死的临床疗效亦有报道[11]。在本研究中,利用辛伐他汀对激素性股骨头坏死患者进行了治疗,结果显示,辛伐他汀的确对于激素性股骨头坏死患者的临床症状改善有所帮助,治疗组在应用辛伐他汀12周后其循环EPC的各项体外功能指标均较对照组存在明显上调,与之相应的Harris评分也较对照组有显著的提高。这表明辛伐他汀能够通过改善激素性股骨头坏死患者循环EPC的功能,发挥其对股骨头局部微血管的修复功能,有效地改善股骨头的局部血液供应,从而达到对股骨头坏死的治疗作用。
[1]Seguln C,Kassis J,Busque L,et al.Non-traumatic necrosis of bone(osteonecrosis)is associated with endothelial cell activation but not thmmbophilia[J].Rheumatology(Oxford),2008,47(8):115l-1155.
[2]ARCO (Association Research Circulation Osseous).Committeeon Terminology and Classification[J].ARCO News,1992,(4):41-46.
[3]Liu JF,Du ZD,Chen Z,et al.Endothelial progenitor cell downregulation in a mouse model of Kawasaki disease [J].Chin Med J,2012,125(3):496-501.
[4]Wu X,Yang S,Duan D,et al.A combination of granulocyte colony stimulating factor and stem cell factor ameliorates stemid-associated osteonecresis in rabbits[J].J Rheumatol,2008,35(9):224l-2248.
[5]Kerachian MA,Harvey EJ,Coumoyer D,et al.A vascular necrosis of the femorat head:vascular hypotheses [J].Endothelium, 2006,13(8):237-244.
[6]Werner N,Kosiol S,Schiegl T,et al.Circulating endothelial progenitor cells and cardiovascular outcomes [J].N Engl J Med,2005,353(24):999-1007.
[7]Vogt CJ,Sehmid-Sehonbein GW.Microvascular endothelial cell death and rarefaction in the glucacorticoid-induced hypertensive rat[J].Microcirculation,2001,8(4):129-139.
[8]Li X,Jin L,Cui Q,et al.Steroid effects on osteogenesis through mesenchymal cell gene expression[J].Osteoporos Int,2005,16(3):101-108.
[9]Akaike M,Matsumoto T.Glucocorticoid-induced reduction in NO bioavailability and vascular endothelial dysfunction[J].Clin Calcium,2007,17(8):864-870.
[10]Deschaseaux F,Selmani Z,Falcoz PE,et al.Two types of circulating endathelial progenitor cells in patients receiving long term therapy by HMG-CoA reductase inhibitors[J].Eur J Pharmacol,2007,562(1-2):111-118.
[11]刘会怡,潘昌如,潘平.辛伐他汀治疗早期激素引起缺血性股骨头坏死[J].中国中西医结合外科杂志,2012,18(2):178-180.
