外周血miR-29a-3p、miR-365a-3p在活动性肺结核和结核潜伏感染者中的表达
2013-09-14刘守江覃林珍王三清
刘守江 张 帆 魏 巍 覃林珍 闫 敬 王三清 王 健
广东省深圳市南山区慢性病防治中心结核病防治科,广东深圳 518054
微小 RNA(microRNA,miRNA)是一类广泛存在于真核细胞中,长度约20 nt的高度保守的非编码RNA调控因子,是由全长的mRNA样转录子加工而来,通过与对应的靶mRNA的3'非翻译区的非完全或完全配对结合,阻止其翻译或破坏其稳定性,实现对基因表达的调控,越来越多的研究表明,miRNA在肿瘤、糖尿病、心血管疾病、病毒感染等多种疾病中都起着重要作用,是正常和疾病状态下基因调节的一个新的机制[1-2]。近年miRNA在肺结核患者中表达也是研究热点之一。本研究主要探讨miR-29a-3p、miR-365a-3p分子在活动性肺结核(TB)和结核潜伏感染(LTBI)者外周血中的表达情况。
1 资料与方法
1.1 一般资料
收集深圳市南山区慢性病防治院(以下简称“我院”)结核病防治科门诊2012年1~10月诊治的TB患者30例,其中男 17例,女 13例,平均年龄(26.1±10.1)岁,诊断标准:经痰抗酸杆菌涂片阳性,临床症状结合X线表现、CT诊断以及病原学检查,符合全国结核病分类与诊断标准;LTBI者 30例,其中男 14例,女16例,平均年龄(28.9±9.5)岁,判定标准:采用结核菌特异性酶联免疫斑点试验阳性,而胸片未见异常[3]。两组研究对象之间的年龄、性别比较差异无统计学意义 (P>0.05)。所有研究对象均排除HBV、HCV、HIV病毒感染及其他慢性疾病如高血压、糖尿病、肾炎、自身免疫性疾病等。所有研究对象均经我院伦理委员会批准通过,并签署知情同意书。
1.2 标本的收集和处理
抽取外周静脉血2 mL,30 min内分装200 μL全血于冻存管中(已预装有Trizol和研磨珠),振荡混匀后-80℃保存;根据Trizol Reagent试剂盒说明书(Invitrogen)抽提总RNA,核酸测定仪测定浓度和纯度,琼脂糖凝胶电泳分析RNA的完整性;-80℃保存。
1.3 研究方法
1.3.1 全血RNA提取 加入1 mL Trizol,充分裂解细胞,加入 200 μL 氯仿,剧烈振荡 15 s,室温放置 3 min,12 000 r/min,4℃,离心15 min。吸取上层水相,至另一离心管中。加入1.5倍体积异丙醇充分混匀,室温放置10 min。12 000 r/min,4℃,离心10 min,RNA沉淀于管底,倾倒上清,沉淀物用75%乙醇洗涤2次,室温晾干10 min,加入适量无RNase水充分溶解,调整RNA浓度。
1.3.2 反转录-荧光定量PCR检测 miRNA反转录反应体系为 20 μL,0.5 g/L 总 RNA 1 μL,2×反转录缓冲混合物 10 μL,RNase Free 水 5 μL,反转录酶 2 μL,0.1%BSA 2 μL。反转录反应条件为 37℃ 60 min,85℃ 5 min,4℃ 5 min。荧光定量 PCR 反应体系为 25 μL,cDNA 模板 2 μL, 水 8.5 μL,SYBR Green 12.5 μL,上游引物 1 μL,下游引物 1 μL。荧光定量PCR反应条件为预变性95℃10 s;变性和延伸95℃5 s;60℃ 20 s,共40个循环。引物采用在线设计软件:http://www.ncbi.nlm.nih.gov/tools/primer-blast/;管家基因U6为内参照,测得的数据用平均相对含量表示。引物由invitrogen合成,引物序列见表1。
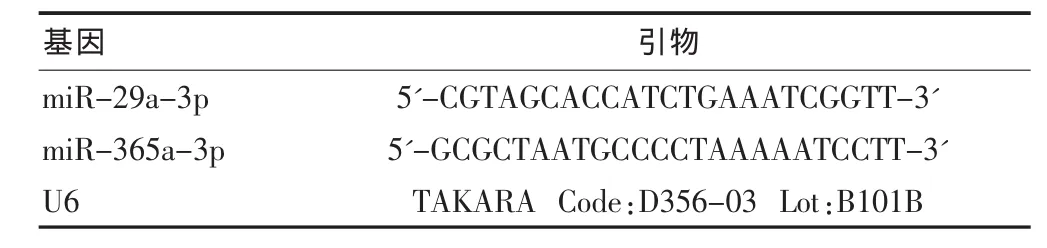
表1 反转录-荧光定量PCR引物序列(5'-3')
1.4 统计学方法
采用SPSS 13.0统计软件进行数据分析,比较两组间差异采用t检验,相关性分析采用Pearson检验,以P<0.05为差异有统计学意义。
2 结果
2.1 外周血miR-29a-3p在活动性肺结核和结核潜伏感染者中的表达
对活动性肺结核患者和LTBI外周血miR-29a-3p数据进行分析,结果表明,外周血miR-29a-3p表达在LTBI(1.16±0.65)中明显高于活动性肺结核患者组(0.71±0.32)(P<0.05)。见图1。
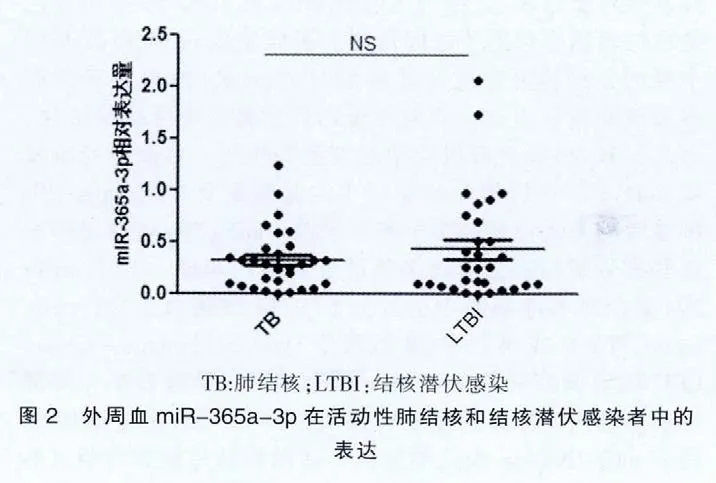
2.2 外周血miR-365a-3p在活动性肺结核和结核潜伏感染者中的表达

对活动性肺结核患者和LTBI外周血miR-365a-3p数据进行分析,结果表明,活动性肺结核组外周血miR-365a-3p 表达(0.32±0.71)与 LTBI(0.43±0.51)比较差异无统计学意义(P>0.05)。见图2。
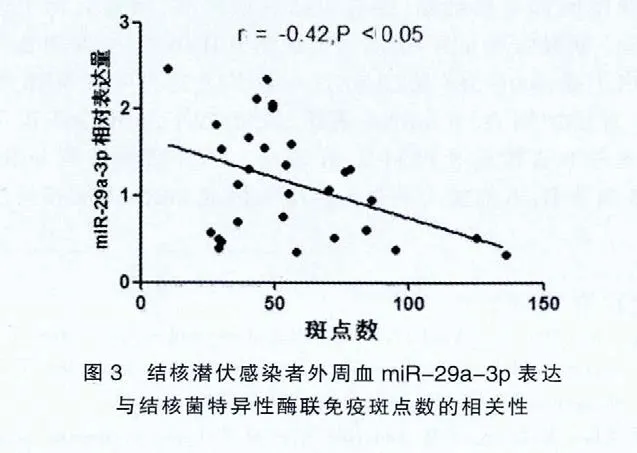
2.3 结核潜伏感染者外周血miR-29a-3p表达与结核菌特异性酶联免疫斑点数相关性分析
相关性分析发现,LTBI外周血miR-29a-3p表达与结核菌特异性酶联免疫斑点数呈负相关 (r=-0.42,P=0.02)。见图3。
3 讨论
miRNA在细胞生长发育、分化、增殖、凋亡、肿瘤发生等发生发展中均起到重要作用。越来越多的研究发现miRNAs表达失调与多种疾病发生(如病毒感染、心血管疾病、肺部疾病、纤维化、肿瘤等)密切相关。近年来研究也发现miRNA可以参与调节免疫细胞的成熟、增殖、分化和活化,miRNA通过选择性表达,干扰、降解或抑制靶基因的mRNA,从而调控免疫反应,其在固有免疫应答和适应性免疫应答中均起到重要作用,如通过下调信号通路TCR中多种蛋白磷酸激酶活性,调节TCR信号通路强度[4];通过下调促凋亡蛋白和肿瘤抑制因子,促进T细胞、B细胞增殖;通过下调SOCS1信号通路调节Treg细胞发育[5]、通过下调AID调节B细胞抗体类别转换[6-7],以及通过下调多种转录因子调节髓样细胞的增殖和分化等多种形式。
microRNA-29a(miR-29a)是新近发现的一个与多种疾病发生紧密相关的小分子RNA家族,除3'端非编码区碱基区域(3'untranslated region,3'UTR)外,miR-29 也可与非3'UTR区内的miRNA调节元件(miRNA regulator elments,MRE)结合发挥作用。弹性蛋白3'UTR和编码区共有14个miR-29的结合位点,荧光素酶报告基因分析方法证实:miR-29可通过同时与编码区内和3'UTR的MRE结合来抑制弹性蛋白表达,编码区内的MRE在miR-29抑制弹性蛋白的表达中起到了协同作用。研究发现miR-29靶基因主要的是细胞外基质及迁移蛋白[8-9],miR-29可直接抑制多种胶原蛋白表达。而胶原蛋白异常聚集可导致纤维化,因此miR-29在抗纤维化中起到重要作用。目前研究也发现miR-29a在机体免疫反应中也起到重要作用,miR-29a靶基因相关蛋白参与多个信号通路。miR-29a可通过抑制这些信号蛋白表达参与多条信号通路的调控。其中miR-29a是经典Wnt通路中信号分子——T细胞因子(T-cellfactor,TCF)或淋巴样增强因子(lymphoi denhancer factor,LEF)的负调控分子,miR-29a可通过靶向降解IFN-γ降低机体对胞内病原体的免疫应答[10-11]。本研究也发现LTBI外周血miR-29a-3p表达明显高于活动性肺结核患者组,LTBI外周血miR-29a-3p表达与结核菌特异性酶联免疫斑点数呈负相关,miR-29a-3p表达高的,结核菌特异性酶联免疫斑点数却较少,而结核菌特异性酶联免疫斑点数反应了T细胞分泌IFN-γ的能力,因此miR-29a-3p在肺结核感染、发病过程中可能起到重要作用。
IL-6是介导组织炎症的重要细胞因子,趋化、活化中性粒细胞和单核细胞,促进炎症递质释放,增强局部炎性反应。研究发现miR-365a可负性调节IL-6表达,抑制IL-6蛋白生成,miR-365通过与IL-6基因的3'UTR的MRE结合,直接抑制IL-6 mRNA表达,除此之外,miR-365也可能通过非直接途径抑制IL-6表达,体外实验发现miR-365调节IL-6的能力超过let-7a[12],因此miR-365a在炎性反应中也起到重要作用,但本研究中并未发现结核潜伏感染者和活动性肺结核之间差异,miR-365a-3p在肺结核发病中的作用还需进一步研究。
综上所述,miRNA-29a表达在肺结核感染、发病过程中可能起到重要作用。随着研究的不断深入,miRNA-29a将在肺结核诊断及致病机制中作用更加清楚、明确,且有可能成为区别结核潜伏感染者的一个重要标志分子。
[1]Calin GA,Ferracin M,Cimmino A,et al.A MicroRNA signature associated with prognosis and progression in chronic lymphocytic leukemia[J].N Engl J Med,2005,353(17):1793-1801.
[2]Lu J,Getz G,Miska EA,et al.MicroRNA expression profiles classify human cancers[J].Nature,2005,435(7043):834-838.
[3]Chen X,Yang Q,Zhang M,et al.Diagnosis of active tuberculosis in China using an in-house gamma interferon enzyme-linked immunospot assay[J].Clin Vaccine Immunol,2009,16(6):879-884.
[4]Li QJ,Chau J,Ebert PJ,et al.miR-181a is an intrinsic modulat or of T cell sensitivity and selection[J].Cell,2007,129:147-161.
[5]Lu LF,Boldin MP,Chaudry A,et al.Functi on of miR-146a in cont rol ling T regcell mediated regulation of Th1 responses [J].Cell,2010,142:914-929.
[6]Dorsett Y,McBride KM,Jankovic M,et al.MicroRNA-155 suppresses activation-induced cytidine deaminase mediated MycIgh trans location[J].Imunity,2008,28:630-638.
[7]Teng G,Hakimpour P,Landgraf P,et al.MicroRNA-155 is a negative regulator of activation-induced cytidine deaminase [J].Immunity,2008,28:621-629.
[8]Gebeshuber CA,Zatloukal K,Martinez J.miR-29a suppresses tristetraprolin,which is a regulator of epithelial polarity and metastasis[J].EMBO Rep,2009,10(4):400-405.
[9]Fort A,Borel C,Migliavacca E,et al.Regulation of fibrinogen production by microRNAs[J].Blood,2010,116(14):2608-2615.
[10]Kapinas K,Kessler C,Ricks T,et al.MiR-29 modulates Wnt signaling in human osteoblasts through a positive feedback loop[J].J Biol Chem,2010,285(33):25221-25231.
[11]Sharbati J,Lewin A,Kutz-Lohroff B,et al.Integrated microRNA-mRNA-analysis of human monocyte derived macrophages upon mycobacterium avium subsp,homin issuis infection [J].PLoS One.2011,6(5):20258.
[12]Xu Z,Xiao SB,Xu P,et al.miR-365,a novel negative regulator of interleukin-6 gene expression,is cooperatively regulated by Sp1 and NF-kappa B[J].J Biol Chem,2011,286(24):21401-21412.
