大柴胡颗粒质量标准研究
2013-09-14胡颖菲陆兔林毛春芹弓晓东周云中
胡颖菲, 陆兔林*, 毛春芹, 吴 皓, 弓晓东, 周云中, 王 菊, 张 星
(1.南京中医药大学药学院,江苏南京210046;2.南通精华制药股份有限公司,江苏南通226005)
大柴胡颗粒,是在东汉著名医学家张仲景创立的“大柴胡汤”的基础上,根据现代制剂工艺制备的颗粒剂,由柴胡、黄芩、大黄、枳实 (炒)、芍药、半夏 (姜)、生姜、大枣八味药材组成,具有和解少阳、内泻热结之功效,临床主要用于急慢性胆囊炎的治疗[1]。柴胡为方中君药,黄芩、枳实、大黄共为臣药,主要活性成分包括黄酮类、萜类、皂苷、蒽醌和香豆素等,其中以枳实与黄芩中的黄酮类成分 (柚皮苷、新橙皮苷、黄芩苷等)量最高。目前有关大柴胡颗粒的质量标准研究尚未见报道,仅见对黄芩苷进行定量检测分析[2]。因此,本实验采用薄层色谱法 (TLC)对黄芩、大黄、枳实、白芍进行定性鉴别,高效液相色谱法(HPLC)同时测定柚皮苷、橙皮苷、新橙皮苷和黄芩苷,为全面有效控制大柴胡颗粒的质量提供科学依据。
1 仪器与材料
Agilent1200高效液相色谱仪 (G1315C DAD检测器),Chem Station色谱工作站;KQ-500B型超声波清洗器 (昆山市超声仪器有限公司);AB104-L分析天平 (德国梅特勒公司);HH-S型水浴锅 (巩义市英峪予华仪器厂);硅胶G、H薄层板 (青岛海洋化工厂);紫外分析仪WD-9403C型 (北京市六一仪器厂)。
柚皮苷对照品 (批号110722-201111)、橙皮苷对照品 (批号110721-200905)、新橙皮苷对照品 (批号111857-201102)、黄芩苷对照品 (批号110715-201014)、黄芩对照药材 (批号 120955-201008)、大黄对照药材 (掌叶大黄,批号121249-201003)、枳实对照药材 (批号 120936-201005)、白芍对照药材 (批号120905-201109)均购自中国药品生物制品检定所;大柴胡颗粒样品及处方药材 (江苏南通精华制药有限公司提供);乙腈 (美国Tedia公司)、甲醇 (上海凌峰化学试剂公司)为色谱纯,水为重蒸水,其它试剂均为分析纯。
2 方法与结果
2.1 薄层色谱 (TLC)鉴别
2.1.1 黄芩的 TLC鉴别[3]取本品2 g,研细,加甲醇40 mL,超声20 min,滤过,滤液挥干,残渣加水50 mL使溶解,离心 (4 800 r/min,15 min)倾出上清液,盐酸调pH 1~2,用乙酸乙酯振摇提取2次,每次30 mL,合并乙酸乙酯提取液,水浴蒸干,残渣用甲醇定容至1 mL,作为供试品溶液。另取黄芩对照药材1 g,同法制成对照药材溶液。再取缺黄芩的阴性样品2 g,同法制成阴性对照溶液。吸取上述溶液各10μL,分别点于同一硅胶G薄层板上,以甲苯-乙酸乙酯-甲醇-甲酸 (10∶3∶1∶2)为展开剂,展开,取出,晾干,喷以2%三氯化铁乙醇溶液,在105℃加热至斑点显色清晰。结果,供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点,阴性对照无干扰。黄芩的薄层色谱图见图1。
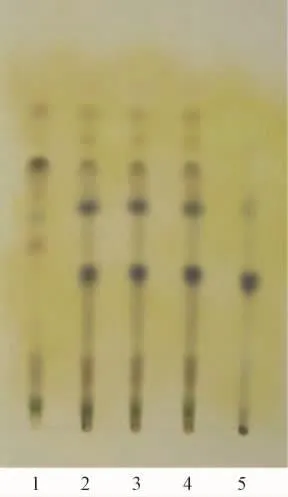
图1 黄芩TLC色谱图Fig.1 TLC chromatogram of Scutellariae Radix
2.1.2 大黄的 TLC鉴别[4-5]取本品0.5 g,研细,加甲醇20 mL,超声10 min,滤过,取滤液5 mL,蒸干,残渣加水10 mL使溶解,再加盐酸1 mL,加热回流30 min,立即冷却,用三氯甲烷分2次振摇萃取,每次20 mL,合并萃取液,蒸干,残渣加甲醇2 mL使溶解,作为供试品溶液。另取大黄素、大黄酸、大黄酚、大黄素甲醚对照品适量,加甲醇制成每1 mL含1 mg的混合溶液,作为对照品溶液。再取缺大黄的阴性样品0.5 g,同法制成阴性对照溶液。照薄层色谱法 (附录Ⅵ B)试验,吸取上述3种溶液各4μL,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶H薄层板上,以石油醚 (30~60℃)-甲酸乙酯-甲酸 (15∶5∶1)的上层溶液为展开剂,展开,取出,晾干,置紫外光灯 (365 nm)下检视。供试品色谱中,结果,供试品色谱中,在与对照品色谱相应的位置上,显橙黄色荧光斑点,阴性对照无干扰。大黄的薄层色谱图见图2。
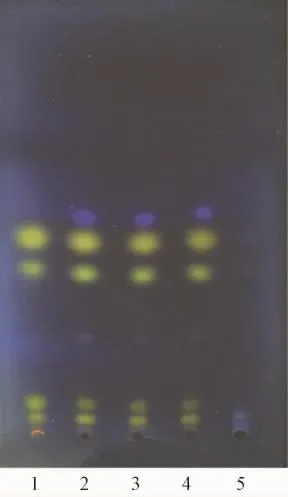
图2 大黄TLC色图谱Fig.2 TLC chromatogram of Rhei Radix et Rhizoma
2.1.3 枳实的 TLC鉴别[6]取本品2 g,研细,加甲醇20 mL,密塞,超声20 min,滤过,取滤液10 mL,蒸干,残渣加甲醇2 mL作为供试品溶液。另取枳实对照药材,加甲醇制成每1 mL含0.5 mg的混合溶液,作为对照品溶液。再取缺枳实的阴性样品2 g,同法制成阴性对照溶液。分别吸取上述溶液各10μL,点于同一硅胶G薄层板上,以甲苯-乙酸乙酯-甲酸-水 (20∶10∶1∶1)的上层溶液为展开剂,展开,取出,晾干,喷以三氯化铝试液,置紫外光灯 (365 nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点,阴性对照无干扰。枳实的薄层色谱图见图3。

图3 枳实TLC色谱图Fig.3 TLC chromatogram of Aurantii Fructus immaturus
2.1.4 白芍的TLC鉴别[7]取本品1.5 g,研细,加70%甲醇20 mL,超声30 min,滤过,滤液蒸干,残渣加乙醇2 mL使溶解,作为供试品溶液。另取白芍对照药材0.5 g,同法制成对照药材溶液。再取缺白芍阴性样品1.5 g,同法制成阴性对照溶液。吸取上述3种溶液各10μL,分别点于同一硅胶G薄层板上,以二氯甲烷-甲醇-乙酸乙酯(8∶4∶1)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,在105℃加热至斑点显色清晰。结果,供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点,阴性对照无干扰。白芍的薄层色谱图见图4。
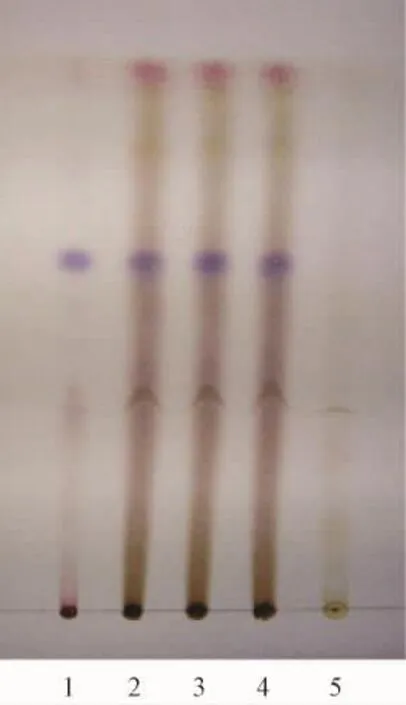
图4 白芍TLC色谱图Fig.4 TLC chromatogram of Paeoniae Radix alba
2.2 黄酮类成分 (黄芩苷、柚皮苷、橙皮苷、新橙皮苷)HPLC定量测定[8-12]
2.2.1 色谱条件 汉邦Kromasil C18色谱柱 (250 mm×4.6mm,5μm),乙腈 (A) -0.2%醋酸水溶液 (B)为流动相梯度洗脱,0 min(5%A),28 min(26%A),36 min(26%A),48 min(40%A),体积流量为1 mL/min,检测波长280 nm,柱温为30℃,进样量10μL,理论塔板数按柚皮苷、橙皮苷、新橙皮苷和黄芩苷计算均不低于4 000。
2.2.2 对照品溶液的配制 分别称取柚皮苷、橙皮苷、新橙皮苷和黄芩苷对照品适量,精密称定,置2mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,备用。分别精密量取单个组分对照品溶液,加甲醇配成每1 mL分别含柚皮苷0.193 8 mg、橙皮苷0.109 6 mg、新橙皮苷0.128 7 mg、黄芩苷0.452 5 mg的混合对照品液。
2.2.3 供试品溶液的配制 取大柴胡颗粒适量,研细,精密称取1.00 g,置具塞锥形瓶中,精密加入甲醇25 mL,密塞,称定质量,超声处理30 min,取出,放冷至室温,再称定质量,加甲醇补足损失的质量,摇匀,过滤,取续滤液,即得供试品溶液,用时过0.45μm的滤膜。
2.2.4 阴性对照溶液配制 按处方比例分别称取除黄芩、枳实以外的其余药味,按照制备工艺制成缺黄芩、缺枳实、同时缺黄芩和枳实的阴性样品,按2.2.3项供试品溶液的制备方法操作,制成阴性对照溶液。
2.2.5 专属性试验 分别取混合对照品溶液,供试品溶液及阴性供试品溶液,按上述色谱条件进样分析,液相色谱图见图5。阴性样品在指标成分柚皮苷、橙皮苷、新橙皮苷和黄芩苷的色谱峰位置上无吸收,表明该方法的专属性良好。
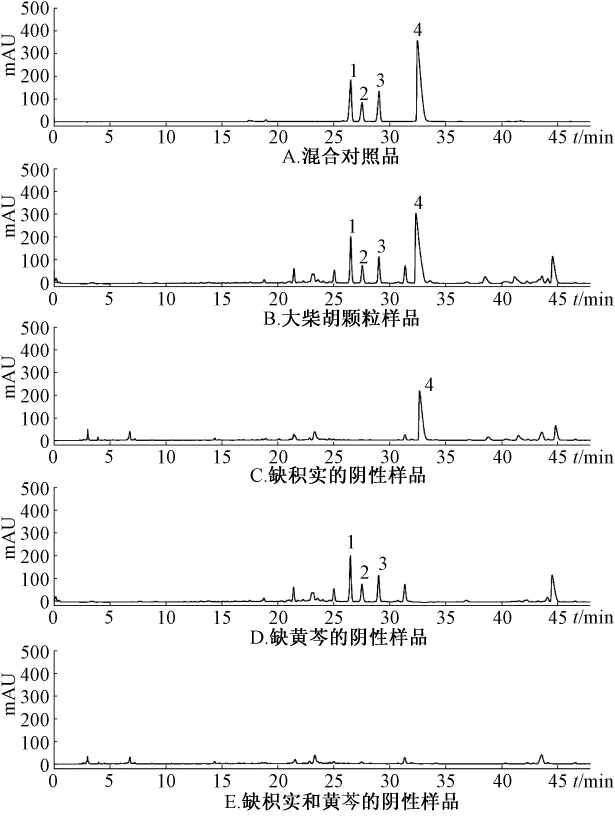
图5 大柴胡颗粒的HPLC色谱图Fig.5 HPLC chromatogram s of Dachaihu Granules
2.2.6 线性关系考察 分别精密吸取2.2.2项下的混合对照品溶液1、2、5、10、15、20μL进样分析,记录峰面积。以峰面积Y对进样量X(μg)进行线性回归,求得柚皮苷、橙皮苷、新橙皮苷和黄芩苷的回归方程、相关系数和线性范围,结果见表1。
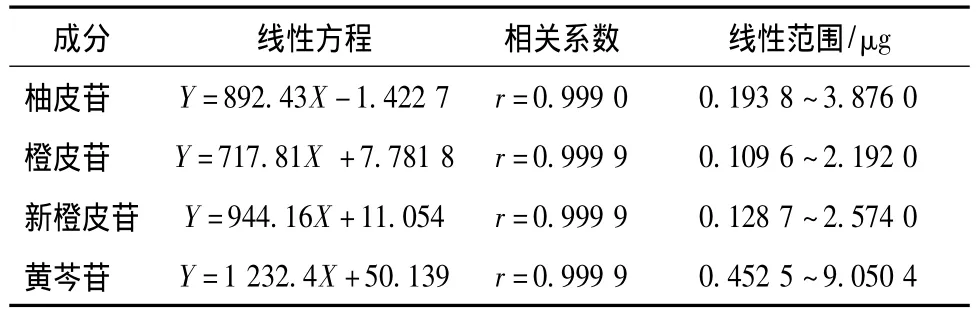
表1 4种有效成分的线性方程、相关系数及线性范围Tab.1 Regression equations,correlation coefficients and linearity ranges of four compounds
2.2.7 精密度试验 取上述对照品溶液,在上述色谱条件下连续进样6次,计算柚皮苷、橙皮苷、新橙皮苷和黄芩苷的峰面积,其RSD分别为0.80%、0.89%、0.79%、1.44%,表明仪器精密度良好。
2.2.8 稳定性试验 取批号为110801的大柴胡颗粒样品1份,按照供试品溶液的制备方法制备供试品液,分别在0、2、4、8、12、20 h测定样品中各组分的峰面积,测得柚皮苷、橙皮苷、新橙皮苷和黄芩苷峰面积的RSD分别为1.32%、1.19%、1.68%、1.15%,表明供试品溶液在20 h内稳定。
2.2.9 重复性试验 取批号为110801的大柴胡颗粒样品6份,每份1.00 g,按照供试品溶液的制备方法制备供试品液,进样10μL,记录峰面积,并计算质量分数。结果样品中柚皮苷、橙皮苷、新橙皮苷和黄芩苷平均质量分数 (n=6)分别为5.764 2 mg/g、 2.907 4 mg/g、 3.422 2 mg/g、16.523 2 mg/g,RSD分别为 1.50%、2.39%、1.93%、2.78%,表明该方法重复性良好。
2.2.10 加样回收率试验 称取批号为110801的大柴胡颗粒样品9份,每份约0.5 g,精密称定,置具塞锥形瓶中,分别加入低、中、高3个质量浓度的混合对照品溶液 (含柚皮苷2.882 3 mg/mL、橙皮苷1.456 1 mg/mL、新橙皮苷1.702 8 mg/mL、黄芩苷8.262 4 mg/mL)0.8 mL、1.0 mL、1.2 mL,按2.2.3项下方法制备供试品溶液,进样测定,计算回收率,结果见表2。柚皮苷、橙皮苷、新橙皮苷及黄芩苷的平均回收率分别为99.94%、95.83%、97.46% 和 98.94%,RSD 分 别 为1.89%、1.72%、2.21%和2.68%。

表2 大柴胡颗粒中4种成分加样回收率(n=9)Tab.2 Recoveries of four com pounds in Dachaihu Granules(n=9)
2.2.11 样品测定 取不同批号的大柴胡颗粒,按2.2.3项下的方法制备供试品溶液,按上述色谱条件测定质量分数,结果见表3。

表3 大柴胡颗粒4种成分的测定结果(n=3)Tab.3 Contents of four com pounds in Dachaihu Granules(n=3)
3 讨论
一般质量标准研究,主要是选择方中一到两个主要成分进行定量分析。本实验选择柚皮苷、橙皮苷、新橙皮苷和黄芩苷作为大柴胡颗粒的定量指标,有以下几个原因。这4种成分均是黄酮类物质,在280 nm附近有最大吸收,同一色谱条件下能很好地分离;同时,方中君药柴胡中的柴胡皂苷量极低,且不易检测;柚皮苷、橙皮苷、新橙皮苷是枳实中最主要的活性成分,黄芩苷是黄芩中量最高的活性物质,故选择臣药黄芩、枳实中的主要成分作为大柴胡颗粒的定量指标。4种黄酮类成分同时定量检测对于控制大柴胡颗粒的质量有着重要意义。
本实验考察了不同提取溶剂如水、95%乙醇、50%甲醇、80%甲醇、甲醇,结果以甲醇提取较完全。比较了超声提取和回流提取,发现两者提取效果相当,因超声提取简单、节省时间,故选择超声提取法。对提取时间 (30 min、40 min、50 min)进行比较,发现30 min即可提取完全。同时,比较了多种流动相系统,包括甲醇-水、乙腈-水、乙腈-醋酸水系统,结果表明甲醇-水体系基线漂移,乙腈-水体系基线平稳,各峰分离度较好,但黄芩苷未见出峰,乙腈-醋酸水系统各峰分离较好。又考察了乙腈-0.05%醋酸水、乙腈-0.1%醋酸水、乙腈-0.2%醋酸水3个流动相体系,结果以乙腈-0.2%醋酸水为流动相各成分峰形较好,各峰间的分离度均达到1.5以上。故选择流动相为乙腈-0.2%醋酸水梯度洗脱。
[1]张振中,李 美.大柴胡颗粒治疗老年慢性胆囊炎的临床观察[J].国际消化病杂志,2011,31(3):183-184.
[2]刘 博,杨向东,史自东.HPLC法测定大柴胡颗粒中黄芩苷含量[J].湖北中医杂志,2007,29(5):51-52.
[3]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:283.
[4]刘友平,宋 英,秦春梅,等.枳实导滞浓缩丸质量标准研究[J].中国中药杂志,2002,27(11):838-840.
[5]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:22.
[6]刘振华,何丽果,徐艳霞,等.枳实消痞丸的薄层色谱鉴别[J].药物鉴定,2010,19(10):48.
[7]杨婉花,郝晓静,李 娟,等.双白片质量标准研究[J].中国药房,2010,21(27):2549-2551.
[8]许丽娜,韩 旭,丑小华,等.反相HPLC法同时测定大柴胡汤中3种黄酮类的含量[J].药物分析杂志,2008,28(10):1686-1688.
[9]徐海燕,金 艺,张红霞,等.HPLC同时测定胃动力片中柚皮苷、橙皮苷和新橙皮苷的含量[J].中成药,2010,32(8):1355-1357.
[10]郭丽红,郑国钧,苗爱东,等.高效液相色谱法测定劫镖清肺丸中柚皮苷、橙皮苷和黄芩苷的含量[J].药物分析杂志,2009,29(9):1493-1495.
[11]谢友良,曾慧芳,林 吉,等.HPLC测定黄芩正气胶囊中橙皮苷、黄芩苷、和厚朴酚、厚朴酚的含量[J].中成药,2006,28(1):34-36.
[12]于 颖.HPLC测定木香理气丸中黄芩苷和橙皮苷含量[J].中成药,2004,26(10):810-812.
