不稳定型心绞痛合并高尿酸血症患者内皮功能的研究
2013-09-14吴永辉吴立华
吴永辉,史 哲,吴立华
不稳定型心绞痛属于冠心病的分型之一,是常见的心血管急症。近些年,冠心病的发病率和死亡率呈上升趋势。与这种改变相伴随的还有高尿酸血症患者日益增加。高尿酸血症在冠心病发生、发展中的机制也备受关注。本研究检测不稳定型心绞痛合并高尿酸血症患者血清一氧化氮(NO)、血浆内皮素-1(ET-1)的水平,探讨不稳定型心绞痛合并高尿酸血症患者是否存在血管内皮功能障碍。
1 资料与方法
1.1 研究对象 2009年1月—2011年3月因不稳定型心绞痛合并高尿酸血症住院患者40例,男22例,女18例,年龄59.67岁±7.42岁。纳入标准:符合ACC/AHA制定不稳定型心绞痛诊断标准[1]。高尿酸血症诊断标准[2]:男性血尿酸≥416 μmol/L(7.0mg/dL),女性血尿酸≥357μmol/L(6.0mg/dL)。所有入选者均排除感染性疾病、肿瘤、免疫、射血分数小于40%的心力衰竭,且近期无手术及肝肾功能不全者。另选取本院门诊健康查体者30名为正常组,男18名,女12名,年龄59.72岁±6.39岁。经临床、心电图及有关实验室检查,排除心、脑、肝、肾、内分泌、感染及免疫等方面疾病,采血前两周内未用过任何药物。
1.2 方法 所有患者住院期间均记录心率、血压、血常规,查空腹血糖、肝功能、肾功能、心脏彩超等相关的检查,于入院第2天清晨空腹取血。
1.3 检测方法 入选对象在入院第二天清晨空腹取血后,离心取血清、血浆,放于-70℃冻存待测。NO采用硝酸还原酶法,试剂盒由南京建成生物工程研究所提供。ET采用放免法测定,试剂盒由北京北方生物技术研究所提供。
1.4 统计学处理 应用SPSS 13.0软件,计量资料以均数±标准差(±s)表示,非配对资料采用t检验。
2 结 果
不稳定型心绞痛合并高尿酸血症患者组血清NO水平低于对照组,血浆ET-1高于对照组P<0.05)。详见表1。
表1 两组NO、ET-1比较(±s)
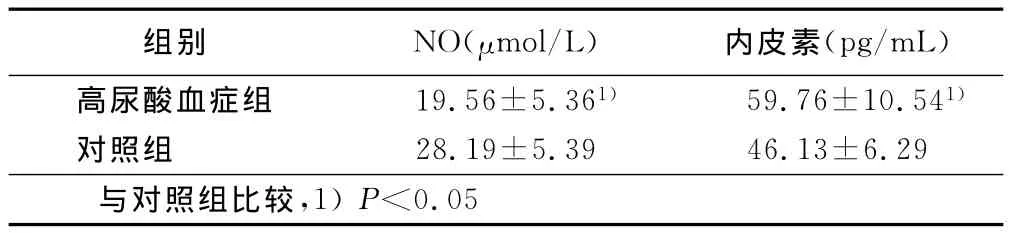
表1 两组NO、ET-1比较(±s)
组别 NO(μmol/L) 内皮素(pg/mL)高尿酸血症组 19.56±5.361) 59.76±10.541)对照组 28.19±5.39 46.13±6.29与对照组比较,1)P<0.05
3 讨 论
不稳定型心绞痛因冠脉内粥样斑块不稳定,出现裂隙或破裂,引起血小板聚集,形成血栓,导致冠脉管腔不完全阻塞而引起的。血管内皮是介于循环血液与血管平滑肌之间的生理屏障,它既是内分泌组织又是激素反应组织,可产生多种激素如内皮源性舒张因子(NO)、内皮素、前列环素、血栓素A2等。已经证实NO可抑制细胞增殖、抑制血小板聚集、抑制超氧阴离子产生等动脉粥样硬化的关键过程。目前认定内皮功能失调会引起内皮衍生的NO生成,释放减少或活性降低[3]。ET-1是内皮细胞分泌的缩血管物质,参与动脉粥样硬化的发生发展,ET的升高在一定程度上反映了血管内皮细胞损伤程度,也是衡量内皮功能的重要指标之一。高尿酸血症是心血管病死亡及全因死亡的独立危险因素。
本研究发现,不稳定型心绞痛合并高尿酸血症患者血清NO水平减低,血浆ET-1增高 ,存在内皮功能障碍,提示内皮功能障碍参与不稳定型心绞痛合并高尿酸血症患者的病理过程。可能的机制是:血尿酸结晶析出,沉积于血管壁,直接损伤血管内皮;尿酸在合成过程中产生的超氧阴离子可灭活NO,形成强氧化剂过氧亚硝基阴离子,损伤血管内皮;尿酸可引起血小板激活、黏附及聚集;高尿酸血症参与众多的炎症介质(如白细胞介素、C反应蛋白等)的生成[4];高尿酸血症可促进氧自由基生成增加。氧自由基可使低密度脂蛋白氧化、损伤内皮细胞、促进血管平滑肌及内膜增生、内皮细胞脱落和血小板黏附[5]等。降低血尿酸水平,可减少内皮功能的损伤,有可能是治疗不稳定型心绞痛合并高尿酸血症患者方法之一。
[1]Braunwald E,Antman EM,Beasley JW,etal.ACC/AHA guidelines for the management of patients with unstable angina and non-ST-segment elevation myocardial infarction.A report of the American College of Cardiology/American Heart Association.Task Force on Practice Guidelines[J].J Am Coll Cardiol,2000,36(3):970-1062.
[2]Feig DI,Kang DH,Johnson RJ.Uric acid and cardiovascular risk[J].N Engl J Med,2008,359(17):1811-1821.
[3]Hasdai D,Gibbons RJ,Holmes DR,etal.Coronary endothelial dysfunction in humans is associated with myocardial perfusion defects[J].Circulation,1997,96:3390-3395.
[4]Zapolski T,Wacinski P,Kondracki B,etal.Uric acid as a link between renal dysfunction and both pro-inflammatory and prothrombotic state in patients with metabolic syndrome and coronary artery disease[J].Kardiol Pol,2011,69(4):319-326.
[5]Ruggiero C,Cherubini A,Ble A,etal.Uric acid and inflammatory markers[J].Eur Heart J,2006,27(10):1874-1181.
