兔肺VX2鳞癌移植瘤射频消融后残存肿瘤ERCC1表达的变化
2013-09-14马连君周乃康祁彦君刘慧峰赵亚超郑梦利
马连君 周乃康 祁彦君 刘慧峰 赵亚超 郑梦利
射频消融(radiofrequency ablation, RAF)是通过射频电流引起离子振荡和极性生物大分子极性转换,造成摩擦,使靶区组织升温,导致凝固性坏死的一种局部热损毁手段,具有操作方便、创伤小、恢复快的特点[1]。在胸部恶性肿瘤领域,RFA主要用于不能耐受手术的早期非小细胞肺癌(non-small cell lung cancer, NSCLC)和肺内转移肿瘤的治疗[2]。随着RFA应用的普及,人们发现残存肿瘤细胞是影响其远期疗效的最主要因素[3,4],RFA联合铂类药物化疗是减少术后肿瘤细胞残存的有效手段之一,但在具体的结合模式方面,尚缺乏统一认识[5,6]。近年来,人们对RFA治疗后残存肿瘤细胞的一些生物学特性改变进行了深入研究[7-10]。ERCC1表达情况常用作肺癌对铂类化疗药物敏感性的预测指标,也用作肺癌患者预后指标[11],目前尚无肺肿瘤RFA治疗后残存肿瘤细胞ERCC1表达情况的研究报道。兔VX2肿瘤源于Shop病毒诱导的兔乳头状瘤衍生鳞癌,有高侵袭性和高转移性,可在多种兔子、多种脏器建立移植瘤模型[12]。为此,我们采用免疫组织化学方法对RFA治疗后兔肺内残存VX2鳞癌细胞ERCC1表达情况进行了研究。
1 材料与方法
1.1 荷瘤动物模型制备和分组 70只健康纯种新西兰白兔,3月-4月龄,体重2.0 kg-2.5 kg,雌雄不限(由解放军总医院实验动物中心提供);肌肉注射3%戊巴比妥钠(1 mL/kg)麻醉后,右胸壁脱毛,采用组织块悬液肺内注射法[12]建立VX2鳞癌肺内移植瘤模型(VX2鳞癌细胞株由解放军总医院肿瘤中心提供);然后随机分为对照组10只,RFA组60只。RFA组再按时间分为0 d(即时)、1 d、3 d、5 d、7 d、14 d共6个组,每组10只。
1.2 RFA治疗和取材 待新西兰白兔肺内VX2鳞癌生长至最大径超过10 mm后进行RFA治疗。以前述方法麻醉,3 mm层厚连续胸部CT扫描定位,置入10针集束电极,确认其尖端位于肿瘤中心后,控制电极展开直径不超过8 mm。开启RF2000型射频机(RadiotherapeuticTM公司生产),起始输出功率为30 W,每分钟升高10 W,最高输出功率60 W,治疗4 min,退出电极。CT扫描有无血、气胸发生,并及时进行胸腔穿刺治疗。术后常规饲养,并肌肉注射青霉素160万单位/天(0 d-3 d)。各RFA组实验动物按相应时间点处死,取凝固性坏死边界内外各3 mm的肿瘤组织,4%中性甲醛固定后,常规制备石蜡切片,HE染色观察,以同时含有凝固性坏死肿瘤和残存肿瘤的组织为合格标本,否则为不合格标本。对照组实验动物仅置入并展开电极,不进行RFA治疗即处死,取周边的肿瘤组织作为研究标本。
1.3 免疫组织化学染色 对照组和RFA组合格标本的石蜡块连续4 μm厚切片,按Envision法进行免疫组织化学染色。即用型鼠抗兔ERCC1单克隆抗体(克隆号:8F1)及免疫组织化学检测试剂盒购自福州迈新生物技术开发有限公司,实验步骤按试剂盒说明书进行。以提供的阳性切片在同一条件下染色作为阳性对照,用PBS替代一抗作为阴性对照。利用Image-Pro Plus 6.0软件进行图像分析,以细胞核内发现棕黄色颗粒为阳性,每例标本在400倍光镜下选取5个有代表性的区域进行计数,共计数500个-1,500个肿瘤细胞,计算阳性细胞百分率。
1.4 统计学处理 采用SPSS 13.0软件进行数据分析,肿瘤细胞ERCC1表达的阳性百分率采用Mean±SD表示,各RFA组均同对照组进行比较,采用t检验,P<0.05为差异有统计学意义,检验和P值均为双侧。
2 结果
2.1 合格标本数量 RFA组共获得48例合格标本。在12例不合格标本中,7例因为实验动物死于RFA并发症未达相应时间点而剔除(大量气胸2例,大量血胸1例,广泛肺不张4例);其余5例因HE染色未见残存肿瘤细胞,不符合本实验要求而剔除。
2.2 残存肿瘤的分布 对RFA组合格标本HE染色观察发现,绝大多数残存VX2鳞癌细胞位于凝固性坏死灶周边,成片存在(图1);在凝固性坏死灶内较大血管周围偶见残存肿瘤细胞;凝固性坏死灶的其它区域未见残存肿瘤细胞。
2.3 ERCC1免疫组织化学染色结果 对照组肿瘤细胞以及RFA组残存肿瘤细胞均见ERCC1表达(图2),而凝固性坏死的肿瘤细胞未见ERCC1表达。对照组(n=10)肿瘤细胞ERCC1表达阳性率为32.9%±2.5%;1 d(n=7)、3 d(n=6)、5 d(n=8)组残存肿瘤细胞的ERCC1表达阳性率分别为50.7%±1.4%、53.7%±1.6%和36.9%±2.5%,明显高于对照组(P<0.05),尤其以3 d组最高(t=18.23, P<0.001);而0 d(n=9)、7 d(n=10)、14 d(n=8)组的残存肿瘤细胞ERCC1表达阳性率分别为31%±2.1%、33.7%±1.4%和32.8%±1.4%,同对照组比较无明显差异(P>0.05)。
3 讨论
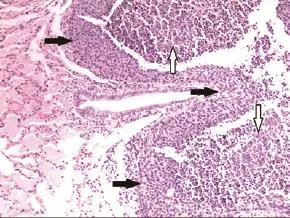
图 1 兔肺内VX2鳞癌RFA治疗后的残存肿瘤细胞和凝固性坏死肿瘤细胞(HE,×100)。白色箭头:凝固性坏死的肿瘤细胞;黑色箭头:残存肿瘤细胞。Fig 1 Residual cells and coagulation necrosis cells of VX2 squamous carcinoma in rabbit lung after RFA (HE, ×100). Black arrows: residual cells; White arrows: coagulation necrosis cells. RFA: radiofrequency ablation.
肺内肿瘤RFA治疗效果同肺的组织学特点密切相关。由于大量气体的存在,导致肺内电传导和热传导的效应远低于其它实质性脏器;另外,在肺肿瘤周边持续存在的血流、气流又造成明显的“散热效应”。这两种因素导致RFA靶区周边以及靶区内部较大血管周围容易形成肿瘤残存[13]。虽然,近年通过改良电极等手段扩大了消融范围,但残存肿瘤问题仍没有得到根本解决[4],肺内恶性肿瘤RFA治疗后残存肿瘤发生率为12%-40%[1]。在本研究中,我们通过控制电极展开范围、输出功率和治疗时间的方法,建立了兔VX2鳞癌肺移植瘤RFA治疗后的残存肿瘤模型。通过HE染色观察发现,这种模型的残存肿瘤细胞大多位于凝固性坏死灶的周围,在较大血管周围发现少量的残存肿瘤细胞,这一结果同其它文献报道[1,4,13,14]相吻合。采用这种方法建立的兔肺内肿瘤RFA后残存肿瘤模型,方法简单、安全,成功率高,能够很好的模拟RFA后肺内残存肿瘤的实际状态,为相关研究提供了合适的平台。
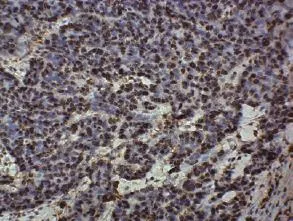
图 2 RFA治疗后兔肺内残存VX2鳞癌细胞ERCC1的表达 (IHC, ×400)Fig 2 ERCC1 expression of in residual VX2 squamous carcinoma cells in rabbit lung after RFA (IHC, ×400)
RFA治疗后残存肿瘤对于肺肿瘤患者远期生存率的影响很大。von Meyenfeldt等[14]报道肺转移瘤患者RFA治疗后有肿瘤残存者3年生存率为49%,而无肿瘤残存者3年生存率为79%。近年来,人们尝试联合含铂类药物化疗,以减少RFA治疗后残存肿瘤细胞,提高治疗效果,但是在铂类药物给药时机方面尚缺乏统一的认识[5,6]。铂类药物通过造成DNA链间交联引发的一系列反应最终导致细胞死亡,这种DNA链间交联可以被细胞内的核酸切除修复(nucleotide excision repair, NER)机制清除,从而修复铂类药物造成的DNA损伤,消弱其细胞毒性,导致耐药。ERCC1是NER的限速酶,是公认的反映NER功能的生物标记物,临床上常作为判断肿瘤细胞对铂类药物敏感性的标志物使用[11]。Olaussen等[15]经对761例NSCLC手术标本的ERCC1表达分析,发现术后含铂类药物化疗能延长ERCC1低表达患者的生存,但对于ERCC1高表达的患者无益处;并且ERCC1高表达可能意味着对铂类耐药。另一方面,ERCC1表达情况与NSCLC患者的预后也密切相关[16,17],ERCC1高表达的患者预后好于ERCC1低表达的患者,其原因是ERCC1低表达提示NER功能低下,容易导致DNA损伤积累增加,故患者预后差;而ERCC1高表达则相反。近期的一些研究[7-10]发现RFA治疗后残存肿瘤细胞的增殖、侵袭以及转移能力发生了改变,但关于ERCC1表达变化的研究尚未见报道。本研究采用免疫组织化学方法检测了RFA治疗后兔肺内VX2鳞癌残存肿瘤细胞ERCC1表达,结果显示在RFA治疗后1 d-5 d内残存肿瘤细胞ERCC1表达明显高于对照组水平,5 d后降至对照组水平。这一现象提示肺内残存的VX2鳞癌细胞受亚致死性热损伤后NER功能增强,这可能是一种自身保护性反应[18],但这种反应的可能导致铂类药物的细胞毒性下降,影响化疗效果。结合Olaussen等[15]的研究结果,我们认为在RFA治疗后5 d内给予铂类药物化疗,可能效果不佳。另外,因在RFA治疗5 d后兔肺内残存VX2鳞癌细胞ERCC1表达阳性率降至对照组水平,故从判断预后角度看,无明显影响。
本研究仅是在动物模型上进行的肺内肿瘤RFA治疗后残存肿瘤ERCC1表达改变的初步探索,对于判断RFA治疗后铂类药物化疗时机还存在一定的局限性和不足之处。肺内肿瘤有多种细胞类型,而本研究仅为一种肿瘤细胞的实验结果,故有待其它类型肿瘤细胞表达数据及临床治疗研究的佐证。另外,影响铂类药物化疗效果的因素还有很多,比如RFA治疗后残存肿瘤细胞的细胞周期改变、肿瘤局部血液供应改变等,故在这些方面还需要深入研究。
