燕麦嗜酸菌鞭毛素的提纯及其活性检测
2013-09-13伍甜刘莹余超边强田芳黄琼陈华民何晨阳
伍甜 刘莹 余超 边强 田芳 黄琼 陈华民 何晨阳
鞭毛素(flagellin)是细菌鞭毛的主要组分,不仅与鞭毛运动性有关,而且可以作为病原相关分子模式(PAMP)激发植物的免疫反应(PTI)[1]。其N 端有一个由 22 个氨基酸组成的保守肽段 flg22,通过与植物受体FLS2 的识别及其信号传导,最终诱导了拟南芥、番茄和烟草等植物的防卫反应[2-5]。同样,通过flg22与水稻受体 OsFLS2 的识别作用,也可引起水稻的防卫反应,但这种反应很微弱;而flg22或鞭毛素却能激发过表达OsFLS2的水稻悬浮细胞强烈的防卫反应[6]。燕麦嗜酸菌(Acidovorax avenae sub.avenae,简称Aaa)不亲和菌株N1141的鞭毛素能够引起水稻过敏反应,并伴随着大量H2O2的产生[7,8]。表明细菌鞭毛素作为PAMP对单子叶植物水稻PTI 的诱导作用机理比较复杂,有必要进行深入的探究。
本研究采用机械震荡、丙酮沉淀以及离子交换层析进行了蛋白提纯,并对其诱导水稻产生 H2O2的能力进行测定,旨在探索一种能够大量提纯的可行方法,并且获得提纯、有活性的鞭毛素蛋白,用于后续的水稻 PTI 机理的解析。
1 材料与方法
1.1 材料
1.1.1 试验材料 供试菌株:Aaa菌株NB001由中国检验检疫科学院赵文军研究员提供。水稻品种:日本晴(Oryza sativa ssp.japonica)由本实验室保存。Aaa 菌株NB001与水稻品种日本晴的存在不亲和互作关系。
1.1.2 主要试剂 KB 培养基(20g蛋白胨、10mL甘油、1.5 g K2HPO4、1.5gMgSO4·7H2O、1000mL H2O);2×SDS 电 泳上样缓冲液(0.0615mmol/L Tris-HCl,pH6.8;1% SDS,10% 甘油,5% β-巯基乙醇,0.002%溴酚蓝);染色液(0.125g考马斯亮蓝R250、30mL甲醇、10mL冰乙酸、加H2O定容至100mL);脱色液(30mL甲醇、10mL冰乙酸,加H2O 定 容 至100mL);PBS(0.27 g KH2PO4、1.42 g Na2HPO4、NaCl 8g,KCl0.2 g、调节pH至7.4,加水定容至1L);抗鞭毛素蛋白兔多克隆抗体(华大公司);HRP标记的羊抗兔 IgG 抗体(华大公司);Super Ecl发光液(北京普利莱基因技术有限公司);DAB(AMRESCO公司);蛋白Marker(预染蛋白质Marker Ⅲ)(天根公司)。
1.1.3 仪器和设备 台式恒温振荡器(太仓市实验设备厂);离心机(BECKMAN公司);震荡混匀器(VORTGX公司);HPLC系统(GE公司);阴离子交换柱(GE公司,5mL HiTrapTMSP HP);阳离子交换柱(GE公司,5mL HiTrapTMQP HP);垂直电泳槽(Junyi公司);半干电转仪(Bio-Rad公司);化学发光采集系统(GE公司);水浴锅(PolyScience公司);光学显微镜(OLYPUS 公司)。
1.2 方法
1.2.1 鞭毛素等电点和分子量预测 根据已测序的鞭毛素基因的编码序列,通过Primer 5.0翻译成为氨基酸序列,通过生物信息学网站 ExPASy(http://web.expasy.org/compute_pi/)对 Aaa鞭毛素等电点(pI)、分子量进行预测。
1.2.2 菌体培养与蛋白粗提 接种细菌于4 L KB培养基中,在28℃下震荡(200r/min)培养24h。离心(7000r/min×20min,28℃),收集菌体沉淀;加玻璃珠与30-40mL的ddH2O于离心管中,振荡3min,收集上清为鞭毛素蛋白粗提液。
1.2.3 粗提液检测及纯化前处理 缓慢加入粗提液4倍体积的预冷丙酮,慢慢搅拌至析出大量蛋白,4℃放置过夜,沉淀蛋白。离心除去上清,收集蛋白后,静置于通风厨10min,待残余丙酮挥发。加入50mL ddH2O 重悬蛋白,留取100μL粗提液重悬物,采用5%浓缩胶(上层),12%分离胶(下层)进行SDS-PAGE电泳,检测粗提物纯度。其余粗提物用HCl调节至pH2.0,在常温下搅拌30min,此时鞭毛素蛋白从鞭毛上解离出来,形成解离液。将解离液分成等体积2份,分别稀释至300mL以降低盐浓度,并分别调节 pH至3.5和7.5,用滤膜(2.2μm)过滤,备用。
1.2.4 离子交换层析法纯化 使用高效蛋白纯化仪,分别通过阴、阳离子交换层析进行蛋白纯化。用浓度为15mmol/L的Tris-HCl,pH8.0的缓冲液作为A液(Start buffer),用1mol/L NaCl,通过加入HCl调节pH至7.0作为B液(elution buffer)。先用5倍柱体积的A液以5mL/min流速平衡层析柱,然后以3mL/min的流速,通过上样泵上蛋白样品(阳离子层析柱上pH为 3.5的粗提物样品,阴离子层析柱上pH7.5的粗提物样品)。然后用 2倍柱体积的A液,以5mL/min的流速冲洗层析柱。最后以线性方式洗脱蛋白(盐梯度使用NaCl的浓度由0-1mol/L),洗脱10个柱体积,用UV 214nm 监测洗脱峰,收集出峰的组份。
1.2.5 SDS-PAGE 检测和 Western blot 验证 取出峰组份,吸取20μL与等体积的2×SDS上样缓冲液,沸水浴中煮5min。处理好的样品经5%浓缩胶(上层),12%分离胶(下层)的SDS-PAGE凝胶电泳。一块胶用考马斯亮蓝染色2h,脱色液脱色12h,检测结果。另一块胶用半干转膜系统,在25 V恒压下转膜1h,所用的膜为PVDF膜;然后膜经过5%的脱脂奶粉室温封闭2h,PBS漂洗3次后,加入用PBS 1∶5000稀释的鞭毛素蛋白多克隆抗体,孵育2h,用PBS漂洗3次,加入HRP标记的羊抗兔IgG,孵育2h,使用PBS漂洗4次,最后加入Super Ecl发光液,采集化学信号成像。
1.2.6 生物活性检测 用DAB染色法进行蛋白活性检测。用浸润法将纯化蛋白(浓度0.3mg/mL)接种苗龄14d的水稻叶片,以15mmol/L的Tris-HCl(pH7.0)缓冲液作为对照。对接种部位叶组织取样,浸入含0.01% Triton-X-100和1mg/mL DAB的水溶液中,同时真空30min。叶片在室温下过夜孵育,出现褐色-红色沉淀物质后,再将叶片浸入在95%乙醇∶乳酸∶苯酚(2∶1∶1)中,65℃孵育30min后,用50%乙醇冲洗,再用清水冲洗后,在光学显微镜下观察结果。
2 结果
2.1 鞭毛素等电点和分子量的预测
根据已经测序的Aaa鞭毛素的基因序列,通过生物信息学分析,预测该菌株的鞭毛素 pI 为 5.46,分子量为 49.37kD。
2.2 鞭毛素蛋白的提纯
通过加入玻璃珠剧烈震荡菌体的方法,使鞭毛与菌体分离。采用丙酮沉淀上清的方法,得到了大量的粗提物。SDS-PAGE电泳检测(图 1)发现,粗提物中鞭毛素蛋白含量较高,但是仍然含有较多的杂蛋白。
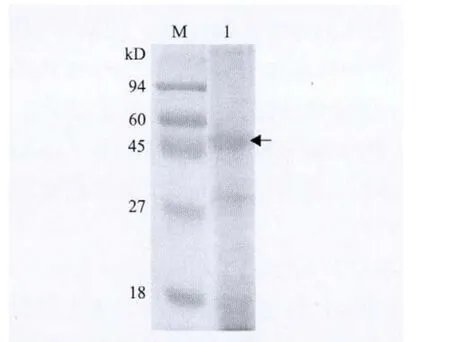
图 1 燕麦嗜酸菌鞭毛素粗提物 SDS-PAGE 电泳分析
在pH3.5或 pH7.5的条件下,粗提物中大量蛋白均能够结合到阳、阴离子层析柱上,洗脱峰较为单一(图 2)。
2.3 鞭毛素蛋白的检测
为了检测蛋白的纯化效果,对离子交换层析组份进行验证。SDS-PAGE结果(图 3)显示,阴、阳离子交换层析纯化后均能获得一条明显的蛋白条带(45kD左右);相比较而言,阳离子交换层析纯化产物更纯,未发现其它蛋白。Western blot分析表明,经阴、阳离子交换层析纯化的为鞭毛素蛋白。

图 2 燕麦嗜酸菌鞭毛素离子交换层析洗脱峰

图 3 纯化后燕麦嗜酸菌鞭毛素的检测
2.4 鞭毛素蛋白的活性检测
通过 DAB 染色分析(图4)显示,纯化后的鞭毛素蛋白能引起水稻叶片产生大量的 H2O2,而缓冲液处理则没有 H2O2的产生,说明纯化得到的鞭毛素蛋白具有生物学活性。

图4 DAB 染色法检测鞭毛素蛋白诱导水稻叶片 H2O2 产生
3 讨论
由于细菌鞭毛素含量较低,在大规模提纯等方面一直存在一些困难。目前大多数报道采用超高速离心提纯法[9],但由于受到仪器容量、离心条件的限制,提取量少,该法不适合大量提取。本研究对燕麦嗜酸菌鞭毛素提取和纯化方法进行了不同尝试,采用机械震荡、丙酮沉淀以及离子交换层析,成功地获得了纯化蛋白,为后续的大规模制备提供了技术支撑。
本试验发现:(1)通过玻璃珠机械震荡,使鞭毛更易从菌体上脱落;(2)针对鞭毛素结构较保守、耐受性较强的特点,通过加入丙酮破坏蛋白水化层,使粗提蛋白沉淀,从而有利于在酸性条件下蛋白解离;(3)鞭毛素(pI=5.46)无论带负或正电荷,都可分别结合到阴、阳离子交换层析柱上。但阳离子交换层析的蛋白组份单一,而阴离子交换层析的有较多的杂带。其可能的原因是,在pH=7.5条件下,粗提物中很多杂蛋白也带负电荷,与鞭毛素一起结合到阴离子层析柱上,且结合力相仿,从而进行线性洗脱时,两者一同被洗脱下来;而在pH=3.5条件下,鞭毛素带正电荷,能够结合到阳离子层析柱上,并且能够被洗脱下来;粗提物中杂蛋白在此pH条件,引发变性和空间构象变化,不能结合到阳离子层析柱上,或结合力过大,导致无法洗脱。用1mol/L NaOH对层析柱重生过程中,发现大量杂蛋白被洗脱出来(实验室资料)。
此外,本研究纯化的鞭毛素能引起水稻叶片产生H2O2,表明这种蛋白具有生物活性。鞭毛素是一种PAMP能够引起水稻的PTI。因此,这种纯化的、具有生物活性的鞭毛素蛋白可用于后续的水稻 PTI分子机理的解析。
4 结论
成功地组合利用机构震荡、丙酮沉淀和离子交换层析法,从Aaa中提纯了具有生物活性的鞭毛素蛋白。
[1] 武晓丽, 陈华民, 吴茂森, 等.细菌鞭毛素对植物免疫防卫反应及其信号机制的激发[J].植物保护, 2011, 37(3):12-16.
[2] Felix G, Duran JD, Volko S, Boller T.Plantshave a sensitive perception system for themost conserved domain of bacterial flagellin[J].The Plant Journal, 1999, 18(3):265-276.
[3] Robatzek S, Bittel P, Chinchilla D, et al.Molecular identification and characterization of the tomato flagellin receptor LeFLS2, an orthologue of Arabidopsis FLS2 exhibiting characteristically different perception specificities[J].Plant Molecular Biology, 2007, 64(5):539-547.
[4] Meindl T, Boller T, Felix G.The bacterial elicitor flagellin activates its receptor in tomato cells according to the address-message concept[J].The Plant Cell, 2000, 12(9):1783-1794.
[5] Hann DR, Rathjen JP.Early events in the pathogenicity of Pseudomonas syringae on Nicotiana benthamiana[J].The Plant Journal,2007, 49(4):607-618.
[6] Takai R, Isogai A, Takayama S, et al.Analysis of flagellin perceptionmediated by flg22 receptor OsFLS2 in rice[J].Molecular Plant-Microbe Interactions, 2008, 21(12):1635-1642.
[7] Hirai H, Takai R, Iwano M, et al.Glycosylation regulates specific induction of rice immune responses by Acidovorax avenae flagellin[J].Journal of Biological Chemistry, 2011, 286(29):25519-25530.
[8] Takakura Y, Che FS, Ishida Y, et al.Expression of a bacterial flagellin gene triggers plant immune responses and confers disease resistance in transgenic rice plants[J].Molecular Plant Pathology,2008, 9(4):525-529.
[9] Kobayashi T, Rinker JN, Koffler H.Purification and chemical properties of flagellin[J].Arch Biochem Biophys, 1959, 84:342-362.
