纳豆激酶生产菌BSNK-5鉴定及发酵条件优化
2013-09-13李淑英聂莹杜欢赵仲麟袁超李燕宋晓燕唐选明
李淑英 聂莹 杜欢 赵仲麟 袁超 李燕 宋晓燕 唐选明
纳豆激酶(Subtilisin NAT)是由枯草芽孢杆菌分泌表达的高效纤维蛋白溶解酶,最早从传统的日本大豆发酵产品纳豆中发现[1]。纳豆激酶对纤维蛋白显示了极高的底物特异性[2],其血栓溶解活性是纤溶酶的4倍[3,4]。纳豆激酶可以直接溶解交联状的血栓块,还可以催化血纤维蛋白溶酶原转化为血纤维蛋白溶酶,增加体内血栓溶解因子的合成,失活纤维蛋白溶解抑制剂等[4-7]。纳豆激酶除了溶解血栓外,还可以降血压、血脂和胆固醇[8],诱导晚期玻璃体分解,治疗玻璃体视网膜紊乱病人等[6]。与临床应用的溶栓药物相比,纳豆激酶具有溶纤活性高、安全可靠、无毒副作用、半衰期长、在胃肠道中稳定性好等优点。该蛋白除了静脉注射外,还可以口服,生产成本低廉[6,9],具有重要的开发价值。
优化培养基组成和发酵工艺,可以明显提高芽孢杆菌的纳豆激酶产量[9-11]。本试验对分离筛选的纳豆激酶生产菌BSNK-5进行了菌落形态观察和分子鉴定;并采用单因素和正交试验对筛选菌株产纳豆激酶的液体发酵条件进行了初步研究,以期提高纳豆激酶产量,为该酶的进一步扩大培养奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种 纳豆枯草芽孢杆菌(Bacillus natto)BSNK-5,由本实验室分离并保存。
1.1.2 主要试剂 纤维蛋白原(牛血,批号:140626-201009)、尿激酶标准品(1280U/支)和凝血酶(560U/支)均购于中国药品生物制品检定所,LB Broth Ultrapure(USB),酵母浸粉(南通香地生物有限公司),胰蛋白胨(OXOID),其余试剂均为国产分析纯。
1.1.3 培养基 斜面和种子培养基:LB培养基。液体发酵培养基:氮源,碳源,Na2HPO40.6%,NaH2PO40.1%,MgSO40.05%,CaCl20.02%,pH7.0。1.1.4 仪器 立式压力蒸汽灭菌锅(YXQ-LS-50A,上海博迅实业有限公司医疗设备厂)、恒温培养振荡器(ZHWY-200H,上海智城分析仪器制造有限公司)、台式高速离心机(TG16MW,湖南赫西仪器装备有限公司)、电热恒温培养箱(DHP-9082型,上海一恒科学仪器有限公司)。
1.2 方法
1.2.1 菌种鉴定 形态学鉴定:LB培养基培养菌株
BSNK-5,用光学显微镜和扫描电子显微镜观察拍照。
分子生物学鉴定:提取BSNK-5的基因组,细菌16S rDNA扩增引物及方法参照文献[12],扩增片段送Invitrogen公司测序。测序结果在NCBI网站利用Blast进行比对,调出相似序列,用Clustal X1.83和 MEGA 3.1 软件构建系统发育树[13]。
1.2.2 菌种的培养 用接种环挑取斜面菌种,接于种子培养基(装液量10mL/50mL)中,37℃,200r/min摇床培养24h。然后根据试验设计,以不同的接种量接于液体发酵培养基(装液量20mL/100mL)中,设置不同温度,200r/min摇床培养不同时间。
1.2.3 产酶条件的优化
1.2.3.1 最适氮源优化 固定碳源为2%的葡萄糖,分别采用浓度为1%的大豆蛋白胨、胰蛋白胨、蛋白胨和酵母浸粉为氮源,其他试剂同1.1.3配置液体发酵培养基。以3%的接种量接菌种于液体发酵培养基中,37℃、200r/m摇床培养72h。离心收集上清液测纳豆激酶活力,以确定最佳氮源。每个试验重复3次。
1.2.3.2 最适碳源优化 据1.2.3.1确定最佳氮源为酵母浸粉,故采用氮源为1%的酵母浸粉,碳源分别采用浓度为2%的葡萄糖、麦芽糖、蔗糖和木糖,其他试剂同1.1.3配置液体发酵培养基。以3%的接种量接菌种于液体发酵培养基中,37℃、200r/min摇床培养72h。离心收集上清液测纳豆激酶活力,以确定最佳碳源。每个试验设3个重复。
1.2.4 酶活测定方法(纤维蛋白平板法)琼脂糖-纤维蛋白平板的配制:含有1%琼脂糖的pH7.2 PBS溶液,50℃恒温水浴45min,加入凝血酶(最终活性0.05U/mL)和同样温度下水浴10min的等量含有0.1%纤维蛋白原的pH7.2 PBS溶液,混匀。9cm×9cm的培养皿加入35mL此溶液,凝固后用直径5mm打孔器打孔,上样10μL(菌株发酵液的上清液),37℃恒温培养18h,测量溶解圈的直径,计算溶解圈的面积,根据尿激酶标准曲线计算酶的活力单位。
尿激酶标准曲线的制作参考马明等[14]的方法。
2 结果
2.1 BSNK-5菌种鉴定
2.1.1 形态特征 LB平板划线,37℃培养24h后,菌落圆形,乳白色,不透明,边缘不整齐,表面干燥,有皱褶,用接种环挑菌落有拉丝现象,菌落与培养基不结合,菌落正反面颜色相同。显微镜下个体形态观察,菌株杆状,两端钝圆,革兰氏染色呈阳性,产芽孢,芽孢椭圆形,中生或近中生(图1)。

图1 BSNK-5显微镜形态观察
2.1.2 16S rDNA序列分析及系统发育构建 PCR扩增所得BSNK-5菌株16S rDNA全长1509bp,将BSNK-5的16S rDNA测序结果经Blast 比对,与BSNK-5菌株16S rDNA同源性较高的菌株均为枯草芽孢杆菌菌株,从中选择15条同源性高于99%的16S rDNA序列构建系统发育树,结果(图2)显示,BSNK-5菌株与Bacillus subtillis 属菌株在同一分枝上,结合菌株形态特征,初步鉴定BSNK-5为枯草芽孢杆菌属菌株。

图2 BSNK-5的系统发育树
2.2 尿激酶的标准曲线
测量不同浓度尿激酶在纤维蛋白平板上2个互相垂直的溶解圈直径,并计算溶解圈的面积,重复试验3次,求平均值,制作尿激酶标准曲线,得出了尿激酶的活力与溶解圈面积呈线性关系,结果见图3。

图3 尿激酶标准曲线
由图3可知,尿激酶标准曲线线性关系为y=1.9769x-106.33,R2=0.9824。此标准曲线可用于测定纳豆激酶的活性,根据纳豆激酶溶解圈面积大小,可计算出纳豆激酶的纤溶活性,即相当于尿激酶的活力单位。
2.3 产酶条件的优化
2.3.1 最适氮源的优化 固定碳源为2%的葡萄糖,分别采用浓度为1%的大豆蛋白胨、胰蛋白胨、蛋白胨和酵母浸粉为氮源,其他试剂同1.1.3配置液体发酵培养基。以3%的接种量接菌种于液体发酵培养基中,37℃、200r/min摇床培养72h。离心收集上清液测纳豆激酶活力,以确定最佳氮源。每个试验重复3次,结果见图4。

图4 不同氮源对菌株产纳豆激酶的影响
由图4可知,不同氮源对纳豆激酶的产生有很大的影响,4种氮源的产酶量差距很大,以酵母浸粉为最高,达到1115U/mL,大豆蛋白胨其次,胰蛋白胨最低。酵母浸粉是微生物源的培养基成分,相比于动植物源蛋白胨和大豆蛋白胨,可能更易于微生物的吸收利用。故选取酵母浸粉为最佳氮源。
2.3.2 最适碳源的优化 由图5可知,4种碳源均适宜菌种的发酵,产酶量都较高,单糖葡萄糖和木糖的产酶量相当,二糖蔗糖和麦芽糖的产酶量相当;但以二糖为碳源时BSNK-5的产酶量较单糖的产酶量高,而两种二糖中以麦芽糖为碳源时菌种产酶量最高,达到986U/mL,与李文亮等[15]的研究一致,且麦芽糖的价格比较适宜,来源比较广泛,适宜工业化生产,故碳源采用麦芽糖为最佳。
2.3.3 培养条件对产酶量的影响 本研究在确定了最佳氮源和碳源的试验基础上设计6因素5水平的完全随机正交试验,考察不同浓度的氮源和碳源,不同起始pH的发酵培养液,不同接种量、培养温度和发酵时间对BSNK-5发酵产纳豆激酶的影响。正交试验设计见表1,试验结果见表2。

图5 不同碳源对菌株产纳豆激酶的影响

表1 正交试验设计简表
由表2可知酵母浸粉和麦芽糖的百分含量,发酵培养基的起始pH值,菌种接种量,培养温度,发酵时间对BSNK-5液体发酵产纳豆激的量有明显影响。25个平行试验中有2个试验结果是相同的,酶活最高达到1160U/mL,这两个最佳的液体发酵培养条件分别为:(1)2%的酵母浸粉、3%的麦芽糖、最适pH为6.5、接种量为5%、培养温度为30℃、培养时间为60h;(2)2.5%的酵母浸粉、2%的麦芽糖、最适pH为7.5、接种量为3%、培养温度为30℃、培养时间为72h。
3 讨论
纳豆激酶突出的生物学功能,特别是在血栓溶解方面的优势使其成为了当今研究的热点。目前关于纳豆激酶的研究主要是提高该酶的产量,主要途径集中于以下几个方面。
首先,筛选纳豆激酶高产菌株。自从1987年Sumi等[1]第一次在纳豆食品中发现了纳豆激酶以来,人们相继在一些海洋生物[14],如skipjack shiokara[17,18],日本纳豆[5],韩国的hungkook-jang soy sauce[19,20],Doen-jang[21],台湾土壤[22],中国的豆豉[2,23]和亚洲发酵虾酱[24]中分离到了纳豆激酶生产菌。为了得到更多优势菌株,人们仍在不同的产品和环境中筛选纳豆激酶生产菌株。
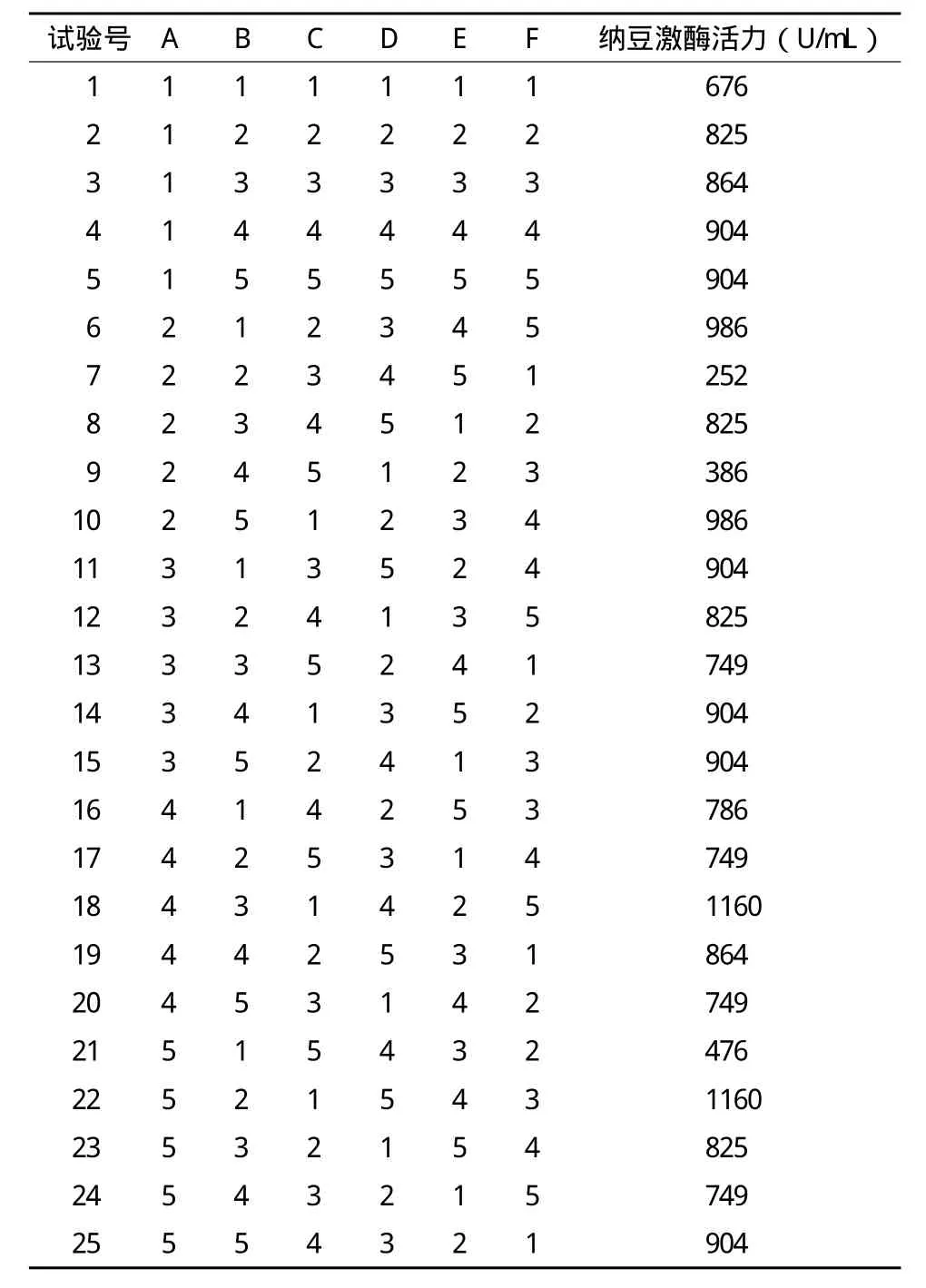
表2 正交试验结果
其次,通过物理或化学方法诱变选育纳豆激酶高产菌株。夏丽等[25]通过紫外线直接照射涂菌蛋白平板,筛选到一个高产突变株,其纤溶活性比出发菌株提高了8.81%。关志伟等[26]通过盐酸羟胺和紫外线复合诱变获得一株高产纳豆激酶突变株,其产酶活性比野生菌提高了68%。刘新梅等[27]通过对纳豆菌原生质体紫外诱变得到一株高产纳豆激酶菌株,其发酵液的酶活力比诱变前提高了74.5%。
再者,对纳豆激酶生产菌发酵条件优化提高纳豆激酶的产量。优化培养基组成和发酵工艺,可以明显提高芽孢杆菌的纳豆激酶产量[9-11]。研究发现,液体发酵培养基的氮源、碳源及其百分含量,液体发酵培养基的pH值,菌种接种量,培养温度,发酵时间等各个因素都会明显影响纳豆芽孢杆菌的生长状态,从而影响到酶的产量。芽孢杆菌在营养缺乏或不适的环境极易形成芽孢,进入休眠状态,从而停止产酶,这也是芽孢杆菌在实际生产应用中的一个瓶颈。
本研究对实验室分离的纳豆激酶高产菌株BSNK-5进行鉴定,结合形态学观察确认为枯草芽孢杆菌属菌株。对BSNK-5发酵产纳豆激酶的各个因素进行了初步的探讨研究,通过优化该菌株发酵过程中的发酵培养基的氮源、碳源及其百分含量,液体发酵培养基的pH值,菌种接种量,培养温度和发酵时间,尽量使菌株处于最适生长环境,提高纳豆激酶的产量。试验结果也进一步证实在优化条件下,BSNK-5的纳豆激酶产量明显提高,高达1160U/mL。与之前相比(发酵条件优化前BSNK-5的纳豆激酶酶活力为303U/mL),活性提高到283%。
4 结论
通过形态学观察和分子鉴定,BSNK-5为枯草芽孢杆菌属菌株。对影响BSNK-5液体发酵产纳豆激酶的不同因素进行了初步探讨研究。由液体发酵产酶的单因素和正交试验结果表明纳豆激酶的最佳产酶条件为:(1)2%酵母浸粉,3%麦芽糖,0.6%Na2HPO4,0.1% NaH2PO4,0.05% MgSO4,0.02%CaCl2,pH6.5,接种量为5%,30℃发酵培养60h;(2)2.5%酵母浸粉,2%麦芽糖,0.6%Na2HPO4,0.1%NaH2PO4,0.05% MgSO4,0.02% CaCl2,pH7.5,接种量为3%,30℃发酵培养72h。在最适产酶条件下纳豆激酶的活性为1160U/mL,是之前的283%。
[1] Sumi H, Hamada H, Tsushima H, et al.A novel fibrinolytic enzyme(nattokinase)in the vegetable cheese natto;a typical and popular soybean food in the Japanese diet[J].Experientia, 1987, 43(10):1110-1111.
[2] Peng Y, Huang Q, Zhang R, et al.Purification and characterization of a fibrinolytic enzyme produced by Bacillus amyloliquefaciens DC-4 screened from douchi, a traditional Chinese soybean food[J].Comp Biochem Physiol Biochem Mol Biol, 2003, 134(1):45-52.
[3] Fujita M, Hong K, Ito Y, et al.Thrombolytic effect of nattokinase on a chemically induced thrombosismodel in rat[J].Biol Pharm Bull, 1995, 18(10):1387-1391.
[4] Tai MW, Sweet BV.Nattokinase for prevention of thrombosis[J].Am J Health-Syst Pharm, 2006, 63(12):1121-1123.
[5] Fujita M, Nomura K, Hong K, et al.Purification and characterization of a strong fibrinolytic enzyme(nattokinase)in the vegetable cheese Natto, a popular soybean fermented food in Japan[J].Biochem Biophys Res Commun, 1993, 197(3):1340-1347.
[6] Sumi H, Hamada H, Nakanishi K, et al.Enhancement of the fibrinolytic activity in plasma by oral administration of nattokinase[J].Acta Haematol, 1990, 84(3):139-143.
[7] Urono T, Ihara H, Umemura, et al.The profibrinolytic enzyme subtilisin NAT purified from Bacillus subtilis cleaves and inactivates plasminogen activator inhibitor type1[J].J Biol Chem, 2001, 276(27):24690-24696.
[8] Iwai K, Nakaya N, Kawasaki Y, et al.Antioxidative functions of natto, a kind of fermented soybeans:effect on LDL oxidation and lipidmetabolism in cholesterol-fed rats[J].J Agric Food Chem,2002, 50(12):3597-3601.
[9] Deepak V, Kalishwaralal K, Ramkumarpandian S, et al.Optimization ofmedia composition for Nattokinase production by Bacillus subtilis using response surfacemethodology[J].Bioresource Technology,2008, 99(17):8170-8174.
[10] Cho YH, Song JY, Kim MK, et al.Production of nattokinase by batch and fed-batch culture of Bacillus subtilis[J].New Biotechnology, 2010, 27(4):341-346.
[11] Kwon EY, Kim KM, Kim MK, et al.Production of nattokinase byhigh cell density fed-batch culture of Bacillus subtilis[J].Bioprocess Biosyst Eng, 2011, 34:789-793.
[12] 闫建芳, 齐小辉, 高晓梅, 等.拮抗放线菌B-20的种类鉴定及其16S rDNA序列分析[J].微生物学杂志, 2008, 28:26-29.
[13] 蒋茜.海洋放线菌GY-4的鉴定及其抗菌物质研究[D].南京:南京农业大学, 2011.
[14] 马明, 杜金华, 于玲, 等.高纳豆激酶酶活枯草芽孢杆菌的筛选及菌种鉴定[J].中国食物与营养, 2006(8):29-32.
[15] 李文亮, 边鸣镝, 王海波, 等.高产纳豆激酶突变菌株产酶条件的研究[J].大豆科学, 2010, 29(4):692-695.
[16] Chang CT, Fan MH, Kuo FC, et al.Potent fibrinolytic enzyme from amutant of Bacillus subtilis IMR-NK1[J].J Agric Food Chem,2000, 48(8):3210-3216.
[17] Kim SH, Choi NS.Purification and characterization of subtilisin DJ-4 secreted by Bacillus sp.strain DJ-4 screened from Doen-Jang[J].Biosci Biotechnol Biochem, 2000, 64(8):1722-1725.
[18] Kim W, Choi K, Kim Y, et al.Purification and characterization of a fibrinolytic enzyme produced from Bacillus sp.strain CK 11-4 screened from Chungkook-Jang[J].Appl Environ Microbiol,1996, 62(7):2482-2488.
[19] Nakajima N, Mihara H, Sumi H.Characterization of potent fibrinolytic enzymes in earthworm, Lumbricus rubellus[J].Biosci Biotechnol Biochem, 1993, 57(10):1726-1730.
[20] Nakajima N, Taya N, Sumi H.Potent fibrinolytic enzyme from the lysate of Katsuwonus pelamis digestive tract(Shiokara):purification and characterization[J].Biosci Biotechnol Biochem,1993, 57(9):1604-1605.
[21] Noh KA, Kim DH, Choi NS, et al.Isolation of fibrinolytic enzyme producing strains from Kimuchi[J].Korean J Food Sci Technol,1999, 31(1):219-223.
[22] Sumi H, Nakajima N, Mihara H.Fibrinolysis relating substances inmarine creatures[J].Comp Biochem Physiol, 1992, 102(1):163-167.
[23] Wang CT, Ji BP, Li B, et al.Purification and characterization of a fibrinolytic enzyme of Bacillus subtilis DC33, isolated from Chinese traditional Douchi[J].J Ind Microbiol Biotehnol, 2006, 33:750-758.
[24] Wong AHK, Mine Y.Novel fibrinolytic enzyme in fermented shrimp paste, a traditional Asian fermented seasoning.J Agric Food Chem,2004, 52(4):980-986.
[25] 关志伟, 等.盐酸羟胺和紫外复合诱变选育纳豆激酶高产菌株[J].食品与发酵工业, 2009, 35(6):71-74.
[26] 夏丽, 沙维, 张丽萍.紫外诱变选育高产纳豆激酶菌株的研究[J].农产品加工·创新版, 2010, 4:29-34.
[27] 刘新梅, 高宇, 董明盛.原生质体紫外诱变筛选纳豆激酶高产菌株[J].食品科学, 2005, 26(11):69-72.
