滇大蓟中黄酮的提取及其对羟基自由基清除作用研究
2013-09-13管春平何艳娇徐成东
管春平,何艳娇,徐成东
(楚雄师范学院化学与生命科学系,云南 楚雄 675000)
黄酮类化合物 (flavones compounds)泛指两个苯环 (A与B)通过三个碳原子相互联结而成的一系列化合物[1],主要包括黄酮、黄酮醇、异黄酮、二氢黄酮、查耳酮等,广泛存在蔬菜、水果、牧草、浆果和药用植物中,大约有4千多种。黄酮类化合物具有广泛的生物活性,可以改善血液循环、降低胆固醇、抑制炎性生物酶的渗出、增进伤口愈合和止痛,它还具有很强的抗氧化活性,可有效清除体内的氧自由基[2]。
滇大蓟[3](Cirsium chlorolepis Petrak),菊科蓟属多年生草本野生药用植物,在滇中大部分地区有分布,生长于山坡或田野沟边、路旁。滇大蓟的营养及药用价值极高,可作蔬菜煮食,具清凉、消炎作用;入药能凉血、止血、散瘀、治吐血、咯血等症,主要含有黄酮和黄酮苷,三萜类、甾体类、挥发油类等化学成分[4]。滇大蓟在云南代替大蓟入药[5],从中提取黄酮还尚未见相关研究报道。探究滇大蓟中黄酮的提取条件及提取液对羟基自由基的清除作用,有利于滇大蓟资源的开发,为今后滇大蓟的利用提供一定的参考。
1 材料与方法
1.1 材料、试剂、仪器
1.1.1 材料
滇大蓟,采于云南石林县,经楚雄师范学院徐成东教授鉴定为菊科蓟属植物滇大蓟。
1.1.2 试剂
无水乙醇、芦丁标准品、水杨酸、氢氧化钠、锌粉、亚硝酸钠、硫酸亚铁、硝酸铝、双氧水、浓氨水、三氯化铁、盐酸、BHT(二丁基羟基甲苯),以上试剂为分析纯;蒸馏水。
准确称取干燥恒重芦丁10mg,加适量70%乙醇溶解并转移至50mL容量瓶中,定容,摇匀,得浓度为0.2mg/mL的芦丁标准溶液。
1.1.3 仪器
722S型光栅分光光度计 (山东高密分析仪器厂)、CP214C电子天平 (奥豪斯仪器有限公司)、HH—S2S恒温水浴锅 (金坛市大地自动化仪器厂)、DFY-500型摇摆式高速中药粉碎机(温岭市林大机械有限公司)。
1.2 实验方法
1.2.1 原料处理
滇大蓟洗净→晒干→粉碎→备用。
1.2.2 黄酮类化合物的提取
称取4.0g滇大蓟粉末,置于圆底烧瓶中,加入50.0mL70%乙醇溶液,装上冷凝装置,在70℃下恒温水浴2h,过滤,制得提取液。
1.2.3 提取液的定性检验[6]
铝盐反应:取提取液1.0mL于试管中,加入几滴1%硝酸铝溶液,振荡。若溶液颜色显黄色,则说明提取液中含有黄酮。
浓氨水反应:取提取液1.0mL于试管中,加入几滴浓氨水溶液,振荡。若溶液显亮黄色,则说明提取液中含有黄酮。
氢氧化钠反应:取提取液1.0mL于试管中,加入几滴4%氢氧化钠溶液,振荡。若溶液显亮黄色,则说明提取液中含有黄酮。
乙酸铅反应:取提取液1.0mL于试管中,加入几滴乙酸铅溶液,振荡。若有黄色沉淀产生,则说明提取液中含有黄酮。
浓硫酸反应:取提取液1.0mL于试管中,加入几滴浓硫酸,振荡。若有溶液显黄色或橙色,则说明提取液中含有黄酮。
1.2.4 黄酮含量的测定[7]
准确吸取 0.2mg/mL的芦丁标准溶液 0.00 mL,0.50mL,1.00mL,1.50mL,2.00mL,2.50mL,3.00mL分别置于25mL比色管中,各加入5%NaNO20.30mL,摇匀,放置6min;加10%Al(NO3)30.30mL,摇匀,放置6min;加4%NaOH 4.00mL,用70%乙醇溶液定容到10mL刻度线,摇匀,放置10min后,以试剂空白为参比,在510nm波长下测定吸光度,并绘制标准曲线。由标准曲线可得回归方程。
准确吸取滇大蓟样品液1.00mL于25mL比色管中,顺序加入5%NaNO20.30mL、10%Al(NO3)30.30mL、4%NaOH 4.00mL,用同浓度乙醇定容到10mL,在510nm波长处以试剂空白作为参比测定吸光度。
将所测吸光度代入回归方程,求出样品液中黄酮浓度,按下式计算黄酮提取得率:
黄酮提取得率 (%)=[(C×V×n)/(M×1000)]×100% (1—1)
式中:C—样品液中黄酮的浓度 (单位:mg/mL);V—样品液体积 (单位mL);n—稀释倍数;M—滇大蓟粉末的质量 (单位:g)。
1.2.5 提取条件的单因素实验
称取3.0g滇大蓟粉末,按1.2.2方法提取黄酮,过滤,滤液转移到50mL容量瓶中,并用相应乙醇定容,制得样品液。按1.2.4方法显色后,在510nm波长处测定其吸光度,平行实验三次。分别进行乙醇浓度、料液比、提取温度及提取时间的选择。
1.2.6 最佳提取条件的选择
在单因素实验的基础上,进行L9(34)正交实验,确定最佳提取条件。
1.2.7 滇大蓟提取液对羟基自由基 (·OH)的清除作用[8—9]
参照Fenton反应[10]的方法建立反应体系模型。采用固定反应时间法,在510nm波长处测反应液的吸光度,并与空白液比较。
反应体系为:在10mL比色管中加入9mmol/LFeSO4溶液2.00mL,9mmol/L水杨酸-乙醇溶液2.00mL,不同体积的滇大蓟提取液,最后加8.8mmol/LH2O22.00mL启动反应,加蒸馏水定容,将反应体系置于37℃的水浴中反应30min,以蒸馏水为参比,以试剂空白作比较,在510nm处测定吸光度。考虑到提取液自身的吸光度,在10mL比色管中加入9mmol/LFeSO4溶液2.00mL,9mmol/L水杨酸-乙醇溶液2.00mL,不同体积的滇大蓟提取液,加蒸馏水定容,反应体系也置于37℃的水浴中反应30min,作为提取液的本底吸收。重复实验三次,并与BHT溶液和芦丁溶液为对照,比较三者对羟自由基的清除能力。
清除率计算公式:·OH清除率 (%)={[A0- (Ax-Ax0)]/A0}×100% (1—2)
式中:A0—空白对照溶液吸光度;Ax—提取液吸光度;Ax0—不加H2O2的提取液的本底吸光度。
2 结果与分析
2.1 提取液定性检验结果
按1.2.3对滇大蓟提取液进行定性检验,结果如表2—1所示。

表2—1 提取液定性检验结果
由表2—1结果可看出,滇大蓟的提取液与上述试剂的反应现象和黄酮与这些试剂的反应现象相吻合,说明滇大蓟的提取液中含有黄酮类化合物。
2.2 黄酮含量测定标准曲线
按1.2.4进行实验,以浓度为横坐标、吸光度为纵坐标绘制标准曲线,结果如图2—1所示。
由标准曲线得回归方程:A=9.9429C-0.00314,R=0.9998。
2.3 提取条件的单因素实验结果
按1.2.5方法进行实验,结果如图2—2、如图2—3、如图2—4、如图2—5所示。
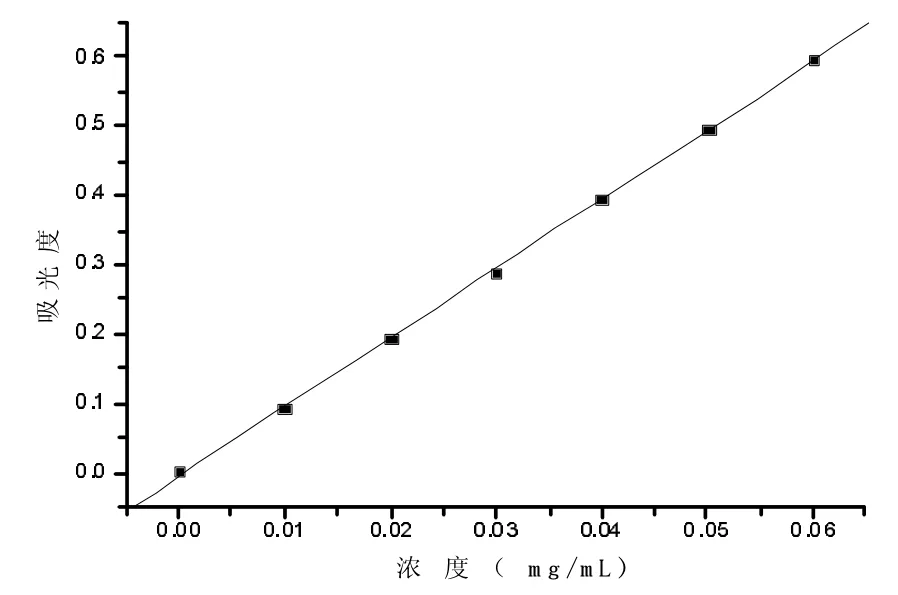
图2—1 芦丁标准曲线

图2—2 乙醇浓度的选择
由图2—2可看出,在其他条件不变的情况下,样品液的吸光度随乙醇溶液浓度的增大而增高,当乙醇溶液浓度为60%时达到最大值,此后随着乙醇溶液浓度的升高,样品液吸光度下降。当乙醇体积分数超过60% 时,高浓度的乙醇反而会导致原料细胞膜性状改变而使得总黄酮难以从细胞中提出,从而导致黄酮提取得率降低[11]。故选用60%的乙醇溶液作提取剂较适宜。
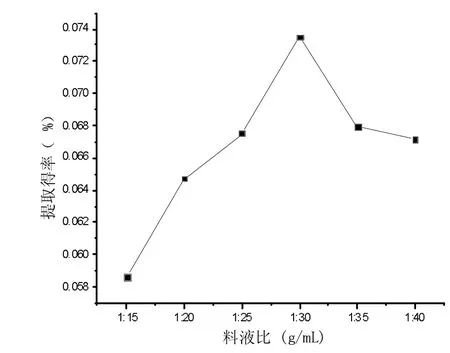
图2—3 料液比的选择

图2—4 提取温度的选择
由图2—3可看出,在其他条件不变的情况下,滇大蓟中黄酮的提取得率随料液比的增大而增大,当料液比为1∶30时黄酮提取得率最大,此后随着料液比的增大,提取得率下降,因此,从滇大蓟中提取黄酮时宜采用1∶30的料液比。
由图2—4可看出,在其他条件不变的情况下,样品液的吸光度随着提取温度的升高而增大,70℃时到达最大,此后随着提取温度的升高,样品液吸光度降低。原因是温度过高,一些蛋白质、糖类等物质大量溶出,导致提取液粘性加大,杂质溶出量增加,从而导致提取率下降[11],近而导致样品液吸光度降低,因此,从滇大蓟中提取黄酮时提取温度选用70℃较为适宜。

图2—5 提取时间的选择
由图2—5可看出,在其他条件不变的情况下,样品液的吸光度随着提取时间的增加而增大,在3h时达到最大值,此后随着提取时间的增长,样品液吸光度下降。因此,从滇大蓟中提取黄酮时提取时间选用3h较为适宜。
2.4 最佳提取条件的选择
根据单因素实验结果,进行L9(34)正交实验。选定的正交实验因素如表2—2,正交实验结果如表2—3所示。

表2—2 正交实验因素水平表
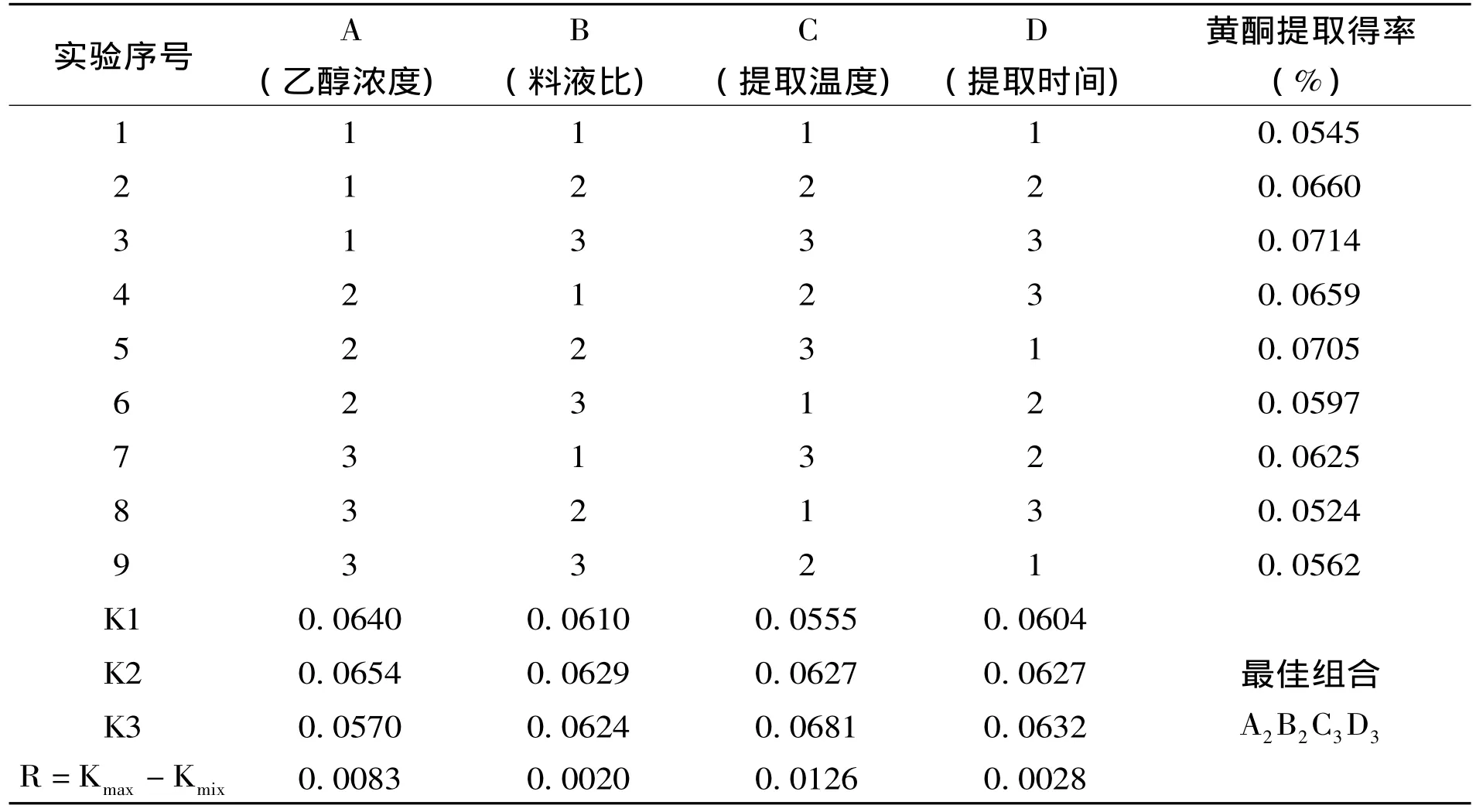
表2—3 正交实验结果
从表2—3可以看出,四个因素对滇大蓟中黄酮提取得率的影响程度是C(提取温度)﹥A(乙醇浓度)﹥D(提取时间)﹥B(料液比),最佳提取条件为A2B2C3D3,即:乙醇浓度为60%,料液比为1∶30,提取温度为80℃,提取时间4h。
在最佳提取条件下进行三次平行实验,结果如表2—4所示。

表2—4 最佳提取条件下实验结果
由表2—4可知,在最佳条件下提取黄酮,平均提取得率可达0.163%。
2.5 滇大蓟提取液对羟基自由基 (·OH)的清除作用结果
按1.2.7方法进行实验,结果如图2—6所示。
由图2—7可知,同浓度同体积的滇大蓟提取液、芦丁溶液和BHT溶液对羟基自由基的清除能力为:滇大蓟提取液>芦丁溶液>BHT溶液,滇大蓟提取液的清除效果较好。
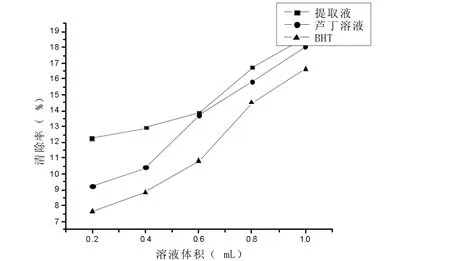
图2—6 滇大蓟提取液、芦丁溶液和BHT对羟自由基的清除
3 结论
用乙醇作为提取剂提取滇大蓟中的黄酮,最佳提取条件为:60%的乙醇溶液,料液比1∶30(g/mL),提取温度为80℃,提取时间为4h,在此条件下,黄酮提取率可达0.163%。
同浓度同体积的滇大蓟提取液、芦丁溶液和BHT(二丁基羟基甲苯)溶液对羟基自由基(·OH)的清除效果为:提取液>芦丁溶液>BHT溶液,表明滇大蓟提取液能较好的清除羟基自由基。
[1]肖崇厚,杨松松,洪筱坤等.中药化学 (第二版)[M].上海:上海科学技术出版社.
[2]魏朝良,于德红,安利佳.黄酮类化合物及其清除自由基机制的探讨 [J].中成药,2005,27 (2):239—241.
[3]谢宗万.汉拉英对照中药材正名词典[M].北京:北京科学技术出版社.
[4]宋泽规,薛伟.大蓟的研究进展 [J].广州化工,2011,39(7):13—15.
[5]植飞,孔令义,彭司勋.中药大蓟的化学及药理研究进展 [J].中草药,2001,32(7):664—667.
[6]郑大成,木合布力·阿布力孜,阿依努尔·吐鲁洪等.昆仑雪菊水溶性黄酮的制备及初步鉴定 [J].亚太传统医药,2010,10(7):18—20.
[7]李燕,曾庆华,陈利梅.正交试验法优选紫苏叶中总黄酮提取工艺 [J].食品工程,2011 (06):148—150.
[8]艾志录,王育红,潘治利等.苹果渣中多酚物质的抗氧化活性研究 [J].食品科学,2006,27 (12):160—163.
[9]黄锁义,罗建华,张丽丹等.茉莉花茎总黄酮提取及其对羟基自由基清除作用 [J].时珍国医国药,2008,19(3):592—593.
[10]刘凤喜,李志东,李娜等.Fenton法中的羟基自由基的测定技术简介 [J].环境研究与监测,2007,15 (4):1—5.
[11]徐玲花,熊亚青,严镇钧等.女贞子总黄酮提取工艺的研究 [J].安徽农业科学,2011,39 (6):3305—3308.
