蛋白质的连接模型及机理研究
2013-09-13杨力权李珍贵
杨力权,桑 鹏,李珍贵
(1.大理学院农学与生物科学学院,云南 大理 671003;2.云南大学云南省生物资源保护与利用重点实验室,云南 昆明 650091)
自然界中蛋白质发挥功能的过程其实就是蛋白质之间或蛋白质与其他生物分子连接和相互作用的过程。因此,阐明蛋白质-配体识别与连接的驱动力及机理对于理解其功能发挥起到非常重要的作用。
1 蛋白质连接的模型
目前,描述蛋白质连接机理的模型主要有以下三种:锁-钥匙模型 (lock-and-key)[1],诱导契合模型 (induced-fit)[2]和构象选择模型 (conformational selection)[3](如图1所示)。
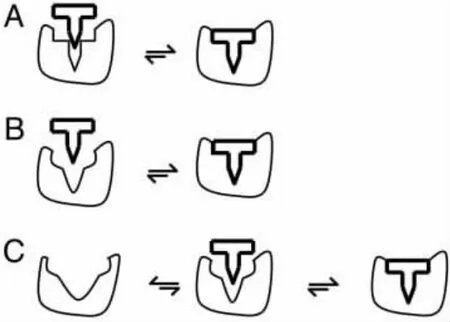
图1 蛋白质-配体连接模型
此图引用并修改于参考文献[3]。
1.1 锁-钥匙模型和诱导契合模型
在锁-钥匙模型中,蛋白质连接部位 (比喻为锁)和配体 (比喻为钥匙)的结构必须是高度互补的,而且蛋白质和配体的结构是刚性的,以保证正确的匹配和连接 (如图1A所示)。在诱导契合模型中,配体的结合能够诱导蛋白质连接部位构象发生变化,使连接部位甚至于整个蛋白质的结构不同于连接前的结构 (如图1B所示)。诱导契合发生的前提是蛋白质的连接部位必须有足够的构象灵活性。
1.2 构象选择模型
构象选择模型是基于自由能图景理论[4]提出的,自由能图景理论已经被广泛用于描述蛋白质的折叠[5],并且逐渐用于描述蛋白质的连接[6]。自由能图景理论描述了蛋白质折叠和连接过程中体系的能量变化与蛋白质构象的关系,三维空间下的自由能图景,纵坐标代表了体系的吉布斯自由能,横坐标代表了蛋白质构象的熵。在蛋白质的自由能图景理论下,连接过程中体系自由能的不断降低伴随着连接中间体构象自由度的逐渐减少,决定了蛋白质连接的自由能图景为漏斗状的,称为连接漏斗[5]。
在漏斗状的自由能图景理论中,蛋白质的连接过程被描述为发生在粗糙的漏斗底部的过程,表现为漏斗底部自由能井的熔合 (蛋白质之间连接)[6]或者漏斗底部自由能井的延伸 (蛋白质与配体连接)[7]。而且,自由能图景底部是粗糙的和动态可变的,也就是说,在天然构型附近存在着多种能量相近、构象不同的构象并存平衡,当有影响体系自由能改变的条件时,构象之间可以发生相互转换,能量图景的形状会随之发生变化。
构象选择模型认为不同的构象并存平衡于粗糙的自由能图景底部,连接过程中配体选择最合适的构象进行连接,使得构象平衡朝向连接的构象移动[5,8](如图1C所示)。与诱导契合模型相似,构象选择模型适合于构象灵活性较高的蛋白质,高灵活性可以降低构象间的能垒,增加配体选择合适构象及构象转换 (平衡移动)的几率。
1.3 几种模型之间的联系
在自由能图景理论下,锁-钥匙模型和诱导契合模型都可以看作是构象选择模型的特例。例如,构象选择模型虽然描述多种构象存在于漏斗底部粗糙的多个能量井中达到共存平衡,但连接的过程只是选择性的发生在最适合构象所存在的唯一能量井中,随后才导致构象平衡朝向复合物形成的构象移动。选择连接的过程与锁-钥匙模型描述的过程相似[5,8]。对于诱导契合模型,虽然连接后的最终构象与连接前的不一样,但最初的选择接触碰撞过程决定了只有接近构象互补的状态才能保证提供足够的连接强度和时间,使得形成的中间体内进一步调整,最终形成连接复合物。因此,最初的碰撞选择是随后的构象调整变化的前提,从这个角度讲,诱导契合模型也可以被认为是构象选择模型的特例。
总的说来,这三种模型并不是孤立存在、相互排斥的,它们在蛋白质分子识别和连接过程中发挥着联合的作用[5,8]。由于构象选择模型包含了锁-钥匙模型和诱导契合模型,在解释蛋白质-配体连接过程中更加全面和合理。在这个模型中,最初的构象选择过程 (通过锁-钥匙)对于相互作用分子最初的识别接触非常重要,决定了连接的特异性;随后的构象调整过程(通过诱导契合)决定了连接的亲和性。
2 蛋白质连接过程的驱动力
虽然蛋白质与配体的连接过程可以用前述的三个模型来解释,但进一步阐明蛋白质-配体连接过程的驱动力对于理解三个模型的机理有很大帮助。
2.1 连接过程的基本热力学属性
与蛋白质折叠过程相似,蛋白质-配体连接过程的驱动力也是蛋白质-配体-溶剂体系吉布斯自由能的降低[5]。在蛋白质-配体连接过程中,体系的吉布斯自由能 (△G),一般可以通过如下的方程表示:

其中,焓变部分 (△H)来源于连接过程中蛋白质-配体-溶剂之间非共价键 (如氢键、范德华力、静电作用等)的形成与断裂;熵变部分 (△S)来源于所有溶剂分子、蛋白质分子和配体分子的构象变化。
正如方程 (1)所描述,体系吉布斯自由能的变化受焓变 (△H)和熵变 (T△S)共同影响,它们对自由能具有相反的影响效果。在连接过程中,负的焓变值意味着发生了放热反应,对降低体系自由能有利;正的焓变值意味着吸热反应,不利于自由能的降低。需要注意的是,连接过程的焓变是整个体系全局性的特性,包含了蛋白质与配体、蛋白质与溶剂、配体与溶剂的相互作用。例如,蛋白质-溶剂,配体-溶剂之间的氢键、静电作用、范德华力的断裂需要吸收能量,导致体系焓变增加 (△H为正值);在蛋白质表面附近发生的蛋白质-配体-溶剂之间非共价键的形成释放能量,导致体系焓变减少 (△H为负值)。连接过程的焓变是这些具体焓变的综合效应,具体的连接控制着具体的焓变。
熵是蛋白质-配体-溶剂体系中能量平均分布的一个程度,能量在体系中尽可能平均分布的趋势会降低最初体系的有序程度,因此,熵也可以看作是体系混乱度和无序程度的一个体现。在连接过程中,熵增加对于降低体系吉布斯自由能有利,熵减少不利于降低自由能。由于蛋白质连接过程体系的复杂性,体系总的熵变 (△Stot)包含三个方面:溶剂熵变 (△Ssolv),构象熵变 (△Sconf),旋转和转换熵变 (△Sr/t)[5,8]。

其中,溶剂熵变 (△Ssolv)是连接过程释放了与结合部位相连的溶剂分子引起的,溶剂分子(水)的混乱度增加,连接过程中的熵增加,对总熵变 (△Stot)增加有利。构象熵变 (△Sconf)是由于在连接过程中蛋白质与配体围绕旋转角度的旋转自由度降低引起的,熵减少,不利于总熵变的增加;旋转和转换熵变 (△Sr/t)是由于复合物的形成导致蛋白质与配体的转换和旋转的自由度降低引起的,同样不利于总熵变的增加。由于熵减少会使自由能增加,对连接不利,因此构象熵变、旋转和转换熵变也被称为熵损失[5]。然而,连接过程使连接部位表面紧密存在的水分子网络得到释放,增加了水分子 (溶剂)的自由度,由于水分子巨大的数量产生了大量的熵增加值,能够克服和抵消由于构象熵变、旋转和转换熵变带来的不利影响,使得总熵变值增加,有利于体系总的吉布斯自由能降低[8]。
2.2 熵焓互补平衡
值得注意的是,方程 (1)所描述的焓变和熵变之间的线性关系导致了一个重要的现象——熵焓互补[9]。换句话说,有利于连接的焓变 (△H为负)(如蛋白质和配体间非共价键的形成)不可避免的会带来不利于连接的熵变 (△S为负)(如非共价键的形成带来的构象自由度的降低);反过来,连接过程产生的有利的熵变 (△S为正)也不可避免的会带来不利的焓变 (△H为正),这个过程导致了连接过程的自由能会有变化和波动,造成体系吉布斯自由能的升高或降低。这种熵焓互补决定连接过程自由能变化的特征,使得很难区分特定配体的连接过程到底是焓驱动还是熵驱动,也使得希望通过修饰配体的结构增强连接的特异性和亲和性变得很困难。
3 不同连接过程的连接机理
区分一个连接过程具体是由熵增加驱动、焓减少驱动还是熵增加和焓减少共同驱动对于理解连接的机理有极大的帮助。这里并不针对具体的配体和具体的蛋白受体讨论连接过程,而作为一般性讨论三种模型的连接机理及具体驱动因素。
3.1 锁-钥匙连接的机理
对于锁-钥匙连接过程的机理,由于蛋白质和配体连接部位结构的高度互补性,连接过程释放了结合部位表面的大量水分子,导致产生的大量溶剂熵增加值 (△Ssolv)对于降低体系自由能起到了实质性的作用。同时,由于蛋白质受体和配体具有高度的构象刚性,连接过程不会发生大的骨架构象变化和侧链的旋转,因此只产生少量的构象熵变 (△Sconf)以及旋转和转换熵变(△Sr/t)降低值。产生的少量熵损失 (△Sconf+△Sr/t)很容易被蛋白质和配体间连接形成的非共价键导致的焓降低值抵消。总结起来,锁-钥匙连接过程的机理主要受溶剂的熵增加所驱动,这也证实了作为溶剂的水分子在连接过程中发挥了重要的作用。由于蛋白质和配体间高度的构象互补性是获得大量熵增加的前提,因此锁-钥匙模型所描述的过程可以用来解释连接的特异性。
3.2 诱导契合连接的机理
对于诱导契合模型,由于缺乏高度的构象互补性,蛋白质和配体表面最初的接触释放了相对较少的水分子数 (相对于锁-钥匙模型)。产生的少量溶剂熵增加值 (△Ssolv)不足以抵消构象的熵损失 (△Sconf+△Sr/t)。然而,蛋白质连接部位的高度构象柔性在适应配体时发生了大的构象调整,使蛋白质和配体之间在结合部位进行全面的接触,形成了大量的非共价键。产生了足够克服熵损耗 (△Sconf+△Sr/t)的巨大负焓变值 (△H为负),大的负焓变值对于蛋白质-配体-溶剂体系总吉布斯自由能的减少起到了实质性的作用。总结起来,诱导契合连接过程主要由大量的焓变减少驱动。由于诱导契合过程产生的大量非共价键作用把配体稳定在连接部位上,因此,诱导契合模型可以解释配体连接的亲和性。
3.3 构象选择连接的机理
如前所述,构象选择模型包含了锁-钥匙过程和诱导契合过程,最初的选择连接可被近似的认为是锁-钥匙过程,产生了大量的溶剂熵增加值 (△Ssolv);随后的构象调整阶段在蛋白质和配体形成了广泛的分子间接触,形成大量的非共价键,产生了巨大的负焓变值 (△H为负)。熵增加值和负焓变值大大的超过了不可避免的熵损耗 (△Sconf+△Sr/t),导致了体系总的吉布斯自由能显著降低。总结起来,构象选择模型过程受熵增加和焓减少共同驱动,不仅可以用来解释连接的特异性,还可以解释连接的亲和性。事实上,自然界中的大多数蛋白质都是具有构象活性的(特别是在连接部位),以能量相近但构象有差异的构象聚集体平衡形式存在。因此,选择连接伴随着构象调整的过程应该是进化选择的结果,它有利于调节连接过程蛋白质-配体-溶剂体系的热力学和动力学特征,也使得蛋白质能够识别和连接潜在的分子以发挥生物学功能[10]。
4 结论
总的说来,蛋白质的连接过程是由蛋白质-配体-溶剂体系吉布斯自由能的降低驱动的,而体系的吉布斯自由能又是受体系熵变和焓变之间的精细平衡互补机理——熵焓互补机理决定[5,10]。作为溶剂的水混乱度增加 (熵最大化)导致蛋白质-配体-溶剂体系熵增加是蛋白质连接最初的驱动力,而随后蛋白质-配体相互接触并形成大量的非共价键导致的焓变值减少进一步驱动了连接的进行。因此,蛋白质的连接过程是由热力学的熵焓互补机理决定的自由能降低的过程。
[1]Fischer E.Einfluss der configuration auf die wirkung der enzyme [J].Ber Dtsch Chem Ges,1894,27:2984—2993.
[2]Koshland D E J.Application of a theory of enzyme specificity to protein synthesis [J].Proc Natl Acad Sci USA,1958,44:98—104.
[3]Tobi D,Bahar I.Structural changes involved in protein binding correlate with intrinsic motions of proteins in the unbound state [J].Proceedings of the National Academy of Sciences of the United States of America,2005,102 (52):18908—18913.
[4]Bryngelson J D,Onuchic J N,Socci N D,et al.Funnels,pathways,and the energy landscape of protein folding:a synthesis [J].Proteins:Structure,Function,and Bioinformatics,1995,21 (3):167—195.
[5]Liu S Q,Xie Y H,Ji X L,et al.Protein folding,binding and energy landscape:A synthesis[M].in Protein Engineering.Rijeka:Intech,2012:207—252.
[6]Ma B,Kumar S,Tsai C J,et al.Folding funnels and binding mechanisms [J].Protein Engineering,1999,12 (9):713—720.
[7]Tsai C J,Ma B,Sham Y Y,et al.Structured disorder and conformational selection [J].Proteins:Structure,Function,and Bioinformatics,2001,44 (4):418—427.
[8]Yang LQ,Sang P,Tao Y,et al.Protein dynamics and motions in relation to their functions:several case studies and the underlying mechanisms[J].Journal of Biomolecular Structure and Dynamics,2013:1—22.
[9]Ji X L,Liu S Q.Thinking into mechanism of protein folding and molecular binding [J].J Biomol Struct Dyn,2011,28:995—996.
[10]Yang L Q,Ji X L,Liu S Q.The free energy landscape of protein folding and dynamics:a global view [J].Journal of Biomolecular Structure and Dynamics,2013:1—11.
