6 6例糖尿病足临床特征分析
2013-09-13李雪璐杨小红
李雪璐 杨小红▲ 孙 娜
1.川北医学院微生物学与免疫学教研室,四川南充 637000;2.四川省南充市中心医院内分泌科,四川南充 637000
糖尿病足(diabetic foot,DF),是指糖尿病患者由于合并局部神经异常和(或)外周血管病变而导致下肢的感染、溃疡、深部组织的破坏[1]。DF是糖尿病患者致残以及致死的主要原因之一,患者生存质量低,治疗难,周期长,费用高,给患者及家庭带来了极大的痛苦及沉重的经济负担。由于DF有发病率高和截肢率高的特点,临床医师应该深入了解DF的临床特点,探讨DF发生的危险因素,及时发现高危人群,开展针对性的教育,采取针对高危因素的处理与干预措施,减少DF和截肢的发生,提高糖尿病患者的生活质量。本研究对DF患者的临床资料进行回顾性分析,探讨DF发生的临床特点和危险因素,以期指导临床预防和治疗。
1 资料与方法
1.1 一般资料
收集川北医学院附属医院2010年1月~2011年5月住院的DF患者临床病历资料,所有患者均符合WHO糖尿病诊断标准(1999年),共66例,其中男28例(42.4%),女 38 例(57.6%);年龄 46~84 岁,平均(64.9±9.1)岁;糖尿病病程 1~30 年,平均(8.6±7.5)年,DF 病程 1 d~6 个月。
1.2 糖尿病足Wanger分级
DF按Wanger分级[2],1级及以上DF入选。其中,1级12例(18.2%),2级 24例(36.4%),3级 26例(39.4%),4级4例(6.1%),5级 0例,待截肢 4例(6.1%)。
1.3 检查项目
包括白细胞总数(WBC)和中性粒细胞分类计数、白蛋白(ALB)、平均血糖(MBG)、糖化血红蛋白(HbA1c)、血脂、双下肢血管彩色多普勒超声(CDU)、病原菌培养及药敏试验。
2 结果
2.1 白细胞总数、平均血糖、糖化血红蛋白、白蛋白水平
患者入院时 MBG 为(16.9±7.1)mmol/L,HbA1c为(10.7±3.6)%,ALB 为(31.7±7.3)g/L,WBC 为(10.8±7.2)×109/L,中性粒细胞分类计数为(71.7±14.6)%。
2.2 血脂水平
结果显示DF患者存在血脂异常,三酰甘油 (TG)为(1.39±0.59)mmol/L,升高 4 例(6.1%);总胆固 醇(TC)为(4.08±1.32)mmol/L,升高 14 例(21.2%);低密度脂蛋白胆固醇(LDL-C)为(2.35±0.95)mmol/L,升高 10 例(15.2%);高密度脂蛋白(HDL-C)为(1.06±0.36)mmol/L,下降 12 例(18.2%)。
2.3 双下肢血管彩色多普勒超声
双下肢血管CDU结果显示,正常14例(21.2%),异常52例(78.8%),其中毛糙 2例(3.0%),斑块 4例(6.1%),硬化 12例(18.2%),狭窄 18例(27.3%),闭塞 16例(24.2%)。
2.4 病原菌培养及药敏结果
2.4.1 病原菌培养结果 结果显示,分离培养病原菌阳性46例(69.7%),阴性(细菌和真菌均未见生长)20例(30.3%);单一感染34例(73.9%),混合感染12例(26.1%)(病原菌种类≥2种);分离培养病原菌共 62株,G+菌 36株(58.1%),G-菌 24 株(38.7%),真菌 2 株(3.2%),其中 G+球菌32株 (51.6%)[葡萄球菌16株 (25.8%), 肠球菌10株(16.1%),链球菌 6 株(9.7%)],G+杆菌 4 株(6.5%),G-菌详细分布情况见表1。Ⅰ级4例(大肠埃希菌和葡萄球菌各占2例);Ⅱ和Ⅳ级主要是G+菌感染,葡萄球菌为主(57.1%);Ⅲ级主要是G-菌感染,普通变形杆菌为主(40.0%)。Ⅱ~Ⅳ级均是混合感染,均合并G+菌感染。本研究未进行厌氧菌培养。
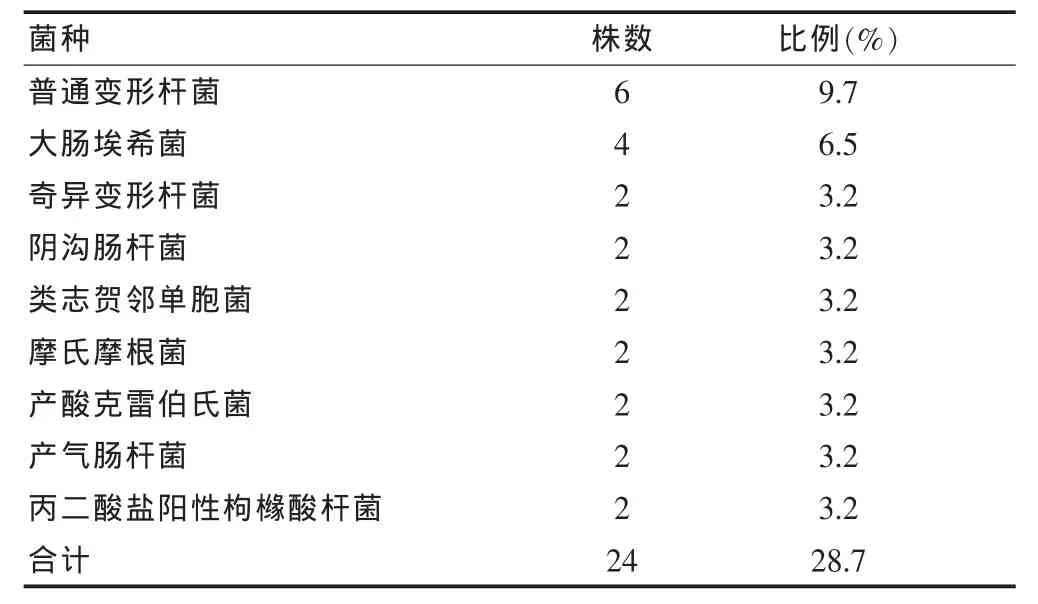
表1 24株G-菌分布情况
2.4.2 病原菌药敏结果 G+菌敏感的抗菌药物依次为万古霉素、磺胺类、利奈唑烷等,但对头孢菌素、氯霉素、喹诺酮类、氨基糖苷类等耐药;G-菌敏感的抗菌药物依次为亚胺培南、氨基糖苷类、第2、3代头孢菌素、碳青霉烯类和β-内酰胺酶抑制剂等,但对第1代头孢菌素及青霉素类等耐药;混合感染比单一感染的多重耐药菌株所占比例高。
3 讨论
国内外大量资料已证实,糖尿病患者年龄、病程是DF发病的危险因素[3]。本研究发现70~80岁年龄组的发病率最高,50岁以上占全部DF患者的89%,且随着年龄的增加,其发病率呈上升趋势。本研究还发现DF患者的糖尿病病程平均(8.6±7.5)年,其中绝大多数病程在10年以上。虽然糖尿病患者的年龄和病程与DF发生相关,但这些危险因素在预防DF发生中是很难改变的。
绝大部分DF患者血糖水平控制不佳。长期的高血糖可通过激活多元醇通路而促进山梨醇的生成,增加神经细胞骨架蛋白的糖化,下调Na+/K+-ATP酶的活性,抑制细胞的生长,而促进细胞的凋亡。长期的高血糖可引起糖化血红蛋白的升高,一方面影响血红蛋白与2,3-DPG的结合,通过上调血红蛋白与氧的亲和力、抑制其携氧能力而造成组织局部缺氧,最终可导致细胞凋亡[4];另一方面也可刺激血管平滑肌细胞的增生而促进血管的收缩,同时还可促进毛细血管内皮细胞的功能障碍,造成毛细血管基底膜增生而使管腔变窄,最终可导致下肢局部营养供给发生严重障碍。长期的高血糖通过上述机制导致神经病变和(或)血管病变的发生,可积极促进DF的发生,因此,糖尿病患者血糖水平控制不好是DF的危险因素[5-6]。有报道,HbAlc每增加2%,其DF的发生率就增加1.4~1.5倍[7]。本研究显示DF患者 HbAlc平均为(10.7±3.6)%,比正常值(3%~6%)增高,与大多研究结果一致[8]。故积极控制好血糖水平是预防DF的重要措施。
糖尿病周围血管病变(PAD)是DF和截肢发生的独立危险因素,有研究表明截肢的DF患者中大约有50%存在PAD[9],PAD的严重程度是决定DF患者是否进行截肢、决定截肢平面以及伤口可否愈合的主要因素。而众多临床和动物实验研究表明血脂代谢紊乱又是PAD的独立危险因素[10],本研究也发现DF患者(60.6%)存在血脂异常,TG和TC升高、HDL-C降低(18.2%)。血脂代谢紊乱可促进中、小动脉粥样硬化及血栓形成,引起血管腔狭窄或阻塞,增加血液粘度导致微循环障碍,造成下肢局部缺血、溃烂、感染及坏疽,最终导致DF的发生。故积极纠正糖尿病患者的血脂代谢是预防DF比较重要的措施之一。
虽然感染不是DF患者截肢的直接原因,但感染可以加重神经和血管病变,故加强对DF患者感染的控制是很重要的措施。本研究分离培养病原菌62株,以单一感染为主(51.5%),这与既往报道以多重感染为主不一致[11-12],可能与本研究未进行厌氧菌培养而降低了混合感染的阳性检出率有关。本研究显示真菌的检出率低(3.2%),这与大多数研究结果相一致。本研究还显示,DF以G+菌感染为主(58.1%),这与周丽杰等[11]报道的结果一致,而与金虹飞等[13]以G-菌为主的报道不一致,这说明病原菌在不同地区存在着一定的分布差异,临床医师应该根据当地病原菌的分布特征而采取相应的治疗措施。
本研究还发现,DF的病原菌分布与DF分级有关,II和IV级以G+菌感染为主,III级以G-菌为主;Ⅱ~Ⅳ级均为混合感染,其分布的菌种均不同但都合并G+菌感染,这与徐灵芝等[14]的报道不一致。本研究发现,以葡萄球菌、肠球菌和链球菌为主的G+菌,敏感的抗菌药物依次是万古霉素、磺胺类、利奈唑烷等,但对头孢菌素、氯霉素、喹诺酮类及氨基糖苷类等耐药;以普通变形杆菌和大肠埃希菌为主的G-菌,敏感的抗菌药物依次是亚胺培南和氨基糖苷类等敏感,但对第1代头孢菌素及青霉素类等耐药。临床医师应根据细菌培养及药敏试验选择敏感的抗菌药物。但因本研究未进行厌氧菌的培养,如抗菌效果不好,或感染局部有明显恶臭味,应注意加用抗厌氧菌的药物。
在DF感染的治疗中,如果保持DF患者淋巴细胞总数>1.5×109/L,血清总蛋白>62 g/L,白蛋白>35 g/L,则可积极促进DF溃疡的愈合。血清白蛋白水平的降低可代偿性地促进肝脏合成脂蛋白,加重其血脂紊乱,机体免疫防御功能下降,感染增加。本资料结果显示,DF患者血清白蛋白平均为(31.7±7.3)g/L,总白蛋白水平低,这与大多数报道一致。因此,应注意积极加强DF患者的营养给予,促进DF溃疡的愈合,这是预防DF坏疽的重要措施之一。
研究报道,DF患者在机体发生严重感染时白细胞总数和中性粒细胞分类计数可出现不升高或升高不明显现象[15]。 本研究显示 DF 患者白细胞总数为(10.8±7.2)×109/L,中性粒细胞分类计数为(71.7±14.6)%,这可能与DF患者溃疡局限化、糖尿病史较长、机体免疫功能下降等因素有关[16]。因此,糖尿病患者一旦发生感染,应及时对其溃疡分泌物进行病原菌培养和药敏试验,早日确诊断而采取针对性抗感染治疗,这是预防DF的重要措施之一。
[1]Apelqvist J,Bakker K,Houtum WH,et al.International consensus and practical guidelines on the man agement and the prevention of the diabetic foot.International Working Group on the Diabetes Foot[J].Diabetes Metab Res Rev,2000,16(1):84-92.
[2]Wagner FW.The dysvascular foot:A system for diagnosis and treatment[J].Foot Ankle,1981,2(2):64-122.
[3]常宝成,潘从清,曾淑范,等.208例糖尿病足流行病学及临床特点分析[J].中华糖尿病杂志,2005,13(2):129-130.
[4]许樟荣,廖二元.内分泌学[M].北京:人民卫生出版社,2001:1584-1592.
[5]李娜,肖珊,朱筠.2型糖尿病患者糖尿病足的相关危险因素分析[J].新疆医科大学学报,2009,32(1):26-28.
[6]Malik A,Mohammad Z,Ahmad J.The diabetic foot infections:Biofilms and antimicrobial resistance[J].Diabetes Metab Syndr,2013,7(2):101-107.
[7]Moss SE,Klein R,Klein BE.The prevalence and incidence of lower extremity amputation in a diabetic population [J].Arch Intern Med,1992,152(3):610-616.
[8]胡琛亮,吴乐霞.糖尿病足感染的细菌培养特征及预后分析[J].中华全科医学,2011,9(6):872-873.
[9]New JP,Mcdowell E,Burns E,et al.Problem of amputations in Patients with newly diagnosed diabetes [J].Diabet Med,1998,15(9):760-764.
[10]胡蕖,吕波,鲁宏.糖尿病患者下肢动脉病变危险因素分析[J].重庆医学,2009,38(13):1639-1640.
[11]周丽杰,张静萍,张静.糖尿病足深部感染的病原菌分布与耐药性变迁[J].中国医科大学学报,2009,38(2):121-129.
[12]Kavita A,Chopdekar,Ameeta A,et al.Bacteriological analysis of diabetic foot infection [J].Bombay Hospital Journal,2011,53 (4):706-711.
[13]金虹飞,蔡少平,顾慧群.544例糖尿病足感染患者的病原菌特点及药敏分析[J].检验医学,2010,25(5):356-359.
[14]徐灵芝,杨叶虹,叶红英.糖尿病足感染的细菌学特点与预后分析[J].浙江临床医学,2008,10(4):451-452.
[15]Muhammad RK,Khaled AO.Prevalence of ischemia in diabetic foot infection[J].World J Surg,2003,27(7):797-799.
[16]Lavery LA,Armstrong DG,Wunderlich RP,et al.Risk factors for foot infections in individuals with diabetes [J].Diabetes Care,2006,29(6):1288-1293.
