去氢表雄酮的生物转化、衍生物合成及细胞毒活性研究
2013-09-13单丽红张璐珈刘宏民
单丽红,乔 星,李 央,张璐珈,焦 凯,刘宏民
(1.郑州大学药学院,河南郑州450001;2.郑州大学新药研发中心,河南郑州450001)
0 引言
甾体化合物广泛分布于自然界及生物体内,是一类重要的生物活性分子,被誉为药学领域的“Golden Egg”[1].近年来,去氢表雄酮(Dihydroepiandrostrone,DHEA)及其在肝脏中的主要代谢产物7-羟基DHEA表现出非常好的生物活性,如提高试验动物的免疫能力[2-3],阻止体外神经元缺氧细胞死亡[4],并且对治疗阿尔茨海默病和降低体重也有一定作用[5].这些重要的研究成果引起了众多学者对甾体7-羟基衍生物的研究兴趣.
虽然甾体7位的羟基化用化学方法相对其它位置比较容易进行,但是这些方法路线长,所用试剂昂贵或有毒,不利于进行大规模生产.利用微生物转化法可以很好的克服化学合成法的不足,还具有高效、低耗、污染少等明显优势,符合现代“绿色化学”的要求.
据文献报道在甾环16位引入芳亚甲基结构,可使其产生细胞毒作用[6-7].因此本课题组利用 Claison-Schimidt缩 合 反 应 在 7α-羟 基DHEA的16位引入系列取代苯亚甲基基团,合成得到8个未见文献报道的新化合物,并测试了这些化合物对人食管癌EC109细胞株的细胞毒作用.
1 实验部分
1.1 主要试剂与仪器
试剂:去氢表雄酮(99%,汉江振华生物科技有限公司);葡萄糖(分析纯,汕头市西陇化工厂),蛋白胨和酵母膏(生化试剂,北京奥博星生物技术责任有限公司);磷酸二氢钾(分析纯,汕头金沙化工厂);琼脂(Slandand International Inc);薄层层析和柱层析硅胶(化学纯,青岛海浪硅胶干燥剂厂),所用工业溶剂均经重蒸.仪器:WC-1型显微熔点仪;BIO-RAD公司FTS-40型红外分光光度计(KBr压片);瑞士Bruker DPX-400型超导核磁共振仪;HZQ-Q全温振荡器;HVE-50高压蒸汽灭菌锅.菌种:卷枝毛霉(Mucor circinelloides lusitanicus,自筛),由中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏编号为CGMCC2256.斜面培养基:PDA培养基;发酵培养基:葡萄糖30 g,蛋白胨12 g,酵母膏1.0 g,磷酸二氢钾 0.9 g,蒸馏水 1 000 mL,pH 4.5.
1.2 制备和表征
1.2.1 生物转化
按照1.1节中发酵培养基的组成配置1 000 mL发酵培养基,分装至10个厄伦美厄烧瓶,高压灭菌锅121℃灭菌20 min,待培养基冷却后在安全柜中接种,接种后的培养基放置恒温振荡器中,培养48 h(28℃,220 r/min)后,将1.0 g DHEA 溶解于10 mL丙酮后加入上述培养基,继续培养转化4 d.转化结束后,过滤除去菌丝体,发酵液用乙酸乙酯萃取3次,萃取液浓缩后用饱和NaHCO3、饱和食盐水及水各洗3次,无水硫酸钠干燥后减压蒸干溶剂,得到白色固体,柱层析(V乙酸乙酯:V石油醚=1∶3)分离得到化合物1和2,结构如图1所示.

图1 卷枝毛霉转化DHEAFig.1 Biotransformation of DHEA by Mucor circinelloides
化合物1:白色固体粉末,收率为31.56%;mp 179.3~181.2℃ (literature 181.5~183.5℃[8]); [α]20D-71°(c.0.21,MeOH);IR(KBr)ν:3 431,2 933,1 730,1 657,1 621,1 375,1 057 cm-1;1H NMR(400 MHz,CDCl3):δ0.89(3H,s,H-18),1.02(3H,s,H-19),3.46(1H,m,H-3),3.89(1H,t,H-7,2J=7.6 Hz),5.57(1H,d,H-6,2J=5.2 Hz);13C NMR(100 MHz,CDCl3): δ:223.9,146.8,124.6,71.9,64.9,49.6,46.4,43.8,42.9,38.6,38.6,38.0,36.6,32.4,32.1,22.7,21.2,18.6,13.7;HR-MS m/z%:[M+H]+305.211 2(calcd.305.2117).
化合物2:白色固体粉末,收率为12.59%;mp 208.6~209.8℃ (literature 215~216℃[8]);[α]D20-93°(c.0.29,MeOH);IR(KBr)ν:3 364,2 930,1 730,1 660,1 629,1 380,1 056 cm-1;1H NMR(400 MHz,CDCl3):δ0.78(3H,s,H-18),0.98(3H,s,H-19),3.26(1H,m,H-3),3.70(1H,d,H-7,2J=8.0 Hz),5.18(1H,s,H-6);13C NMR(100 MHz,CDCl3): δ220.5,141.6,127.1,71.3,70.0,50.9,48.2,47.3,41.9,39.3,36.8,36.3,35.7,31.7,31.3,24.2,20.2,19.0,13.4;HR-MS m/z%:[M+H]+305.211 5(calcd.305.211 7).
1.2.2 3β,7α-二羟基-16-苯亚甲基雄甾-5-烯-17-酮衍生物1a-h的合成
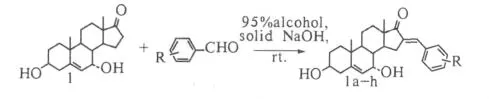
图2 化合物1a~h的合成Fig.2 Synthesis of compound 1a~h
化合物1 100 mg(0.33 mmol)溶于10~20 ml 95%乙醇,加入固体氢氧化钠0.2~0.3 g,室温搅拌10 min,加入苯甲醛(0.05 ml)或各种取代苯甲醛(0.4 mmol),继续室温搅拌,TLC检测反应完全后,减压蒸干乙醇,加入20~30 mL乙酸乙酯使瓶内固体溶解,继而用饱和食盐水15 mL分三次洗涤,至有机相呈中性,再将有机相用水洗1-2次,无水硫酸钠干燥,减压蒸干乙酸乙酯,所得固体混合物可用柱层析(V乙酸乙酯:V氯仿=2:1)的方法分离纯化.
化合物1a:白色固体粉末,收率见表1,mp:187.3~188.2℃;1H NMR(400 MHz,CDCl3):δ 7.55(2H,d,J=7.18 Hz),7.37(2H,d,J=7.39 Hz),7.35(1H,d,J=5.9 Hz),7.26(1H,s),5.65(1H,d,J=5.5 Hz),4.06(1H,s),3.57(1H,m),1.05(3H,s),0.98(3H,s);13C NMR(100M Hz,CDCl3): δ 210.4,147.4,136.6,136.6,134.0,131.2,131.2,130.0,129.3,129.4,124.4,71.9,65.2,47.6,43.9,43.5,42.7,38.3,37.5,37.6,32.0,31.9,30.1,20.9,19.0,14.8;HR-MS m/z%:[M+H]+393.241 6(calcd.393.242 9).
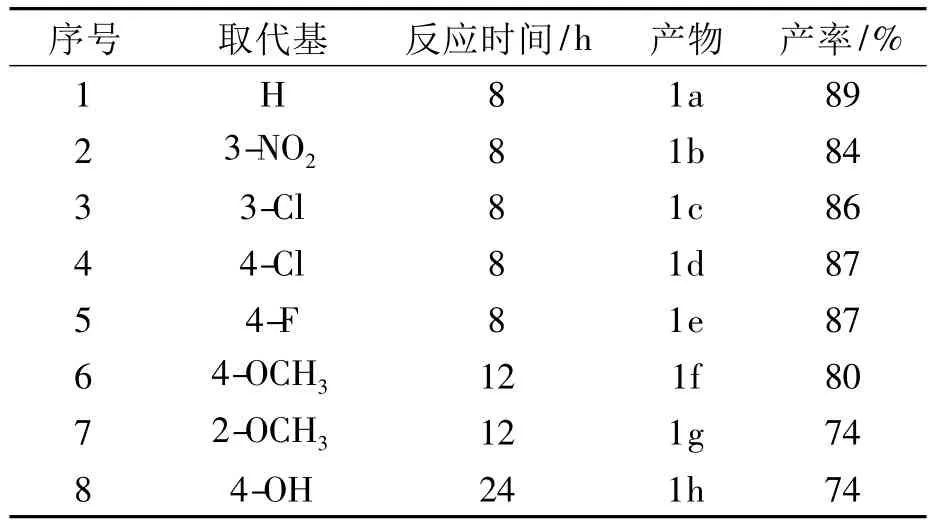
表1 化合物1a~h的结构和收率Tab.1 Structure and yield of comp.1a~h
化合物1b:白色固体粉末,收率见表1,mp:161.7~163.4℃;1H NMR(400 MHz,CDCl3):δ 8.26(2H,d,J=8.36 Hz),7.68(2H,d,J=8.36 Hz),7.45(1H,s),5.67(1H,d,J=4.56 Hz),4.06(1H,s),3.59(1H,m),1.00(3H,s),0.87(3H,s);13C NMR(100M Hz,CDCl3):δ 208.8,147.4,146.8,142.0,139.9,130.7,130.7,130.3,123.8,123.9,123.4,71.1,64.4,47.0,43.1,42.8,41.9,37.6,36.8,36.8,31.3,31.1,29.4,20.1,18.3,13.9;HR-MS m/z%:[M+H]+437.219 8(calcd.437.220 2).
化合物1c:白色固体粉末,收率见表1,mp:172.5~173.6℃;1H NMR(400 MHz,CDCl3):δ 8.39(1H,s),8.21(1H,d,J=8.93 Hz),7.83(1H,d,J=7.76 Hz),7.59(1H,t,J=15.94 Hz),7.46(1H,s),5.67(1H,d,J=5.14 Hz),4.08(1H,s),3.59(1H,m),1.07(3H,s),1.01(3H,s);13C NMR(100 MHz,CDCl3):δ 209.3,146.7,136.3,135.1,134.1,131.8,131.5,131.5,128.9,128.9,123.5,71.2,64.4,46.9,43.2,42.8,41.9,37.6,36.8,36.9,31.3,31.2,29.3,20.1,18.3,14.0;HR-MS m/z%:[M+H]+427.203 5(calcd.427.204 0).
化合物1d:淡黄色固体粉末,收率见表1,mp:168.2 ~ 169.8℃;1H NMR(400 MHz,CDCl3): δ 7.53(2H,d,J=8.50 Hz),7.38(1H,s),7.08(2H,t,J=17.2 Hz),5.63(1H,d,J=5.03 Hz),4.04(1H,s),3.54(1H,m),1.04(3H,s),0.96(3H,s);13C NMR(100M Hz,CDCl3): δ 209.6,164.3,161.8,146.6,135.4,132.3,132.2,132.0,123.5,115.9,115.7,71.1,64.4,46.9,43.2,42.8,41.9,37.6,36.9,36.9,31.2,31.2,29.2,20.1,18.3,14.0;HR-MS m/z%:[M+H]+411.233 6(calcd.411.233 5).
化合物1e:白色固体粉末,收率见表1,mp:179.3 ~180.8℃;1H NMR(400 MHz,DMSO-d6)):δ 7.61(1H,s),7.57(1H,d,J=7.72 Hz),7.40(1H,m),7.08(1H,d,J=8.2 Hz),7.04(1H,t,J=14.96 Hz),5.45(1H,d,J=5 Hz),3.84(3H,s),3.30(1H,m),0.96(3H,s),0.88(3H,s);13C NMR(100 MHz,DMSO-d6): δ 208.8,158.4,144.0,136.5,131.2,129.6,126.1,124.4,123.8,120.6,111.5,69.9,62.7,55.8,46.6,43.3,42.3,42.1,37.1,36.7,31.5,31.4,28.9,19.9,18.1,13.9;HR-MS m/z%:[M+H]+422.2451(calcd.422.2457).
化合物1f:白色固体粉末,收率见表1,mp:185.1~186.3℃;1H NMR(400 MHz,CDCl3):δ 7.36(1H,s),6.77(2H,s),5.65(1H,d,J=4.84 Hz),4.03(1H,s),3.88(9H,s),3.58(1H,s),1.05(3H,s),0.98(3H,s);13C NMR(100 MHz,CDCl3): δ 209.5,153.1,146.7,139.3,135.0,133.4,131.1,123.4,107.7,107.7,71.2,64.4,61.0,56.1,56.2,46.9,43.2,42.7,41.9,37.6,36.9,31.3,31.2,29.1,20.1,18.3,14.0;HR-MS m/z%:[M+H]+483.2740(calcd.483.2746).
化合物1g:白色固体粉末,收率见表1,mp:174.2~176.1℃;1H NMR(400 MHz,CDCl3):δ 7.668(1H,d,J=7.61 Hz),7.51(1H,s),7.43(1H,t,J=7.90 Hz),7.108(1H,d,J=8.41 Hz),7.01(1H,d,J=7.48 Hz),5.45(1H,d,J=5.40),3.60(1H,d,H-7,J=2.58 Hz),3.33(1H,m,H-3),2.86(1H,t,H-17,J=8.7 Hz),1.05(1H,s,H-19),0.97(1H,s,H-18);13C NMR(100M Hz,CDCl3): δ 208.4,157.7,145.1,135.5,131.2,128.9,126.0,124.7,122.3,120.2,111.7,69.0,62.5,56.8,46.2,43.0,42.5,42.1,37.3,36.5,36.0,33.5,31.4,28.6,19.7,18.3,13.5;HR-MS m/z%:[M+H]+422.245 5(calcd.422.2457).
化合物1h:白色固体粉末,收率见表1,mp:180.1 ~182.4℃;1H NMR(400 MHz,CDCl3):δ7.67(1H,s),7.53(1H,d,J=7.72 Hz),7.38(1H,m),7.02(1H,d,J=8.1 Hz),7.04(1H,t,J=14.90 Hz),5.45(1H,d,J=5.2 Hz),3.78(3H,s),3.35(1H,m),1.04(3H,s),0.86(3H,s);13C NMR(100 MHz,CDCl3):δ 208.8,159.2,143.7,144.0,135.6,128.9,127.8,125.1,120.8,114.7,71.6,65.3,53.1,56.2,51.0,42,3,41.7,39.8,38.0,37.2,34.1,31.3,25.9,20.6,19.3,19.0;HR-MS m/z%:[M+H]+408.229 7(calcd.408.230 1).
1.2.3 3β,7α-二羟基-16-苯亚甲基雄甾-5-烯-17-酮衍生物1a~h的细胞毒活性研究
采用MTT法,考察了化合物1a~h对人食管癌上皮细胞株EC109的抑制活性.结果如表2所示.考虑到化合物1a~h的结构中均形成了α,β不饱和酮的结构,根据文献报道,从中药冬凌草中提取的冬凌草甲素(Oridonin,图3)普遍用于治疗消化道肿瘤,其抗肿瘤活性中心就是结构中的α-环外亚甲基环戊酮单元[9],因此我们选择冬凌草甲素作为阳性对照品.

图3 Oridonin的结构Fig.3 Structure of Oridonin

表2 化合物1a~h对 EC109细胞株的抑制率(50 μg/mL)Tab.2 Inhibition rate of EC109 cells by comp.1a~h
2 结果与讨论
2.1 生物转化
从卷枝毛霉转化DHEA的发酵液中经柱层析分离得到两个纯的化合物1、2,经IR、NMR及HRMS等多种方法确证,并与文献[8]对照,分别确定为DHEA 的7α-和7β-羟基衍生物.其中7α-羟基DHEA的收率(31.56%)较7β-羟基 DHEA(12.59%)为高,是主要转化产物.
2.2 3β,7α-二羟基-16-苯亚甲基雄甾-5-烯-17-酮衍生物1a~h的合成
以7α-羟基 DHEA(1)为原料,利用 Claison-Schimidt缩合反应,使其分别与苯甲醛及多种取代苯甲醛进行反应,在其16位引入系列取代苯亚甲基基团,共得到8种衍生物1a~h,均为未见文献报道的新化合物.以化合物1a为例,在1H NMR谱中,7.26处出现一个单峰,判断为苄位氢的信号,同时在δ 7.55-7.35处也出现了单取代苯的质子信号.13C NMR谱中苯环碳的信号则为147.4(C-1’),126.6(C-2’,6’),131.2(C-3’,5’),134.0(C-4’).由以上分析可以判断1a的结构为3β,7α-二羟基-16-苯亚甲基雄甾-5-烯-17-酮.
2.3 3β,7α-二羟基-16-苯亚甲基雄甾-5-烯-17-酮衍生物1a~h的细胞毒活性研究
甾体化合物在抗肿瘤领域的应用已得到广泛证实[10],因此,笔者对所合成的甾体化合物进行了体外细胞毒活性筛选.表2列出了化合物1a-h对人食管癌上皮细胞株EC109的抑制活性.从表中所显示的结果可以看出经过转化后得到的羟基化衍生物1、2的抑制活性相应比其原料DHEA有所提高,说明引入羟基可增强其抗肿瘤作用.而以1为母体进行改造的苯亚甲基衍生物1a~h均比其母体化合物1的活性有明显提高.这说明在甾体结构中引入苯亚甲基结构可显著增强其细胞毒活性,而且这种体外抑制活性和苯环上的取代基也有一定关系,吸电子基团比斥电子基团的活性好,但与取代基的位置关系不大.
3 结论
笔者利用卷枝毛霉对去氢表雄酮进行了生物转化研究,从发酵液中分离得到其7α-和7β-羟基化产物,并利用Claison-Schimidt缩合反应在7α-羟基去氢表雄酮的16位引入带有不同取代基的苯亚甲基结构,得到8个新化合物,细胞毒实验表明引入苯亚甲基结构的衍生物对人食管癌上皮细胞株EC109有较强的抑制活性.
[1]ALEXANDER K,ZDENA K,MILOŠ B.Neurosteroids:7-aza-allopregnanolone-a poor substitute for allopregnanolone[J].Tetrahedron,2007,63:11355-11362.
[2]MORFIN R,COURCHAY G.Pregnenolone and dehydroepiandrosterone as precursors of native 7-hydroxylated metabolites which increase the immune response in mice[J].J.Steroid Biochem.Mol.Biol.,1994,50(1-2):91-100.
[3]CAROLINA G L,MARIA E S,VALERIA S,et al.Effects of dehydroepiandrosterone on ovarian cystogenesis and immune function[J].Journal of Reproductive Immunology,2004,64(1-2):59-66.
[4]DANENBERG H D,BEN-YEHUDA A,ZAKAYRONES Z,et al.Dehydroepiandrosterone(DHEA)treatment reverses the impaired immune response of old mice to influenza vaccination and protects from influenza infection[J].Vaccine,l995,13:1445-1448.
[5]BAULIEU E E,ROBEL P,FELLOUS A,et al.MAPREG:Toward a novel approach of neuroprotection and treatment of Alzheimer's disease[J].J.Mol.Neurosci.,2004,24(1):63-65.
[6]CHATTOPADHAYA R,JINDAL D P,MINU M,et al.Synthesis and cytotoxic studies of Hydroximino derivatives of some 16E-arylidenosteroids[J].Arzneimittel Forschung,2004,54(9):551-556.
[7]DUBEY S,PIPLANI P,JINDAL D P.Synthesis and evaluation of some 16-benzylidene substituted 3,17-dioximino androstene derivatives as anticancer agents[J].Letters in Drug Design & Discovery,2005,2(7):537-545.
[8]CRABB T A,DAWSON P J,WILLIAMS R O.Microbio-logical transformations.Part3.The oxidation of androstene derivatives with the fungus Cunninghamella Elegans[J].J.Chem.Soc.Perkin,1980,11:2535-2541.
[9]FUJITA E,NAGAO Y,KOHNO T,et al.Antitumor activity of acylated oridonin[J].Chem.Pharm.Bull.,1981,29(11):3208-3213.
[10]VOGEL C L.Update on the current use of hormonals as therapy in advanced breast cancer[J].Anticancer Drugs,2003,14(4):265-273.
