siRNA真核表达载体对大鼠耳蜗前体细胞Notch3基因表达的影响
2013-09-12王军利许映龙许珉
王军利,许映龙,许珉
siRNA真核表达载体对大鼠耳蜗前体细胞Notch3基因表达的影响
王军利,许映龙,许珉
目的构建Notch3基因的siRNA真核表达载体,探讨其对大鼠耳蜗前体细胞中Notch3基因表达的影响。方法机械分离并胰酶消化新生大鼠耳蜗感觉上皮,悬浮培养基培养耳蜗前体细胞。根据Notch3基因序列设计并合成2对siRNA,插入pSilencer4.1-CMV neo载体,进行酶切及测序鉴定。采用脂质体法向大鼠耳蜗前体细胞转染重组质粒,采用Real time-PCR和Western blotting法检测重组质粒对Notch3基因的干扰效果。结果经前体细胞标记物Abcg2染色鉴定证实原代培养的细胞球为耳蜗前体细胞。酶切及测序鉴定证实成功构建了siRNA真核表达载体pSilencer-Notch3-S1和pSilencer-Notch3-S2。Real-time PCR和Western blotting检测结果显示所构建的Notch3基因真核表达载体成功地干扰了目的基因的表达。与空白对照组比较,转染pSilencer-Notch3-S1和pSilencer-Notch3-S2的细胞Notch 3 mRNA和蛋白表达量均有明显减少,而转染空质粒的细胞与空白对照组比较无显著差异。结论成功构建了大鼠Notch3基因的RNAi真核表达载体,该载体在大鼠耳蜗前体细胞中对Notch3基因的表达可发挥抑制作用。
Notch3;小分子干扰;耳蜗; 前体细胞
感音神经性聋严重影响着人们的健康和生存质量,其主要病变部位位于耳蜗毛细胞和螺旋神经元[1]。近年研究发现,新生哺乳动物耳蜗中存在一定数量的具有成体干细胞特点的前体细胞,是细胞移植治疗感音神经性聋极佳的种子细胞[2-4]。Notch信号通路是一个在进化中高度保守的反映细胞间通讯机制的通路,调控细胞的增殖、分化和凋亡,在胚胎发育和细胞命运的决定中发挥着重要作用[2-3]。本研究构建针对Notch3基因的siRNA真核表达载体,以抑制大鼠耳蜗前体细胞中Notch3基因的表达,为进一步研究Notch3在耳蜗前体细胞分化过程中的作用奠定基础。
1 材料与方法
1.1实验动物 新生3d的SD大鼠[SCXK (陕)2007-001],由西安交通大学医学院实验动物中心提供。实验由西安交通大学动物实验管理委员会批准,符合美国国立卫生研究院(NIH)发布的实验动物应用和保护指南。
1.2主要试剂 增殖培养液和分化培养液[2]:DMEM/F12(97ml)、B27(2ml)、N2(1ml)购自美国Gibco公司,EGF(20ng/ml)、bFGF(10ng/ml)购自美国PeproTech公司;氨苄霉素(50μg/ml)购自美国Amresco公司。多克隆兔抗Abcg2一抗和鼠抗GAPDH购自美国Santa Cruz公司,Notch3大鼠抗体购自美国Cell Signaling公司,二抗(Cy3标记山羊抗兔IgG和FITC标记山羊抗小鼠IgG)购自美国Jackson Immuno Research公司,4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)购自美国Sigma公司,pSilencer 4.1-CMV neo质粒购自美国Ambion公司,限制性内切酶BamH Ⅰ、HindⅢ及T4DNA连接酶购自美国NEB公司,质粒抽提试剂盒购自天为时代公司,胶回收试剂盒购自广州美津生物公司,LipofectamineTM2000转染试剂盒购自美国Invitrogen公司,大肠埃希菌DH5α,Real-Time PCR试剂盒SYBR® Premix Ex TaqTMⅡ (Perfect Real Time) DRR081S和反转录试剂盒 PrimeScript® RT Master Mix DRR036S购自大连宝生物公司。
1.3针对Notch3基因的siRNA cDNA的制备根据Gen Bank报道的Notch3基因核苷酸序列NM_020087.2,应用美国Ambion公司在线设计软件选取Notch3的干扰位点,共设计2对4条干扰序列:根据RNA干涉载体pSilencer 4.1-CMV neo的要求分别于上、下游引入BamH Ⅰ和HindⅢ的酶切位点。siRNA设计由北京奥科鼎盛生物科技有限公司合成。两对干扰序列如下:Notch3-S1,5'-GATCCCTGCCGAAGCGACATAGATTTCAAG AGAATCTATGTCGCTTCGGCAGTTA-3';5'-AG CTTAACTGCCGAAGCGACATAGATTCTCTTGA AATCTATGTCGCTTCGGCAGG-3';Notch3-S2,5'-GATCCGCCTACCCTGCACGGAGGCTTCAAGA GAGCCTCCGTGCAGGGTAGGCTTA-3';5'-AGC TTAAGCCTACCCTGCACGGAGGCTCTCTTGAA GCCTCCGTGCAGGGTAGGC G-3'。
1.4Notch3-siRNA表达载体的构建及鉴定 将以上2条干扰序列分别退火,形成带有黏端的双链,用T4连接酶连接插入pSilencer 4.1-CMV neo质粒BamH Ⅰ及HindⅢ位点之间,参照Ambion公司说明书,连接产物转化DH5α感受态细胞,LB平板筛选阳性克隆。转化后挑取单个白色菌落,接种于5ml 100μg/ml Amp LB培养液,37℃振荡过夜培养,提取质粒,用BamH Ⅰ及Hind Ⅲ双酶切鉴定,送北京奥科鼎盛生物科技有限公司测序。
1.5原代耳蜗前体细胞的培养 无菌环境下获取新生3d大鼠的耳蜗感觉上皮[1],加入0.25%胰酶/ EDTA 37℃消化5min,期间吹打40~50次,加入含5%胎牛血清的DMEM/F12液终止消化。1000r/min离心5min,弃上清,添加增殖培养基液重悬,接种于4孔悬浮细胞培养板中(美国Nunc公司)。置入37℃、5%CO2孵箱。
1.6免疫细胞化学染色 4%多聚甲醛(pH 7.4)室温固定细胞20min;PBS洗涤,加入0.2% Triton X-100溶液20min;PBS洗涤,以2%BSA封闭非特异性结合位点30min;加一抗孵育,4℃过夜;PBS洗涤,加入二抗室温避光孵育2h,PBS洗涤。采用0.2% DAPI进行细胞核染色,荧光显微镜下观察。
1.7瞬时转染 采用增殖培养基悬浮培养3d,吸出所获细胞球并种植在预先用鼠尾胶原包被处理过的6孔板中,加分化液,置于37℃、5%CO2孵箱贴壁培养2d,光学显微镜下观察贴壁良好且融合率达到80%左右的细胞进行转染。转染步骤按照LipofectamineTM2000试剂说明书操作。实验共分4组,空白对照组:未进行转染的细胞;pSilencer-C组:pSilencer空载体转染;pSilencer-Notch3-S1干扰组和pSilencer-Notch3-S2干扰组:分别接受pSilencer-Notch3-S1干扰质粒和pSilencer-Notch3- S2质粒转染。
1.8Real-time PCR法检测干涉效果 瞬时转染72h后,收集各组细胞,参照Trizol Reagent说明提取细胞总RNA。用PrimeScript® RT Master Mix DRR036S试剂盒将提取的RNA反转录合成cDNA。以GAPDH作为内参照。Notch 3,F: GGCTACCTTGGCTCTGCTGAA;R:AGCAGCTTGGCAGCCTCATA,产物114bp;GAPDH,F:GGCACAGTCAAGGCTGAGAATG;R:ATGGTGGTGAAGACGCCAGTA,产物143bp。Real-time PCR采用美国Applied Biosystems公司StepOneTM实时荧光定量PCR系统,采用StepOneTMSoftware V2.1分析。Real-Time PCR反应的扩增程序如下:95℃预变性30s;95℃ 5s,60℃ 31s,40个循环。
1.9Western blotting检测干预效果 瞬时转染48h后收获细胞,约1×106个细胞加入100μl细胞裂解液进行裂解,提取细胞总蛋白,取变性样品进行6%SDS-PAGE蛋白电泳,通过电转仪将蛋白转移至硝酸纤维素膜,5%脱脂奶粉封闭非特异性结合位点2h,将膜与相应一抗4℃孵育12h,洗涤,二抗室温孵育2h,洗涤,加入化学发光底物(super signal west dura extended duration substrate,PIERCE),暗室X光片曝光、显影、定影,以GAPDH作为内参照。采用NIH Image J软件测量各条带光密度值。半定量结果以样品条带的光密度值/GAPDH光密度值表示。
2 结 果
2.1获取耳蜗前体细胞 经机械分离及胰酶消化,获取新生3d大鼠耳蜗感觉上皮细胞,并于悬浮培养基培养。获得悬浮生长的细胞克隆称为细胞球,经前体细胞标记物Abcg2染色鉴定该细胞球为耳蜗前体细胞(图1)。
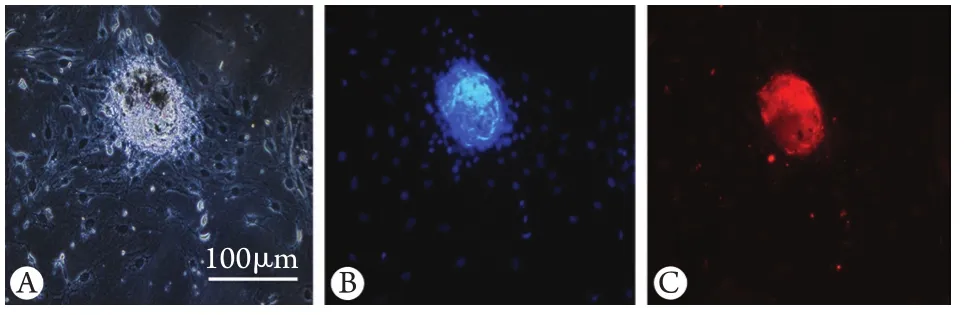
图1 Abcg2在大鼠耳蜗前体细胞的表达Fig.1 Expression of Abcg2 in cochlear progenitor cellsA. Images of cochlear progenitor spheres; B. Nuclei labeled with DAPI (blue); C. Expression of Abcg2, progenitor cell marker, on the sphere (red)
2.2siRNA干涉载体构建鉴定 DNA测序结果证实,2个载体都成功插入了干扰片段,碱基顺序符合所设计的siRNA序列。将测序正确的成功插入干扰片段的质粒分别命名为pSilencer-Notch3-S1和pSilencer-Notch3-S2(图2)。备用于后续实验。
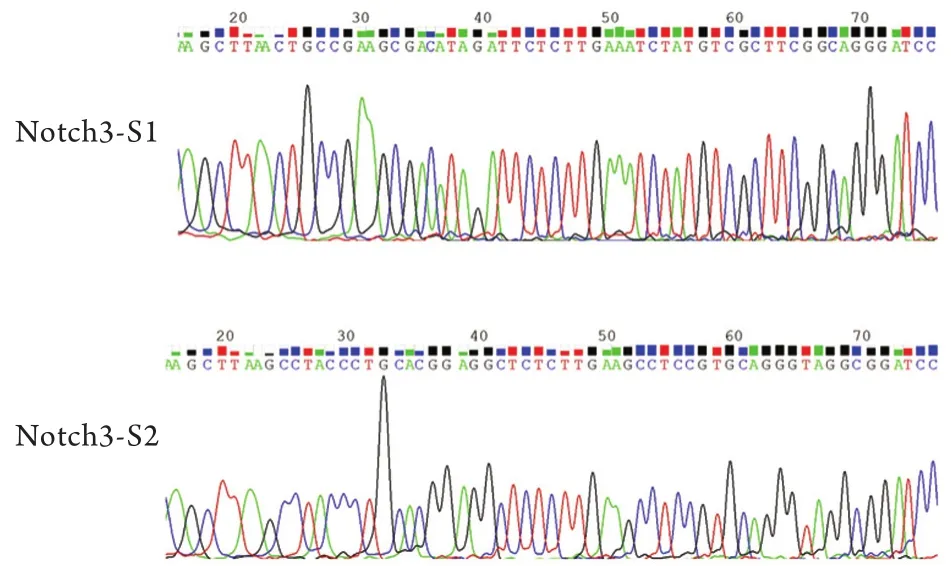
图2 pSilencer-Notch3- siRNA重组质粒酶切测序峰图Fig.2 Sequencing of pSilencer-Notch3- siRNA
2.3Real-time PCR结果 Real-time PCR半定量结果显示,空白对照组、pSilencer-C组、pSilencer-Notch3-S1干扰组和pSilencer-Notch3-S2干扰组的相对表达量分别为:1(ΔΔCt 0)、0.920024 (ΔΔCt 0.120256)、0.403224 (ΔΔCt 1.190088749)和0.503461(ΔΔCt 0.990049)。由结果可见,pSilencer-Notch3-S1和pSilencer-Notch3-S2组Notch3mRNA表达水平明显降低。
2.4Western blotting检测结果 pSilencer-Notch3-S1和pSilencer-Notch3-S2组Notch3蛋白表达水平明显减少,与空白对照组比较分别减少了67.5%和51.6%,pSilencer-C组无显著变化(图3)。各组细胞中GAPDH蛋白表达量基本一致。

图3 转染细胞Notch3蛋白表达情况(Western blotting)Fig. 3 Expression of Notch3 in the transfected cochlear progenitor cells (Western blotting)1. Blank; 2. pSilencer-C; 3. Negative control; 4. pSilencer-Notch3-S1; 5. pSilencer-Notch3-S2
3 讨 论
在鸟类和许多低等脊椎动物中可以观察到毛细胞损伤后,一部分支持细胞重新进入细胞周期并分化产生新的毛细胞和支持细胞[3]。但是在哺乳动物的耳蜗毛细胞损伤后却没有这种再生现象[5-6]。近年研究发现新生哺乳动物耳蜗感觉上皮细胞可以分离出耳蜗前体细胞,并可形成能自我更新、增殖的悬浮细胞球,贴壁生长后可分化为毛细胞样细胞[3]。
Abcg2蛋白是细胞表面转运蛋白ABC(ATP binding cassette)超家族成员之一[4],被认为是干细胞/前体细胞的通用标志[7]。2007年Savary等[8]利用Abcg2蛋白作为标记物,成功分选出耳蜗前体细胞。本研究经机械分离和胰酶消化新生大鼠耳蜗感觉上皮,获取了Abcg2表达阳性的耳蜗前体细胞。
耳蜗前体细胞的分化受多种因素调节,其中Notch信号通路在细胞的增殖、分化过程中起着重要调控作用。在哺乳动物中Notch受体的同源分子有4种,分别是Notch1、Notch2、Notch3和Notch4。Notch信号的活性受到诸多因素的调节,不同Notch蛋白可激活不同的Notch信号通路[9]。有研究认为在耳蜗前体细胞的分化过程中,正在分化为耳蜗毛细胞的前体细胞可通过激活其相邻细胞的Notch1,抑制Math1的表达,相邻细胞即无法向毛细胞方向分化而分化为支持细胞,同时该细胞反过来激活毛细胞的Notch3来抵消毛细胞内Notch1的作用,也就是说Notch1活化可抑制细胞分化,Notch3活化可以拮抗Notch1的作用,也可能是引发细胞分化的作用,但这一模式尚未得到完全证实[10]。
目前针对Notch3的研究相对较少,Notch3在耳蜗前体细胞分化过程中的作用尚不明确。为此本研究构建了Notch3基因的RNA干扰质粒,用RNAi技术封闭大鼠耳蜗前体细胞Notch3基因的表达。RNAi不仅可抑制体外细胞特定基因的表达,而且也可抑制体内特定基因的表达,具有高效性和高特异性[11-12]。
DNA测序证实,本研究所构建的针对Notch3基因的pSilencer-Notch3-S1和pSilencer-Notch3-S2表达载体都成功插入了干扰片段。但用干扰载体通过脂质体瞬时转染新生大鼠耳蜗前体细胞是一个较为棘手的问题。一般来说,悬浮生长的具有干细胞特性的原代前体细胞脂质体转染效率比较低,为此本研究将悬浮培养5d的耳蜗前体细胞球种植在预先用鼠尾胶原包被处理过的培养板上,诱导其贴壁,短暂贴壁培养36h,既保证了前体细胞不发生分化,又提高了转染效率。同时经过反复摸索转染条件,得出脂质体和质粒DNA的最佳使用量均为脂质体转染说明建议用量的一半,这样既能保证转染效率较高,又减少了脂质体对细胞的损伤。转染成功后该载体在CMV启动子调控下表达siRNA。
为了检验RNA干扰的效率,本研究首先从干扰效应的第一个环节mRNA水平进行检测。Real time-PCR结果表明,pSilencer-Notch3-S1和pSilencer-Notch3-S2实验组Notch3基因的mRNA表达受到了明显抑制。第二步,从蛋白水平检测Notch3蛋白的表达水平,与mRNA水平相对应,Western blotting结果证实pSilencer-Notch3-S1和pSilencer-Notch3-S2实验组的Notch3蛋白表达明显下降,说明在RNA干扰开始发挥作用后,由于mRNA结构的破坏,无论缺失起始密码子或终止密码子都将导致翻译不能正常进行。
本研究所构建的针对Notch3基因的siRNA真核表达载体对新生大鼠耳蜗前体细胞中Notch3基因的表达有明显的抑制作用,表明所构建的siRNA成功地发挥了干涉效应,从而为进一步研究Notch3基因以及整个Notch通路在耳蜗前体细胞分化过程中的作用奠定了基础。
[1] Yin ZH, Dong MM, Wang GK. Antagonism of melatonin on presbycusis in guinea pigs[J]. J Zhengzhou Univ (Med Sci), 2006, 41(6): 1160-1162.[尹志华, 董明敏, 王广科. 褪黑素对豚鼠老年性聋的拮抗作用[J]. 郑州大学学报(医学版), 2006, 41(6): 1160-1162.]
[2] Oshima K, Senn P, Heller S. Isolation of sphere-forming stem cells from the mouse inner ear[J]. Methods Mol Biol, 2009, 493:141-162.
[3] Warchol ME. Sensory regeneration in the vertebrate inner ear: differences at the levels of cells and species[J]. Hear Res, 2011, 273(1-2): 72-79.
[4] Alison MR. Tissue-based stem cells: ABC transporter proteins take centre stage[J]. J Pathol, 2003, 200(5): 547-550.
[5] Yang WP, Zhai SQ. Death modes of cochlea hair cells in aged rats[J]. Med J Chin PLA, 2008, 33(1): 995-999.[杨卫平, 翟所强. 老年大鼠耳蜗毛细胞死亡方式观察[J]. 解放军医学杂志, 2008, 33(1): 995-999.]
[6] Yang WP, Hu BH, Donald H. Effects of mitochondrial energyconversion efficiency on controlling the initiation and execution of the apoptotic process in outer hair cells of cochlea following noise exposure[J]. Med J Chin PLA, 2008, 33(1): 964-966.[杨卫平, 胡博华, Donald H. 线粒体能量转换功能在噪声诱导耳蜗毛细胞凋亡启动和进程中的作用[J]. 解放军医学杂志, 2008, 33(1): 964-966.]
[7] Li HX, Guan HH, Sun JF, et al. The differential expression and significance of tumor stem cell markers ABCG2, CK19 and P63 in patients with actinic keratosis, Bowen's Disease and squamous cell carcinoma[J]. Med J Chin PLA, 2012, 37(6): 623-627. [李泓馨, 管海宏, 孙建方, 等. 肿瘤干细胞标志物ABCG2、CK19和P63在皮肤日光性角化病、Bowen病及鳞状细胞癌中的表达差异及意义[J]. 解放军医学杂志, 2012, 37(6): 623-627]
[8] Savary E, Hugnot JP, Chassigneux Y, et al. Distinct population of hair cell progenitors can be isolated from the postnatal mouse cochlea using side population analysis[J]. Stem Cells, 2007, 25(2): 332-339.
[9] Perdigoto CN, Bardin AJ. Sending the right signal: Notch and stem cells[J]. Biochim Biophys Acta, 2013, 1830(2): 2307-2322.
[10] Rivolta MN, Halsall A, Johnson CM, et al. Transcript profiling of functionally related groups of genes during conditional differentiation of a mammalian cochlear hair cell line[J]. Genome Res, 2002, 12(7): 1091-1099.
[11] Aigner A. Gene silencing through RNA interference (RNAi) in vivo: strategies based on the direct application of siRNAs[J]. J Biotechnol, 2006, 124(1): 12-25.
[12] Wurdinger T, Costa FF. Molecular therapy in the microRNA era[J]. Pharmacogenomics J, 2007, 7(5): 297-304.
Blocking effect of vector-based siRNA on Notch3 gene expression in rat cochlear progenitor cells
WANG Jun-li, XU Ying-long, XU Min*
Department of Otolaryngology-HNS, Second Affiliated Hospital of Xi'an Jiaotong University, Xi'an 710004, China
*
E-mail: ent551205@163.com
ObjectiveTo explore the blocking effect of siRNA on the expression of Notch3 gene in rat cochlear progenitor cells using siRNA eukaryotic expression vector.MethodsThe sensory epithelial cells of neonatal rat cochlea were mechanically isolated, and then they underwent trypsin digestion and suspension culture to acquire cochlear progenitor cells. Immunfluorescence staining of Abcg2 expression was applied to confirm the acquired cochlear progenitor cells. Two siRNA cDNAs were synthesized according to the Notch3 gene sequence and cloned into the vector pSilencer4.1-CMV neo, namely pSilencer-Notch3-S1 and pSilencer-Notch3-S2 respectively, and they were further identified by restriction endonuclease digestion analysis and DNA sequencing. The cochlear progenitor cells were then transfected with pSilencer-Notch3-S1 and pSilencer-Notch3-S2. The interfering effect was detected by Real-time PCR and Western blotting.ResultsThe clonal growth cell spheres were acquired and identified to contain Abcg2 positive cochlear progenitor cells. The vectors were successfully constructed and confirmed by DNA sequencing restriction endonuclease digestion analysis. DNA sequencing showed that the two target segments were cloned into pSilencer4.1-CMV neo-vector respectively. Western blotting showed that the protein expression decreased significantly in pSilencer-Notch3-S1 transfected cochlear progenitor cells. Real-time PCR demonstrated a significant decrease in expression of Notch3 mRNA in both pSilencer-Notch3-S1 group and pSilencer-Notch3-S2 group.ConclusionThe vector-based siRNA on Notch3 gene can effectively inhibit the expression of Notch3 gene in rat cochlear progenitor cells.
Notch3;RNA interfering; cochlea; progenitor cells
R329.492
A
0577-7402(2013)05-0369-04
2013-01-22;
2013-03-28)
(责任编辑:李恩江)
国家自然科学基金(30973300)
王军利,博士研究生。主要从事耳聋的基础与临床研究
710004 西安 西安交通大学第二附属医院耳鼻喉科(王军利、许映龙、许珉)
许珉,E-mail:ent551205@163.com
This work was supported by the National Natural Science Foundation of China (30973300)
