苍白杆菌产生脂肽的结构解析
2013-09-12程斌斌杨世忠牟伯中
程斌斌,杨世忠,牟伯中
(华东理工大学化学系,上海 200237)
生物表面活性剂是一类由微生物代谢产生的表面活性物质,其结构同时具有亲水性和疏水性,具有很高的表面活性和生物活性[1]。生物表面活性剂不仅具有优良的表界面活性、化学稳定性和热稳定性,还具有抗菌、抗病毒、环境友好可降解等特性。生物表面活性剂已经在3次采油(MEOR)、化妆品和环境修复领域开始应用,同时在食物、医药领域具有广阔的应用前景。脂肽是一种重要的生物表面活性剂,主要来源于芽胞杆菌、假单胞菌、曲霉菌、链霉菌、沙雷氏菌属和游动放线菌的菌属等。表面活性素(Surfactin)是一类典型的脂肽表面活性剂,其结构是由β-羟基脂肪酸和7个氨基酸组成的环状脂肽组成。脂肽在酸性条件下高温密封水解成游离的β-羟基脂肪酸和氨基酸后,甲酯化后通过气质联用(GC-MS)分析脂肪酸组成[2];硅烷化后通过GC-MS分析氨基酸组成[3]。近年来,串联质谱技术(MS/MS)的发展,为分析脂肽中氨基酸以及氨基酸的连接顺序带来了极大的便利[4]。本文从油藏产出液中分离出1株能代谢产生脂肽的细菌,通过16S rDNA的方法鉴定为苍白杆菌(Ochrobactrum sp.)。这是首次发现苍白杆菌也能够代谢产生脂肽。通过GC-MS分析了脂肽中脂肪酸和氨基酸的组成,并结合MS/MS进一步分析了肽环氨基酸的连接顺序。
1 材料与方法
1.1 材料
1.1.1 培养基 KH2PO43.0 g,Na2HPO4·12H2O 25.2 g,NH4NO32.0 g,MgSO40.1 g,CaCl220 μmol/L,MnSO430 μmol/L,蔗糖 20.0 g,酵母粉0.5 g,加去离子水配成1 L溶液。
1.1.2 主要仪器和试剂 主要仪器:气质联用仪6890GC-7895MS(Agilent,USA),四级杆-飞行时间串联质谱(Q-Tof Micro,UK);主要试剂:N,O-双(三甲基硅基)三氟乙酰胺(BSTFA)(Sigma-Aldrich,USA)、甲醇、硫酸、盐酸、无水乙醚等试剂均为国产且纯度为AR。
1.2 方法
1.2.1 富集培养 细菌接种于含有液体培养基的三角瓶中,空气摇床37℃恒温培养,转速150 r/min发酵培养。
1.2.2 生物表面活性剂的提取 发酵液经5 000 r/min离心30 min,移取上层清液。上清液中滴加6.0 mol/L盐酸,调节 pH≤2.0,4 ℃冰箱中放置过夜。再次离心收集沉淀,用去离子水洗涤3次,烘干得到生物表面活性剂粗品。加入无水乙醚充分震荡萃取3次,收集上层乙醚相,除去乙醚后冷冻干燥获得脂肽浸提物。
1.2.3 脂肽的水解 取10 mg脂肽放入安瓿瓶中,加入6.0 mol/L盐酸1.0 mL,用酒精喷灯熔烧瓶口密封,密封后90 ℃水解24 h[2]。
1.2.4 脂肪酸分析 水解结束后将反应液移至试管中,并加入5倍体积的去离子水。加入1.0 mL无水乙醚萃取3次,收集萃取乙醚相。在除去乙醚的干燥样品中加入1.0 mL的10%(体积比)硫酸-甲醇溶液,55℃反应6 h,反应结束并冷却后,加入5倍体积去离子水稀释,加入0.5 mL无水乙醚萃取3次,收集乙醚相。吹干乙醚,加入0.5 mL甲醇超声溶解,然后移入GC-MS进样瓶中,用GC-MS分析。实验所用的气相色谱-质谱联用仪是美国安捷伦公司的6890GC-5975MS型仪器,配有HP-5MS石英毛细管柱(30 m×0.25 mm ×0.25 μm,5%苯基甲基硅氧烷填充)。气相色谱条件:载气为高纯度氦气(99.999%),进样口温度250 ℃,流速1.0 mL/min,分流比 10∶1,进样量1.0 mL;程序升温条件:起始温度120℃(维持3 min),升温速率10℃/min升温至260℃,维持5 min;质谱条件:EI离子源,离子源温度230℃,电离电压70 eV,四级杆温度150℃。
1.2.5 氨基酸分析 水解结束后将反应液移入GC-MS进样瓶中,吹干,105℃烘干2 h,加入0.30 mL乙腈,混匀后再加入0.20 mL的 N,O-双(三甲基硅基)三氟乙酰胺(BSTFA)试剂,密封后60℃恒温硅烷化反应20 min。反应结束后,混匀样品直接用GC-MS测定氨基酸的组分。实验所用的气相色谱-质谱联用仪同1.2.4。气相色谱条件:载气为高纯度氦气(99.999%),进样口温度250℃,流速1.0 mL/min,分流比 10∶1,进样量 1.0 mL;程序升温条件:起始温度60℃(维持3 min),升温速率10℃/min升温至250℃,维持5 min;质谱条件:EI离子源,离子源温度230℃,电离电压70 eV,四级杆温度150℃。
1.2.6 串联质谱分析 串联质谱分析条件:离子源温度80℃;解离温度150℃;毛细管电压,进样锥电压,离子能量及碰撞能量分别为3 kV、40 V、1.5 V及60 V。钠离子化的目标分子由第一级四极杆质谱质量分析器选取,并经惰性原子轰击而碎裂成片断,产生的钠离子化的碎片再经第二级飞行时间质谱质量分析器分析并记录下MS/MS。
2 结果与分析
2.1 脂肪酸组成
脂肽经过盐酸高温水解之后产生游离β-羟基脂肪酸,酸性条件下与甲醇反应得到β-羟基脂肪酸甲酯,然后通过GC-MS方法检测,检测总离子色谱图见图1。
β-羟基脂肪酸甲酯发生极性基团的α-碎裂,产生质荷比 m/z=103的[CH(OH)CH2COOCH3]+离子碎片,由此,提取质荷比为m/z=103的离子色谱见图2。图2中有8个色谱峰,保留时间分别为 10.3、10.4、11.4、11.8、12.5、12.6、13.5 和 13.8 min。在质谱中 β-羟基脂肪酸甲酯高质量端离子峰丢失H原子、H2O、(CH3OH+H2O)产生M-1、M-18和M-50的碎片离子峰。由此可以判断这8个脂肪酸甲酯分子量分别为244、244、258、258、272、272、286 和286,即2 个 C13β-羟基脂肪酸甲酯、2个C14β-羟基脂肪酸甲酯、2个C15β-羟基脂肪酸甲酯和2个 C16β-羟基脂肪酸甲酯。具有相同碳链长度的β-羟基脂肪酸甲酯由于支链的差异具有n、iso或者anteiso的结构。文献也报道了8种具有不同结构的β-羟基脂肪酸的脂肽,分别为iso C13β-羟基脂肪酸、anteiso C13β-羟基脂肪酸、iso C14β-羟基脂肪酸、n C14β-羟基脂肪酸、iso C15β-羟基脂肪酸、anteiso C15β-羟基脂肪酸、iso C16β-羟基脂肪酸和n C16β-羟基脂肪酸[5-8]。Hosono 等[9]发现 β-羟基脂肪酸甲酯的保留时间与其碳原子数之间存在线性关系,并且具有相同碳原子数目的β-羟基脂肪酸甲酯的保留时间具有以下关系:iso<anteiso<n。据此分析,脂肽样品的脂肪酸链分别iso C13 β-羟基脂肪酸、anteiso C13β-羟基脂肪酸、iso C14β-羟基脂肪酸、n C14β-羟基脂肪酸、iso C15β-羟基脂肪酸、anteiso C15β-羟基脂肪酸、iso C16β-羟基脂肪酸和 n C16β-羟基脂肪酸。这8种β-羟基脂肪酸的质谱图如图3所示。
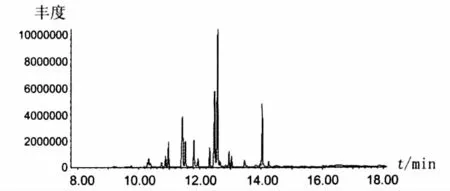
图1 脂肽样品水解酯化后的总离子色谱图Fig.1 Total ion chromatogram of methyl-esterified fatty acids from lipopeptide
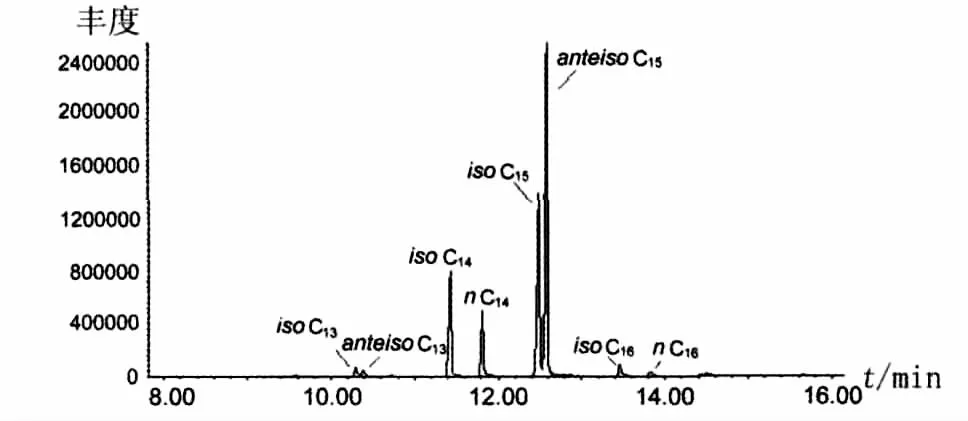
图2 脂肽样品水解产物酯化后的提取离子色谱图(m/z=103)Fig.2 Extracted ion(m/z=103)chromatogram of methyl-esterified fatty acids from lipopeptide
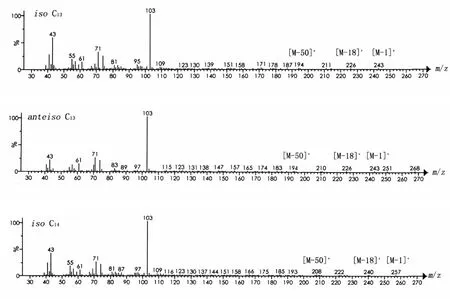

图3 β-羟基脂肪酸甲酯的质谱图Fig.3 MS spectrum of β-hydroxy fatty acid methyl esters
2.2 氨基酸组成
脂肽经过盐酸水解后,断裂产生游离的氨基酸。水解的产物与BSTFA硅烷衍生化后,通过GC-MS的方法检测样品中氨基酸的组分,检测的总离子图谱见图4。图4中有4个色谱峰,保留时间分别为9.9、10.9、14.1 和15.3 min,说明有4种主要成分。根据Aglient NIST 05质谱图数据库检索结果,这4个峰依次为缬氨酸(Val)、亮氨酸(Leu)、天门冬氨酸(Asp)和谷氨酸(Glu)的硅烷化衍生物。图5~图8分别列出了4种氨基酸衍生物质谱图。因此,脂肽样品肽环部分由缬氨酸、亮氨酸、天门冬氨酸和谷氨酸4种氨基酸组成。
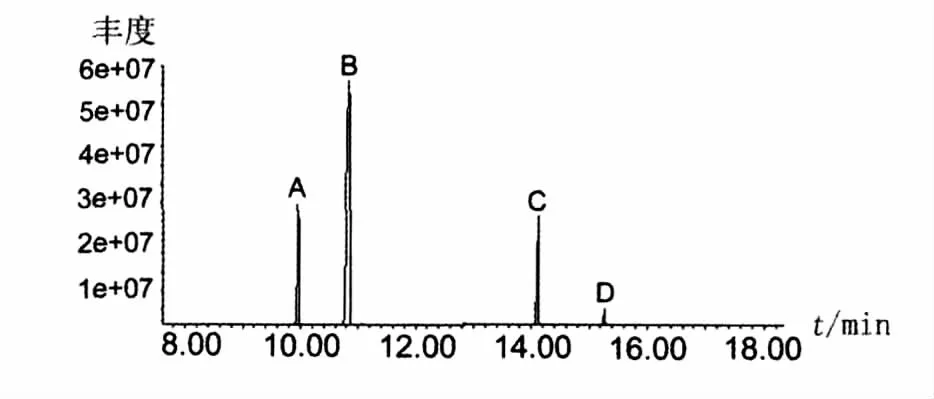
图4 脂肽样品水解后衍生化产物的总离子色谱图Fig.4 Total ion chromatogram derived from hydrolyzed lipopeptide sample
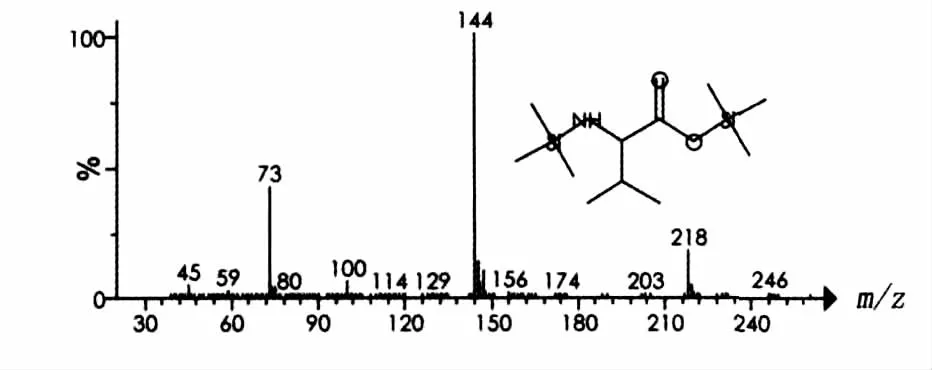
图5 缬氨酸硅烷衍生化质谱图Fig.5 Mass chromatogram of Val after trimethylsilylation
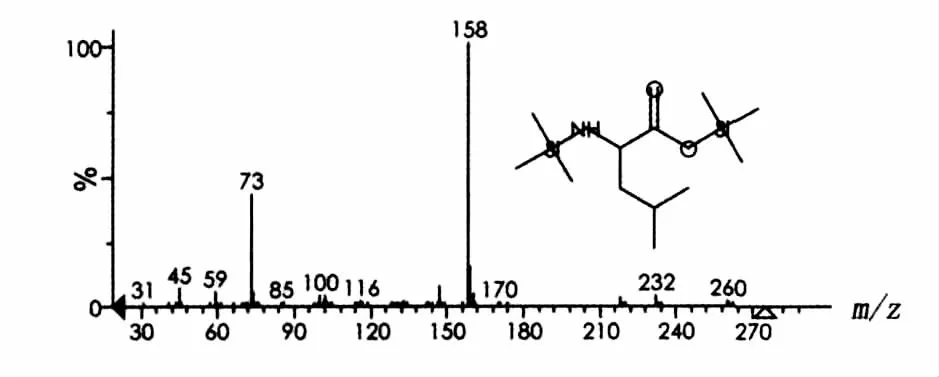
图6 亮氨酸硅烷衍生化质谱图Fig.6 Mass chromatogram of Leu after trimethylsilylation
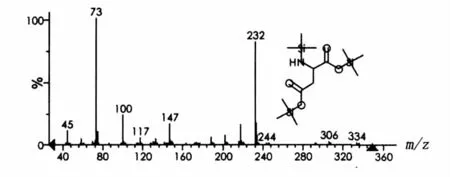
图7 天门冬氨酸硅烷衍生化质谱图Fig.7 Mass chromatogram of Asp after trimethylsilylation
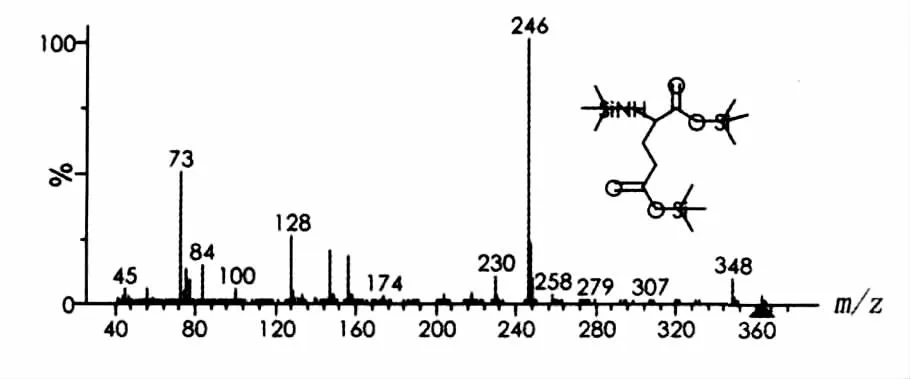
图8 谷氨酸硅烷衍生化质谱图Fig.8 Mass chromatogram of Glu after trimethylsilylation
2.3 氨基酸的连接顺序
图9是脂肽样品的ESI-MS检测质谱图谱。阳离子方式检测中质荷比为1058的质谱峰代表的组分是脂肽的[M+Na]+质谱峰;质荷比为1044、1030的质谱峰与质荷比为1058的质谱峰分别相差14和28,三者互为同系物,结构相差1个和2个CH2。与之对应的,在阴离子方式检测质谱图中出现了1034、1020和1006的[M-H]-质谱峰。
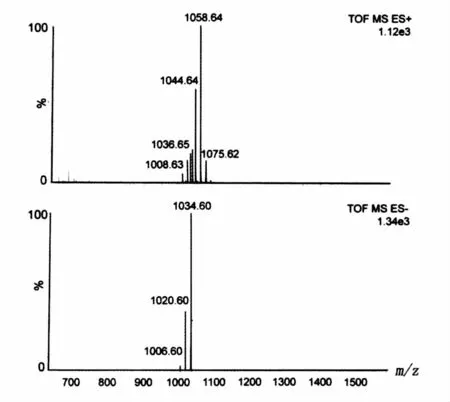
图9 脂肽的电喷雾质谱检测结果Fig.9 ESI-MS detection result of lipopeptide
以质荷比为1058的[M+Na]+离子作为先导离子,进行阳离子串联质谱检测,图10是该离子峰的串联质谱分析图谱。脂肽在质谱中首先断裂氨基酸残基[10]离子碎片 1058、945、832、618 显示了Leu-Leu-Asp-Val的氨基酸序列信息;离子碎片717、594、481、382、267 显示了 Leu-Leu-Val-Asp的氨基酸序列信息。Surfactin肽链由7个氨基酸组成,且其比例为Val∶Leu∶Asp∶Glu=1∶4∶1∶1[5-8]。考虑到氨基酸的组成中有一个Asp和一个Val,氨基酸的链接顺序为Leu-Leu-Asp-Val-Leu-Leu。根据双氢转移机制以及麦氏重排机理,环状脂肽在串联质谱分析过程中,内酯键所在的烷链上发生消除反应而将一分子水转移至肽链的C 末端上,从而判断肽链的 C 端[4,11]。碎片离子832与814相差恰好为18,是氨基酸残基 H2OLeu-Leu与残基Leu-Leu之间的质量差,表明Leu-Leu连接在C端,剩下的谷氨酸只能链接到N端,因此肽链连接顺序为N-Glu-Leu-Leu-Val-Asp-Leu-Leu-C。碎片离子1058与707对应于C12H25C=CHCO-Glu,表明该离子峰为C15surfactin,这也与脂肪酸分析结果吻合。
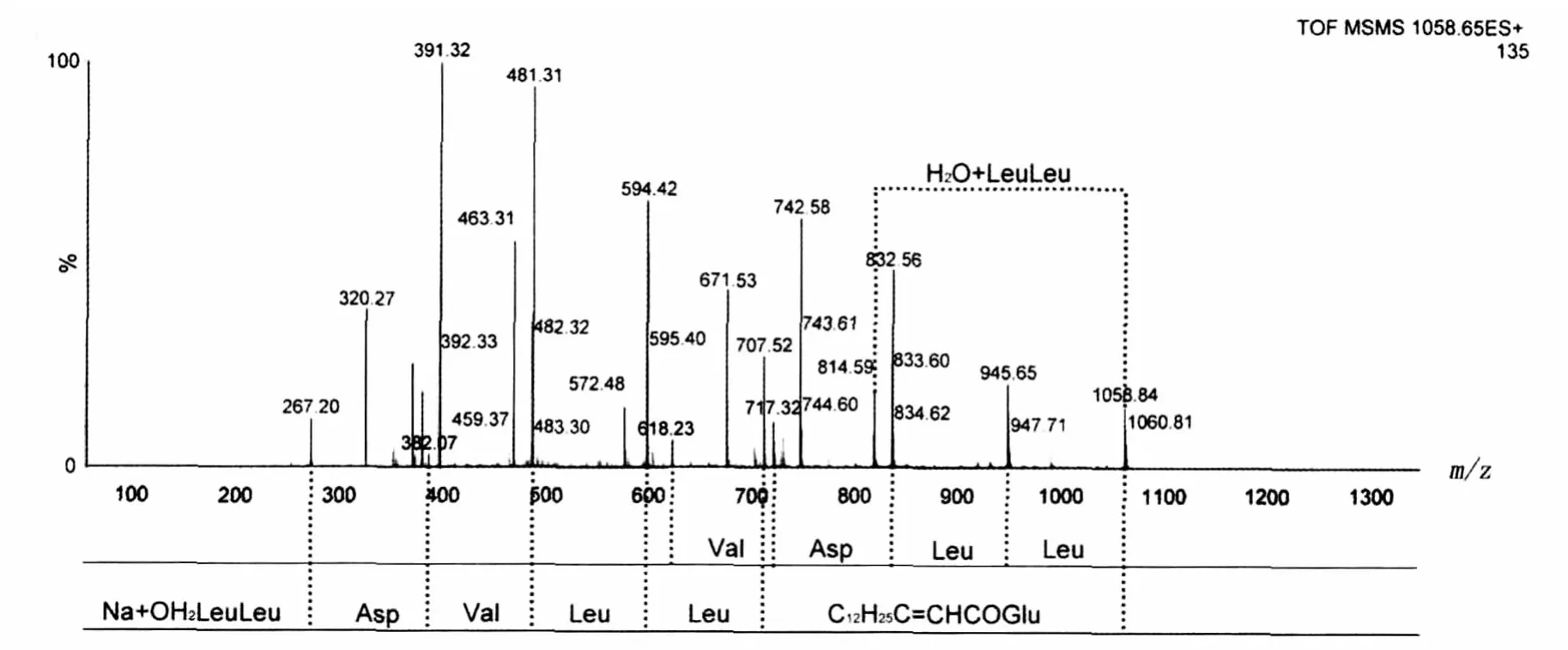
图10 钠离子化碎片(m/z=1058)的串联质谱分析Fig.10 Tandem mass spectrum of sodium-ionized fragment(m/z=1058)
质荷比为1044和1030的离子峰串联质谱分析结果表明:离子碎片1044和1030分别是C14脂肽和C13脂肽的[M+Na]+质谱峰,肽环氨基酸链接顺序与离子碎片1058所代表的C15脂肽氨基酸连接顺序相同,均为N-Glu-Leu-Leu-Val-Asp-Leu-Leu-C。
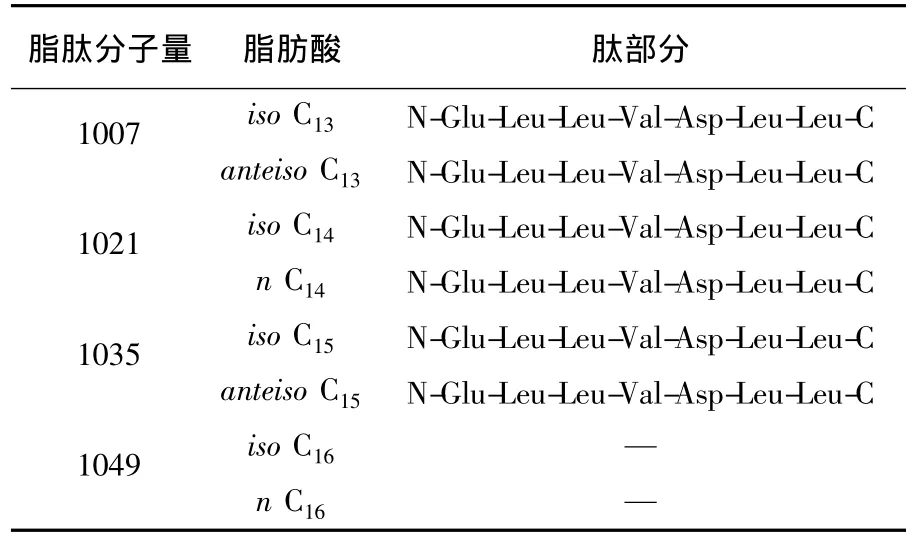
表1 苍白杆菌代谢产生的脂肽类型Table 1 The lipopeptides produced by Ochrobactrum sp.
结合GC-MS和MS/MS分析,筛选的这株苍白杆菌代谢的脂肽为含有脂肪酸组成为iso C13β-羟基脂肪酸、anteiso C13β-羟基脂肪酸、iso C14β-羟基脂肪酸、n C14β-羟基脂肪酸、iso C15β-羟基脂肪酸、anteiso C15β-羟基脂肪酸、iso C16β-羟基脂肪酸和n C16β-羟基脂肪酸的脂肽混合物,肽环部分均由缬氨酸、亮氨酸、天门冬氨酸和谷氨酸4种氨基酸组成,氨基酸连接顺序见表1。苍白杆菌代谢产生的脂肽结构与surfactin相同,但其脂肽组成与报道的其他菌株产生的surfactin不同。串联质谱图中没有检测出C16surfactin对应的[M+Na]+质谱峰,因此无法分析其氨基酸链接顺序。
3 结论
从油藏产出液中筛选到1株代谢产生脂肽的细菌,经鉴定为苍白杆菌。这是首次报道苍白杆菌能够产生脂肽类化合物。脂肽中的脂肪酸由iso C13β-羟基脂肪酸、anteiso C13β-羟基脂肪酸、iso C14β-羟基脂肪酸、n C14β-羟基脂肪酸、iso C15β-羟基脂肪酸、anteiso C15β-羟基脂肪酸、iso C16β-羟基脂肪酸和n C16β-羟基脂肪酸组成;脂肽中的氨基酸由缬氨酸、亮氨酸、天门冬氨酸和谷氨酸组成。其中脂肪酸组成为 iso C13、anteiso C13、iso C14、n C14、iso C15和 anteiso C15β-羟基脂肪酸的脂肽,其氨基酸连接顺序为N-Glu-Leu-Leu-Val-Asp-Leu-Leu-C。该结构与surfactin的结构一致。故该苍白杆菌代谢的脂肽为iso C13surfactin、anteiso C13surfactin、iso C14surfactin、n C14surfactin、iso C15surfactin、iso C16surfactin和 n C16surfactin的混合物,与目前报道的枯草芽胞杆菌、地衣芽胞杆菌及短短芽胞杆菌产生的surfactin的组成相同。
[1] 张天胜等.生物表面活性剂及其应用[M].北京:化学工业出版社,2005:7-10.
[2] 赵越,杨世忠,牟伯中.脂肽类生物表面活性剂的最适水解条件[J].化学通报,2013,76(2):135-140.
[3] Zhao Y.,Yang S.Z.,Mu B.Z..Quantitative analyses of the isoforms of surfactin produced by Bacillus subtilis HSO 121 using GC-MS[J].Analytical Sciences,2012,28(8):789-793.
[4] Yang S.Z.,Wei D.Z.,Mu B.Z..Determination of the amino acid sequence in a cyclic lipopeptide using MS with DHT mechanism[J].J Biochem Biophys Methods,2006,68(1):69-74.
[5] Wang J.,Haddad N.I.A.,Yang S.Z..Structural characterization of lipopeptides from Brevibacillus brevis HOB1[J].Appl Biochem Biotechnol,2010,163(3):812-821.
[6] Liu X.Y.,Yang S.Z.,Mu B.Z..Production and characterization of a C15-surfactin-O-methyl ester by a lipopeptide producing strain Bacillus subtilis HSO121[J].Process Biochemistry,2009,44(10):1144-1151.
[7] Liu X.Y.,Haddad N.I.A.,Yang S.Z.,et al.Structural characterization of eight cyclic lipopeptides produced by Bacillus subtilis HSO121 [J].Protein and Peptide Letters,2007,14(8):766-773.
[8] 吕应年,杨世忠,牟伯中.一种脂肽类生物表面活性剂产生菌的筛选[J].微生物学杂志,2005,25(2):4-8.
[9] K.Hosono,H.Suzuki.Acylpeptides,the inhibitors of cyclic adenosine 3',5'-monophosphate phosphodiesterase.I.Purification,physicochemical properties and structures of fatty acid residues[J].The Journal of Antibiotics,1983,36(6):667-673.
[10]Yang S.Z.,Mu B.Z.,Lü Y.N.,et al.MS determination of the sequence of acids in a cyclic lipopeptide[J].Acta Chim Sin,2004,62(21):2200-2204.
[11]Yang S.Z,Liu X.Y.,Mu B.Z..The McLafferty rearangement in the Glu residue in a cyclic lipopeptide determined by Q-TOF MS/MS[J].J.Mass Spectrom,2008,43(12):1673-1678.