稻曲病菌厚垣孢子中cAMP提取条件优选
2013-09-12任佐华刘敏捷陈娟芳刘二明
李 媛,任佐华,刘敏捷,杨 浪,陈娟芳,刘二明*
(1.湖南农业大学生物安全科学技术学院,湖南长沙 410128;2.湖南农业大学信息科学技术学院,湖南长沙 410128;3.湖南农业大学东方科技学院,湖南长沙 410128)
水稻稻曲病是由稻绿核菌(Ustilaginoidea virens(Cooke.)Takahashi)引起的水稻穗部病害[1]。20世纪80年代以来,由于杂交水稻和籼粳杂交育成的高产品种的推广,分蘖期和孕穗期追施氮肥等多种原因导致稻曲病的发生日趋严重[2]。在稻曲病菌侵染循环中,厚垣孢子是重要的初侵染源[3]。稻曲病菌厚垣孢子,具有休眠期长、基数大等特点,是稻曲病菌越冬的主要病原体[4]。环磷酸腺苷(cAMP)是一种核苷酸衍生物,与信号转导以及细胞的各种生理病理现象密切相关,是生物体内重要的第二信使[5]。有研究发现,cAMP也参与植物致病性真菌生长发育、调控其致病性,并且调控无性孢子的萌发[6]。稻曲病菌在引起穗粒发病过程中,其病征表现由黄色转变成黑色粉(厚垣孢子)状,即由非休眠(黄色)转变成休眠(黑色)厚垣孢子,cAMP在这两种类型厚垣孢子中的转换和它们的萌发过程中有何作用,这对探究真菌的孢子休眠机制可能有重要价值。由于目前尚未有提取稻曲病菌厚垣孢子中cAMP研究方法的报道,因此,本研究以超声-水浴法为基础,探究提取稻曲病菌厚垣孢子cAMP的最适条件,为进一步的研究cAMP功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 稻曲病菌厚垣孢子 于2011年9月从常德市汉寿县军山铺镇的发病水稻(皖稻153)田间采集典型黄色、黄绿色、黑色稻曲球,用刀片将不同颜色稻曲球上的厚垣孢子小心刮下,并存放于-40℃冰箱中备用。
1.1.2 试剂 cAMP标准品(Sigma公司);甲醇(色谱纯Tedia公司);KH2PO4(国药集团上海化学试剂公司);CHCl3(国药集团化学试剂有限公司);正丁醇(国药集团化学试剂有限公司)。
1.1.2 仪器设备 高效液相色谱仪(岛津SPD-20A);超声波振荡器(JY92-Ⅱ型);电热恒温水浴锅(HSY2-SP);旋片式真空泵(ZXZ-1型);高速冷冻离心机(22331 hamburg)。
1.2 方法
1.2.1 样品中cAMP的提取[7]取适量的厚垣孢子粉末,用液氮研磨均匀后[8],置于真空干燥箱中70℃干燥,由于黄绿色厚垣孢子为黄色与黑色厚垣孢子的过渡态,其结构与二者都比较相近,故以黄绿色厚垣孢子为主要提取材料,称取稻曲病菌黄绿色厚垣孢子粉1.0g,加入适量超纯水,超声5~15 min(功率400 W,间歇时间2 s)后,放置于圆底烧瓶中水浴2 h,冷却后,8 000 r/min离心10 min,去除孢壁等物质沉淀,取滤液定容100 mL。进样前,用Sevag法[9]脱蛋白法脱蛋白,将1 mL样品溶液加入到2 mL的小离心管中,加入氯仿-正丁醇(预先配制成体积比为4∶1混合液)溶液0.25 mL,置于2 mL新离心管中,充分振摇30 min后,以12 000 r/min离心5 min,然后将水相与氯仿相分开,取水相到一个新的离心管。
1.2.2 cAMP标准溶液的制备[10]精确称取10 mg cAMP标准品,以超纯水为溶剂,定容于50 mL容量瓶中,制备成 200 μg/mL cAMP标准液,备用。
1.2.3 色谱条件选择[10]根据文献中所提色谱条件,选取甲醇和磷酸二氢钾为流动相,通过V(甲醇)∶V(0.05 mol/L KH2PO4)不同比例10∶90、15∶85、20∶80、25∶75、30∶70 的选择,以及流动相以1.2、1.0、0.8 mL/min 的不同流速选择,获得最佳色谱条件。
1.2.4 cAMP 含量测定[10]①cAMP 的标准曲线制作:分别精确量取1.2.2中的标准溶液1、0.5、0.4、0.3、0.2、0.1、0.05 mL 标准液,置于 10 mL 容量瓶中定容成 20、10、8、6、4、2、1 μg/mL 的浓度梯度。将配置好的不同浓度标准液,各取1 mL溶液,都在12 000 r/min离心5 min,取上清液,过0.22 μm水膜,去除样品中可能给输液泵和柱子造成损伤的杂质后,将滤液以20 μL进样,在波长254 nm处进行HPLC测定。绘制cAMP标准曲线图,建立Y=aX+b回归方程(Y为峰值面积,X为cAMP浓度,a为回归系数,b为常数);②样品的cAMP测定:以1.2.1中的方法处理样品后,取1 mL提取液12 000 r/min离心5 min,取上清液,过0.22 μm 水膜,将滤液以 20 μL 进样,在波长254 nm处进行HPLC测定。
1.2.5 统计分析 根据以超声破碎时间、水浴温度和物料比3因素,及DPS数据处理系统[11]作3因素3水平设计(表1)。以后黄色、黑色厚垣孢子cAMP的提取用该设计优选的条件。
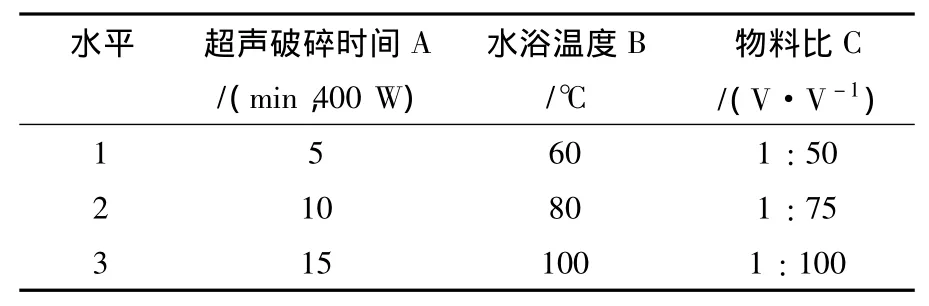
表1 3因素3水平提取厚垣孢子中cAMP的正交设计Table 1 The orthogonal test of the 3 factors and 3 levels for cAMP extraccted from chlamydospores
2 结果与分析
2.1 色谱条件确定
选择色谱柱为Athena C18-WP柱(4.6 mm×250 mm);流动相为 V(甲醇):V(0.05 mol/L KH2PO4)=20∶80;流速为 0.8 mL/min;检测波长为254 nm,进样量为20 μL。根据所选条件,得到样品出峰图(图1、2),显示在该条件下样品出峰分离效果良好。
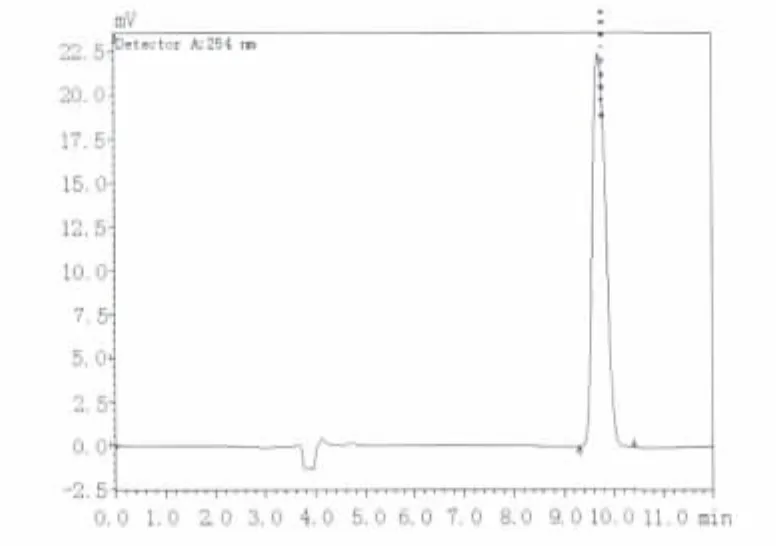
图1 cAMP标准品的HPLC图谱Fig.1 Chromatogrem of standard cAMP
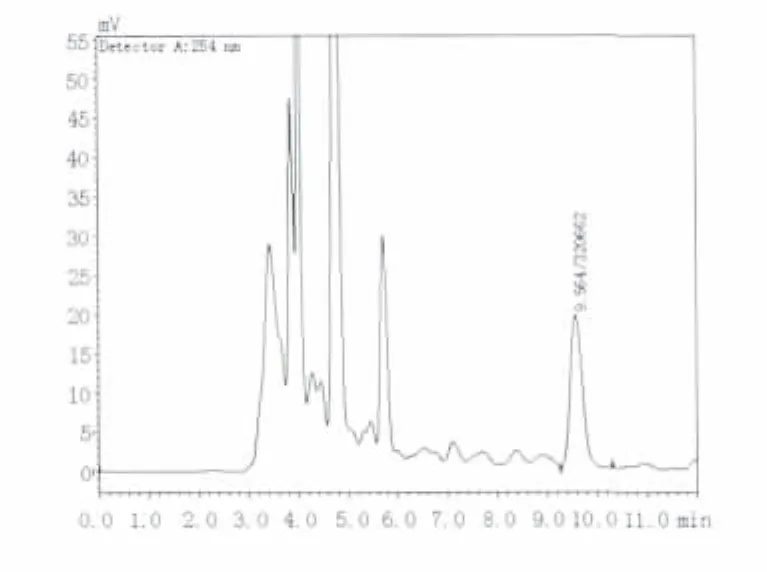
图2 稻曲病菌厚垣孢子中cAMP的HPLC图谱Fig.2 Chromatogrem of cAMP determination in the U.virens of chlamydospores
2.2 标准曲线
根据 1.2.4的标准曲线制作方法,通过HPLC检测,浓度在1~20 μg/mL内色谱峰的面积与样品浓度呈线性关系,根据所得数据绘制标准曲线,并进行数据处理,获得标准曲线(图3),并得回归方程为:Y=69 760X+277.60(式中:Y为标准溶液质量浓度,单位μg/mL;X为峰面积,单位mV),相关系数R2=0.999 8。表明Y与X呈极显著正相关。
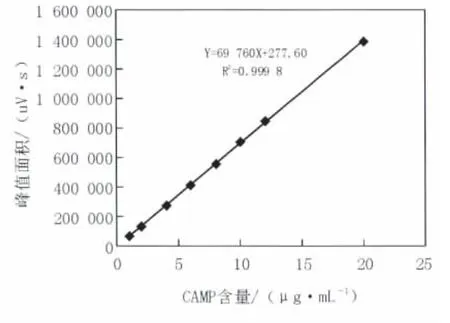
图3 cAMP含量标准曲线Fig.3 Standard curve of cAMP content
2.3 cAMP提取条件优化
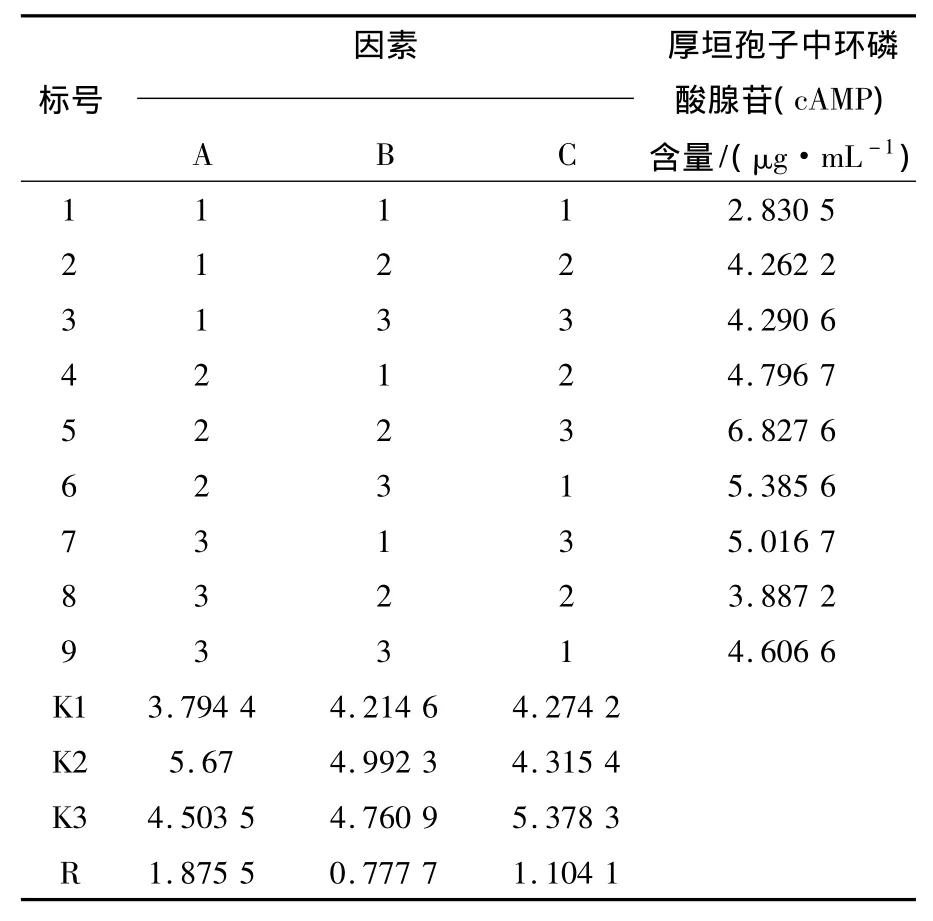
表2 正交试验中测得厚垣孢子cAMP含量Table 2 Relatively cAMP contents of the chlamydospore in orthogonal experiment
采用超声-水浴结合的方式,进行3因素3水平的正交试验(表1),得到结果如表2、3。根据R及P值的大小可知各因素对cAMP提取影响为:A>C>B,说明超声时间对cAMP提取影响最大,其次为物料比率,最小的是水浴温度,最佳的提取条件为A2B2C3。即超声破碎时间10 min,水浴温度80℃,物料比为1∶100。
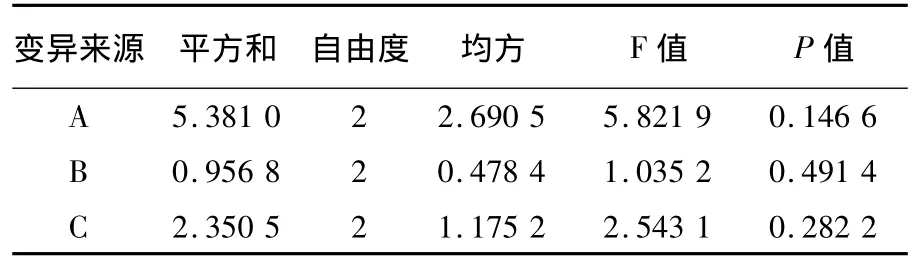
表3 厚垣孢子中cAMP含量的正交设计方差分析表Table 3 Variance analysis of cAMP contents in chlamydospores
2.4 不同颜色厚垣孢子中cAMP含量比较
将稻曲病菌厚垣孢子按照1.2.1所述的条件进行样品处理,并以1.2.3的色谱条件进行检测。通过样品所得峰面积,根据标准曲线的回归方程,参照1.2.4计算出样品中cAMP的含量。不同颜色稻曲病菌厚垣孢子中cAMP含量见表4。
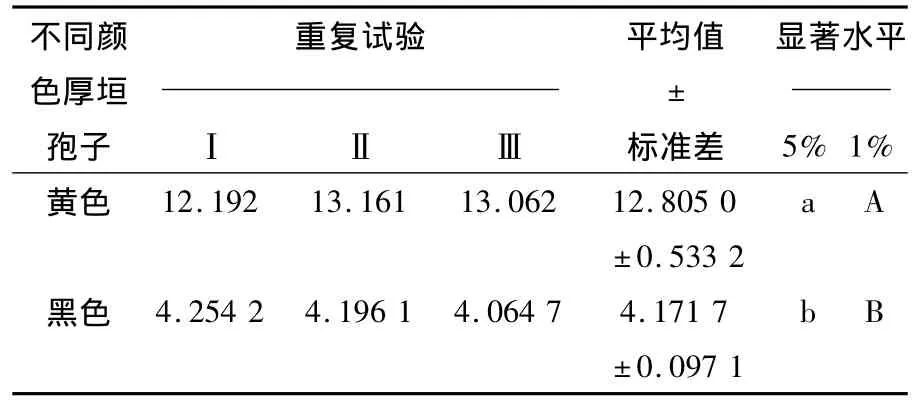
表4 不同颜色厚垣孢子cAMP相对含量Table 4 cAMP contents in the different color chlamydospores
由表4可知,黄色厚垣孢子中cAMP平均含量达到12.805 0 μg/mL,黑色厚垣孢子中 cAMP平均含量为4.171 7 μg/mL。黄色厚垣孢子中的cAMP含量较黑色厚垣孢子中的含量高。
3 讨论
本研究采用超声-水浴结合法黄绿色稻曲病菌厚垣孢子中cAMP提取的不同条件进行了优化比较,得到cAMP得率最高的提取条件:超声破碎时间10 min(功率400 W、间歇时间2 s),水浴温度80℃,物料比为1∶100。
目前国内外对于cAMP提取检测的方式不多,主要集中于酶联免疫、放射免疫以及HPLC法,且多用于动植物细胞,如苏豫梅等[12]用HPLC法对大枣中cAMP进行了提取检测,李建华等[13]用放射免疫法对人体血清中cAMP进行了提取检测,Kimio Uematsu等[14]采用酶联免疫法提取并检测了小列当种子中的 cAMP。对于真菌中cAMP 含量检测,段志兵等[15]与 Chang WQ 等[16]采用了酶联免疫法对绿僵菌和白色念珠菌中的cAMP含量进行了检测。此方法通过加入细胞裂解剂,使细胞破碎,经过特异抗体标记cAMP,再通过特异抗体的显色反应,间接检测cAMP的含量。由于稻曲病菌厚垣孢子壁厚,结构紧密的特质[17],细胞裂解剂并不适用,所以实验参考燕玮婷等[8]对稻曲病菌厚垣孢子的破壁方式,采用超声-水浴结合来进行稻曲病菌厚垣孢子的破壁,再通过HPLC直接检测cAMP的含量,此方法直接、简单且得率高。
已有研究表明,cAMP参与了黑粉病菌、酿酒酵母以及稻瘟病菌的形态发育调控[18]。Borges-Walmsley MI[19]和 D'Souza CA 等[20]发现,cAMP在植物致病性真菌生长发育和致病性的过程中,扮演着极其重要的角色。Takano Y等[21]和Janisiewicz WJ等[22]对 Colletotrichum lagenarium 和Monilinia fructicola的研究表明cAMP含量水平会影响其分生孢子萌发及附着胞的生长,并且影响真菌的致病性。Li Qin等[23]发现在PDA条件下,cAMP可以诱导Coniothyrium minitans产孢缺陷性菌株重新产孢。Tzima A等[24-25]通过基因水平研究表明cAMP-PKA途径调控Verticillium dahliae产孢、菌核形成以及致病性。本研究通过超声-水浴结合法测得的稻曲病菌黄色厚垣孢子中cAMP平均含量达到12.805 0 μg/mL,黑色厚垣孢子中cAMP平均含量为4.171 7 μg/mL。很明显稻曲病菌厚垣孢子由黄色转换为黑色,其厚垣孢子的cAMP含量显著降低。现有研究获悉,稻曲病菌黄色厚垣孢子萌发率显著高于黑色,基于本研究推测cAMP可能参与稻曲病菌厚垣孢子萌发和休眠的调控,其cAMP在稻曲病菌厚垣孢子中萌发和休眠的确切功能性有待于进一步研究。
[1] 黄世文,余柳青.国内稻曲病的研究现状[J].江西农业学报,2002,14(2):45-51.
[2] 唐春生,高家樟,曹国平,等.稻曲病病情分级标准的研究与应用[J].湖南农业大学学报,2000,26(2):122-125.
[3] 陈永坚,肖炎农,赵永静.稻曲病菌越冬厚垣孢子萌发力及其侵染力的研究[J].植物保护学报,1995,22(2):102-106.
[4] Ou SH.Rice Disease.2nd ed[M].Kew:Commonwealth Mycological Institute,1985:307-309.
[5] 张志文.激素第二信使 cAMP的发现[J].生物学通报,2010,45(7):59-62.
[6] Fillinger S,Chaveroche MK,Shimizu K,et al.cAMP and ras signalling independently control spore germination in the filamentous fungus Aspergillus nidulans[J].Molecular Microbiology,2002,44(4):1001-1016.
[7] 崔志强,孟宪军,王传杰.HPLC法测定冬枣环磷酸腺苷含量[J].食品研究与开发,2006,27(7):158-160.
[8] 燕玮婷,刘二明,邓林伟,等.稻曲病菌厚垣孢子不同破壁方法的比较[J].微生物学杂志,2010,30(2):14-17.
[9] 王娜,任佐华,邓林伟,等.稻曲病菌厚垣孢子壁多糖的提取方法优选[J].微生物学通报,2011,38(9):1412-1417.
[10]李学贵,蒋文强,王传芬.HPLC法测定大枣提取液中环腺苷酸含量的研究[J].山东化工,2005,34(5):27-29.
[11]唐启义.DPS数据处理系统(第2版)[M].北京:科学出版社,2010:238-246.
[12]苏豫梅,许玲,孙振荣,等.用HPLC法测定红枣中cAMP含量的研究[J].农产品加工,2011,(7):76-78.
[13]李建华,孙元振,刘冬梅,等.糖尿病患者HA、cAMP检测水平观察[J].放射免疫杂志,2003,16(3):168-169.
[14]Uematsu K,Nakajima M,Yamaguchi I,et al.Role of cAMP in Gibberellin Promotion of Seed Germination in Orobanche minor Smith[J].Plant Growth Regul,2007,26(3):245-254.
[15]段志兵,高强,吕丁丁,等.金龟子绿僵菌附着胞分化及其与环腺苷酸 cAMP的关联性研究[J].菌物学报,2009,28(5):712-717.
[16]Chang WQ,Wu XZ,Cheng AX,et al.Retigeric acid B exerts antifungal effect through enhanced reactive oxygen species and decreased cAMP[J].Biochimica et Biophysica Acta,2011,1810(5):569-576.
[17]燕玮婷,刘二明,邓林伟,等.稻曲病菌不同颜色厚垣孢子超微结构比较[J].植物病理学报2010,40(5):538-542.
[18]Kronstad J,Maria AD,Funnell D,et al.Signaling via cAMP in fungi:interconnections with mitogen-activated protein kinase pathways[J].Arch Microbiol,1998,170(6):395-404.
[19]Borges-Walmsley MI,Walmsley AR.cAMP signalling in pathogenic fungi:control of dimorphic switching and pathogenicity[J].Trends in Microbiology,2000,8(3):33-141.
[20]D'Souza CA,Heitman J.Conserved cAMP signaling cascades regulate fungal development and virulence[J].FEMS Microbiology Review,2001,25(3):349-364.
[21]Takano Y,Komeda K,Kojima K,et al.Proper regulation of cyclic AMP-dependent protein kinase is required for growth,conidiation,and appressorium function in the anthracnose fungus Colletotrichum lagenarium[J].Molecular Plant-Microbe Interactions,2001,14(10):1149-1157.
[22]Janisiewicz WJ,Pimenta RS,Jurick II WM.A novel method for selecting antagonists against postharvest fruit decays originating from latent infections[J].Biological Control,2011,59(3):384-389.
[23]Li Qin,Xiaoyan Gong,Jiatao Xie,et al.Phosphoribosylamidotransferase,the first enzyme for purine de novo synthesis,is required for conidiation in the sclerotial mycoparasite Coniothyrium minitans[J].Fungal Genetics and Biology,2011,(48):956-965.
[24]Tzima AK,Paplomatas E J,Rauyaree P,et al.Roles of the catalytic subunit of cAMP-dependent protein kinase A in virulence and development of the soilborne plant pathogen Verticillium dahliae[J].Fungal Genetics and Biology,2010,47(5):406-415.
[25]Tzima AK,Paplomatas E J,Tsitsigiannis DI.The G protein β subunit controls virulence and multiple growth-and development-related traits in Verticillium dahliae[J].Fungal Genetics and Biology,2012,49(4):271-283.