超声辅助提取华细辛挥发油中甲基丁香酚工艺优化
2013-09-12欧阳天贽
欧阳天贽,袁 泉
武汉理工大学理学院化学系,武汉 430070
细辛为我国传统中药,最早可见于《神农本草经》,具有镇痛、抗炎[1]、抑菌[2]等功效。研究表明,细辛中含有约几十种化学成分,其中甲基丁香酚的含量最高[3-5],是多种植物挥发油的化学成分之一[6]。主要作为调味品用于多种食品中[7]。还可用于化妆品、肥皂、洗发剂、香水中[8]。研究表明甲基丁香酚具有抗过敏、抗组胺、麻醉、降血压、抗抑郁、镇咳、镇痛等多种药理活性[9-11]。
目前对细辛挥发油中甲基丁香酚的研究多集中于定量分析[12-14],提取方法多采用传统提取法,超声辅助提取法(ultrasonic assisted extraction,UAE)的运用可提高细辛挥发油的提取效率[15]。本实验通过研究超声辅助提取过程中料液比、浸泡时间、提取温度、提取时间对甲基丁香酚得率的影响,在单因素实验的基础上,建立L9(34)正交试验,优化超声辅助提取华细辛挥发油中甲基丁香酚的工艺条件,为华细辛的开发利用提供理论依据。
1 材料与方法
1.1 材料与设备
细辛购于湖北省武汉市药材市场(产地:湖北恩施),经华中农业大学植物科学技术学院张宏宇教授鉴定为华细辛(Asarum sieboldii Miq.)的干燥根茎。样品经粉碎后密封保存待用;甲基丁香酚标准品为美国Accustandard公司;其它试剂均为国产分析纯。
KQ5200E超声波仪(昆山市超声仪器有限公司);Agilent 6890N气相色谱仪(美国);FA2204B型电子天平(上海精密科学仪器有限公司)。
1.2 实验方法
1.2.1 GC 分析条件
色谱柱:安捷伦DB-35MS毛细管色谱柱(30 m× 0.32 mm × 0.25 μm);升温程序:初始温度 100℃,保持1 min,以20℃/min升到160℃,5℃/min升到190℃,20℃/min升到220℃保持5 min;进样口温度:220 ℃;检测器:250 ℃;进样量:0.5 μL。分流比:10∶1。
1.2.2 精密度考察实验
取8批样品,每批样品测定两次甲基丁香酚的质量分数,通过绝对极差和相对极差推算出测定相对标准偏差,判断仪器的精密度。
1.2.3 回收率试验
提取样品中加入一定量的甲基丁香酚的正辛醇标准溶液后,测得甲基丁香酚的质量分数,计算加入标准溶液后的甲基丁香酚质量百分数理论值,由此计算得到甲基丁香酚的回收率。
回收率=(加标试样测定值-试样测定值)÷加标量×100%
1.2.4 甲基丁香酚标准储备液的制备和标准曲线的制作
电子天平上去皮后准确称取甲基丁香酚标准品0.0131 g,用移液管加甲醇定量至 1.8040 g,摇匀得到质量分数为7.3%的甲基丁香酚标准溶液。
正辛醇甲醇溶液的配制:取1.67 mL正辛醇和18.33 mL甲醇溶液混合而成20 mL体积分数为8.4%的正辛醇甲醇溶液。
分别取上述甲基丁香酚标准溶液 0.0686、0.1452、0.2754、1.0000 g,分别用甲醇定量至1.0000 g,配制成甲基丁香酚质量分数分别为0.05、0.10、0.20、0.73% 的梯度溶液,分别加入 20 μL 体积分数为8.4%的正辛醇甲醇溶液,按实验设定的方法分别进行GC测定,以甲基丁香酚质量分数对甲基丁香酚与正辛醇的峰面积比进行线性回归分析,得回归方程为Y=6.446X+0.0229(Y是甲基丁香酚与正辛醇的峰面积比,X是甲基丁香酚质量分数),R2=0.9997,对照品质量分数在0.05 ~0.73%范围内与峰面积比有良好的线性关系。
1.2.5 甲基丁香酚的提取
准确称取1.0 g细辛根粉末,置于100 mL锥瓶中,按料液比1∶40加入甲醇溶液,超声提取15 min,过滤。滤渣以相同的条件再提取一次,过滤后合并滤液,水浴40℃条件下用旋转蒸发仪旋转蒸发仪旋干甲醇溶液后,40℃真空干燥1 h,用1.00 g甲醇溶解,准确加入20 μL前述配制正辛醇甲醇溶液,微孔滤膜过滤,气相色谱分析,选取正辛醇作为内标物内标法定量。
根据标准曲线方程求出提取物中甲基丁香酚的质量,按下面方法计算甲基丁香酚的得率:
甲基丁香酚得率=甲基丁香酚质量/华细辛质量×100%
1.2.6 单因素实验
考察不同料液比(g/mL)、浸泡时间、提取温度、提取时间对华细辛挥发油中甲基丁香酚得率的影响。按照1.2.2所需方法进行后处理和分析获得得率。
1.2.7 正交试验
根据单因素实验的结果对料液比、浸泡时间、提取温度、提取时间这四个单因素实验参数进行筛选,按照每一个因素对提取影响的大小顺序,,建立正交试验因素水平表。根据因素水平表由正交设计助手Ⅱ软件建立L9(34)正交试验。按照上述同样方法后处理和分析。
2 结果与分析
2.1 方法学考察
2.1.1 内标物选择和方法专属性实验
分别对甲基丁香酚的正辛醇对照品溶液及1.2.4法提取的样品溶液进行GC分析,所得气相色谱图分别如图1,图2所示。


由图1中可知甲基丁香酚的保留时间为6.611 min,其它组分对测定无干扰。
在所选试剂正丁醚、二甲苯、环己酮、正辛醇中仅正辛醇符合作为内标物的要求,加入正辛醇的萃取物样品溶液GC分析气相色谱图见图3。

图3 细辛提取样中加入正辛醇的气相色谱图Fig.3 Gas chromatogram of octanol in A.Sieboldii extract
2.1.2 精密度实验
取8批1.2.4法提取的样品,每批样品测定两次,测定结果如表1所示。表1中,N为批次号,A1、A2为测定的甲基丁香酚的质量分数,A为甲基丁香酚质量分数的平均值,R为绝对极差(=最大值-最小值)为相对极差(=R/A×100%)。相对极差平均值=2.52%,根据相对极差平均值可推算出测定相对标准偏差:


表1 精确度校核实验结果Table 1 Results of the precision tests
式中,1/d2为由极差估算标准偏差的系数,对于成对试验为0.8865。样品中甲基丁香酚质量分数在2‰ ~5‰之间,测定的相对标准偏差为2.23%,表明仪器精密度良好。
2.1.3 回收率实验
加标前提取样品中甲基丁香酚的质量分数为0.419%,加入一定量的甲基丁香酚的正辛醇标准溶液后,测得甲基丁香酚的质量分数为0.490%,加入标准溶液后的甲基丁香酚质量百分数理论值是0.487%,因此,计算得到甲基丁香酚的回收率为104%,回收率符合实验要求。
2.2 单因素实验
2.2.1 料液比对甲基丁香酚得率的影响

图4 料液比(g/mL)对甲基丁香酚得率的影响Fig.4 Effect of material-liquid ratio on extraction rate of methyl eugenol
图4为浸泡时间4 h、提取温度40℃、提取时间15 min的条件下,不同料液比对甲基丁香酚得率的影响。由图4可知,随料液比增加,甲基丁香酚得率变大。当料液比达到1∶40时提取率趋于稳定。
超声振荡下,提取溶剂量越大,浸润和渗透速度越快,化学成分溶解速率和扩散速度越大,提取率越高,当溶剂达到一定量时,浸出化学物质趋于饱和。考虑成本和环境友好,选择料液比1∶40进行以下单因素实验。
2.2.2 浸泡时间对甲基丁香酚得率的影响

图5 浸泡时间对甲基丁香酚得率的影响Fig.5 Effect of the immersion time on extraction rate of methyl eugenol
图5为料液比1∶40、提取温度40℃、提取时间15 min的条件下,不同浸泡时间对甲基丁香酚得率的影响。由图5可知,浸泡时间达到5 h的时候,甲基丁香酚提取率达到最大值,随后下降。
超声辅助提取中,提取溶剂渗透到细胞内并将有效化学成分溶解,由于浓度差关系,溶解的化学成分扩散到提取溶剂中,但有醇溶性杂质、色素等非有效成分同时溶解并扩散出来,与有效成分的扩散过程竞争,导致有效成分的扩散速率降低,提取率下降。选择浸泡5 h进行以下单因素实验。
2.2.3 提取温度对甲基丁香酚得率的影响

图6 提取温度对甲基丁香酚得率的影响Fig.6 Effect of extraction temperature on extraction rate of methyl eugenol
图6为料液比1∶40、浸泡时间5 h、提取时间15 min的条件下,不同提取温度对甲基丁香酚得率的影响。由图6可知,提取温度从20℃升高到60℃时,甲基丁香酚得率升高,60℃ 时达到最高,随后开始下降,70℃后保持稳定。
超声辅助提取过程中,温度升高导致超声空化作用产生的冲击波冲向物料,引起物料内部细胞结构变化,促使提取溶剂进入植物组织细胞内的速度和化学成分的溶解增大,因此,随着温度的升高,甲基丁香酚得率迅速升高。由于植物中的某些化学成分热稳定性差,随温度过高而分解,导致得率下降到一定值后稳定。所以选择60℃进行以下单因素实验。
2.2.4 提取时间对甲基丁香酚得率的影响
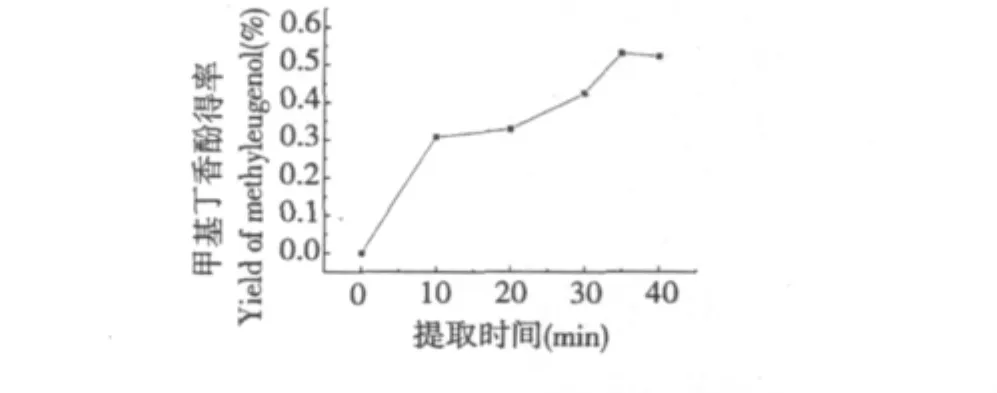
图7 提取时间对甲基丁香酚得率的影响Fig.7 Effect of extraction time on extraction rate of methyl eugenol
图7为料液比1∶40、浸泡时间5 h、提取温度60℃的条件下,不同提取时间对甲基丁香酚得率的影响。由图7可知,随着提取时间的逐渐增加,甲基丁香酚的得率增大,当超声提取35 min之后,得率变化缓慢并趋于稳定。
超声振荡下,提取溶剂首先通过细胞壁进入到细胞内,然后溶解细胞内的化学成分,再扩散出细胞外进入提取溶液中,过程复杂。所以,随提取时间增大,进入到细胞内的提取溶剂越多,溶解化学成分的速度越快,扩散速度也增大,得率随之增大。达到一定提取时间后,细胞内化学成分已被充分提取出来,得率不再增加。
2.3 正交实验
根据单因素实验的结果,建立正交实验因素水平表如表2所示。

表2 正交实验因素与水平表Table 2 Factors and levels of orthogonal test
根据表2由正交设计助手Ⅱ软件建立L9(34)正交实验,通过正交实验对超声辅助提取华细辛挥发油中甲基丁香酚的工艺条件进行优化,实验结果见表3。
从表3中直观分析可知RA>RC>RD>RB。即四个因素中料液比对挥发油提取率的影响最大,其次是提取温度和提取时间,浸泡时间对挥发油提取率的影响最小。
可知UAE法提取华细辛挥发油中甲基丁香酚的最佳工艺条件为A3B1C2D3,即料液比1∶40、浸泡时间3 h、提取温度60℃、提取时间40 min。
2.4 验证实验
按上述UAE法提取的最佳工艺条件,重复提取华细辛挥发油中甲基丁香酚3次,甲基丁香酚得率分别为 0.662%、0.657%、0.665%,平均得率为0.661%,绝对偏差分别为:0.001、-0.004、0.004,相对偏差分别为:0.151%、-0.605%、0.605%。此条件下的甲基丁香酚得率比正交试验任意组的得率高。
3 结论
采用超声辅助提取法提取华细辛挥发油中甲基丁香酚并采用内标法定量分析,分别考察料液比、浸泡时间、提取温度、提取时间等因素对甲基丁香酚得率的影响,在单因素实验基础上,采用正交实验优化了甲基丁香酚的超声提取工艺条件,结果表明最佳提取条件为:浸泡时间为3 h,料液比为1∶40,提取温度为60℃,在此条件下,UAE法提取华细辛挥发油中甲基丁香酚需40 min,此条件下平均得率为:0.661%。
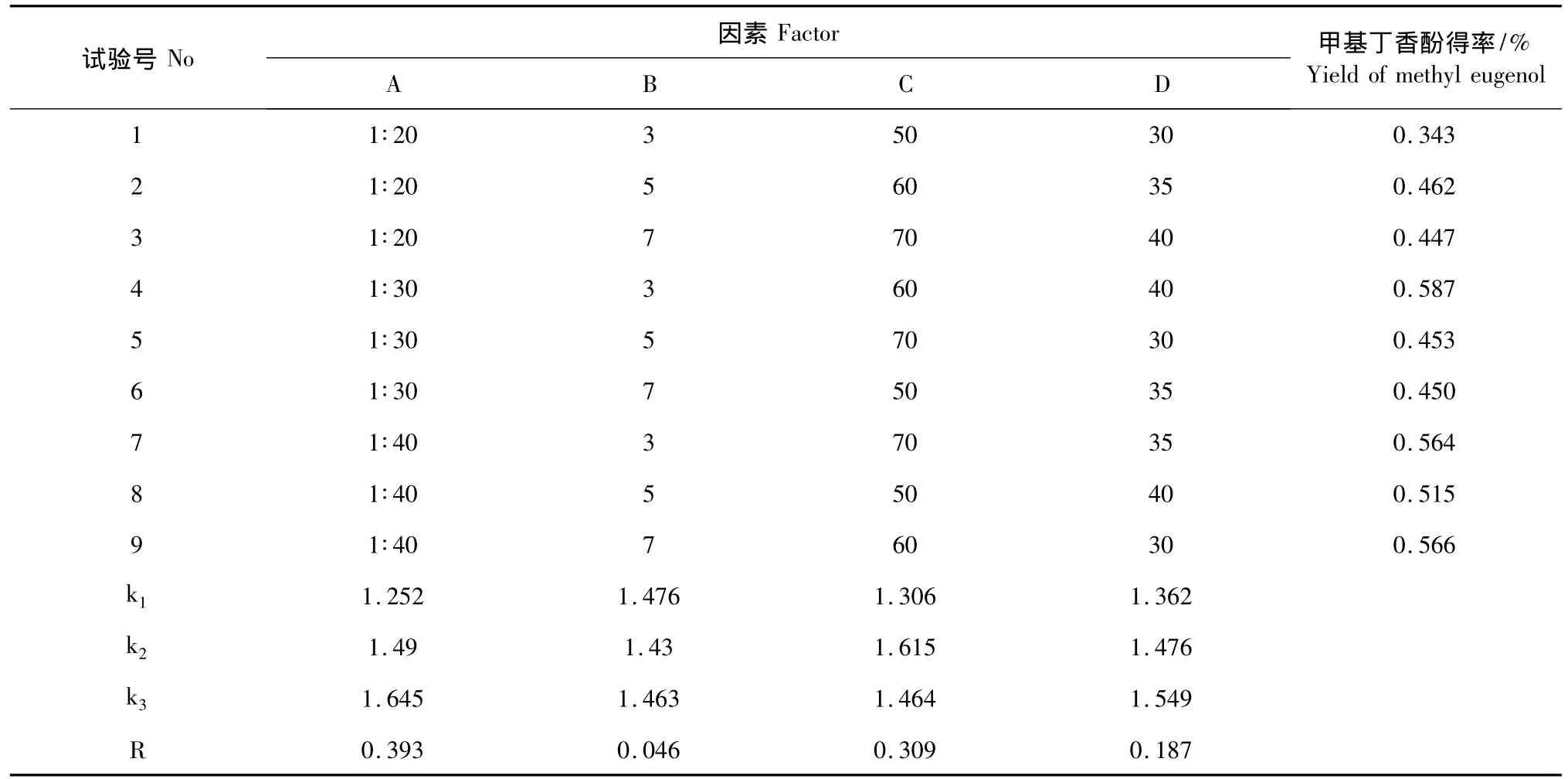
表3 甲基丁香酚提取工艺正交实验结果Table 3 Results of orthogonal test
1 Xiong YL(熊玉兰),Jin Y(荆宇),Shang MY(尚明英),et al.Anti-inflammatory and anti-nociceptive effects in mice of water andethanol extracts of roots and rhizomes of Asarum heterotropoides var.mandshuricum.China J Chin Mater Med(中国中药杂志),2009,34:2252-2257.
2 Duan HZ(段鹤君),Fu ZH(付朝晖).Studies on chemical constituents of volatile oil.J Chin Med Mater(中药材),2010,33:362-365.
3 Zhang F(张峰),Wang LX(王龙星),Luo X(罗茜),et al.Analysis of colatile constituents of Root and Rhizome of Asarum heterotropoides Fr.var.mandshuricum(Maxim.)Kitag.by Gas Chromatography-Mass Spectrometry.Chin J Chromatogr(色谱),2002,20:467-470.
4 Yang HL(杨厚玲),Qiu Q(邱琴),Chen TT(陈婷婷),et al.GC-MS composition analysis of the north volatile oil extracted by different methods.Chin Pharm J(中国药学杂志),2007,42:1031-1033.
5 Chen P(陈蓓),Hu SY(胡苏莹),Li KW(李昆伟),et al.The volatile components of three Radix et Rhizoma Asari.J Chin Med Mater(中药材),2010,33:1886-1893.
6 Yano S,Suzuki Y,Yuzurihara M,et al.Antinociceptive effect of methyleugenol on formalin-induced hyperalgesia in mice.Euro J Pharmacol,2006,553:99-103.
7 Siano F,Ghizzoni C,Gionfriddo F,et al.Determination of estragole,safrole and eugenolmethyl ether in food products.Food Chem,2003,81:469-475.
8 Zhou D,Moorthy B,Bi J,et al.DNA adducts from alkoxyallylbenzene herb and spice constituents in cultured human(HepG2)cells.Environ Mol Mutagen,2007,48:715-721.
9 Kosuge T,Yokota M,Nukaya H,et al.Studies on antitussive principles of Asiasari Radix.Chem Pharm Bull,1978,26:2284-2285.
10 Lahlou S,Figueiredo AF,Magalhaes PJC,et al.Cardiovascular effects of methyleugenol,a natural constituent of many plant essential oils,in normotensive rats.Life Sci,2004,74:2401-2412.
11 Liang XQ(梁学清),Li DD(李丹丹).Progress research on pharmacological activities of Asarum.J Henan Univ of Sci Tech,Med Sci(河南科技大学学报,医学版),2011,4:316-318.
12 Wang D(王栋),Wang XJ(王喜军),Xia XH(夏晓晖).A-nalysis of season variation of methyleugenol and safrole in Asarum Heterotropoides by Gas Chromatography.Chin J Chromatography(色谱),1997,15:85-86.
13 Zhou CZ(周长征),Yang CP(杨春澍),Ma CH(马长华),et al.Quantitative determination of methyleugenol and safrole in Herba Asari by gas chromatography.Chin Pharm J(中国药学杂志),1999,34:836-838.
14 Wu ZG(吴振刚),Wang QW(王庆伟),Liu XY(刘雪英),et al.Determination of methyleugenol and safrole in essential oil of Asarum by RP-HPLC.J Fourth Military Med Univ(第四军医大学学报),2008,29:1175-1177.
15 Pan HL(潘红亮),Ouyang TZ(欧阳天贽).Comparative analysis of volatile oil extracted from Asarum sieboldii Miq.by steam distillation and ultrasound-assisted extraction.Food Sci(食品科学),2011,32:190-193.
