南海深海链霉菌Streptomyces albiflaviniger SCSIO ZJ28中Elaiophylin的分离鉴定
2013-09-12宋永相陈芸芸黄洪波鞠建华
张 云,周 潇,宋永相,陈芸芸,黄洪波,李 洁,华 燕,鞠建华*
1中国科学院海洋生物资源可持续利用重点实验室广东省海洋药物重点实验室中国科学院海洋微生物中心中国科学院南海海洋研究所广州 510301;2中国科学院研究生院,北京 100049;3西南林业大学,昆明 650224;4中山大学药学院,广州 510006
广袤的海洋蕴藏着丰富的、有待开发的生物资源。近年来,随着对海洋认识的不断深入,以及海洋科学技术的不断发展,人们提出了“向海洋要药”的口号。海洋微生物广泛栖息于海洋动植物、海水及海底沉积物中。海洋迥异于陆地的环境及生态系统赋予海洋微生物在生理性状和遗传背景上以特殊性和多样性,导致其次级代谢产物具有结构多样性、新颖性,活性特殊性、显著性[1],这为新型抗生素的发现提供了重要的先导化合物。
海洋放线菌是重要的药源微生物,人们从海洋放线菌中发现了一系列具有抗菌、抗肿瘤、抗疟疾、抗炎等活性的大环内酯类、醌类和生物碱类等新结构的天然产物[2,3]。近年从我国南海海域的海底沉积物中也发现了许多新的放线菌资源[4-6]。随着深海勘探和海底作业技术的提高,人们把探索的目光从近海浅海转向深海大洋,从深海海底沉积物中发现了许多不同于陆地或浅海的新的海洋放线菌类群[4,7]。本课题组一直致力于海洋放线菌活性次级代谢产物及其生物合成方面的研究,已经从来自于南海的海洋放线菌中分离得到了具有多样生物活性的、结构新颖的次级代谢产物,如从海洋链霉菌Streptomyces sp.SCSIO 1666及1667中分离得到了具有抗肿瘤、抗菌活性的吲哚咔唑生物碱及替达霉素类化合物[8,9]。值得一提的是,我们从源自于南海3865米深海的放线菌新属新种Marinactinospora thermotolerans SCSIO 00652中发现了具有抗疟原虫Plasmodium falciparum药敏株3D7及耐药株Dd2活性的β-咔啉新生物碱marinacarbolines A-D及吲哚内酰胺类新生物碱[10],从来源于南海3370 m水深的链霉菌S.lusitanus SCSIO LR32中分离得到了具有抗菌活性的芳酰胺类化合物[11],以及具有细胞毒活性的角环素类新化合物grincamycins B-F[12]。近来,我们通过卤虫致死活性和抗菌活性筛选,获得了一株发酵产物具较强抗菌及卤虫致死生物活性的海洋放线菌SCSIO ZJ28,该菌来源于南海3536米水深的海底沉积物,经16S分子生物学鉴定为链霉菌Streptomyces albiflaviniger。本文报道该深海放线菌的分子生物学鉴定及其代谢产物elaiophylin(1)的发酵、分离和鉴定。
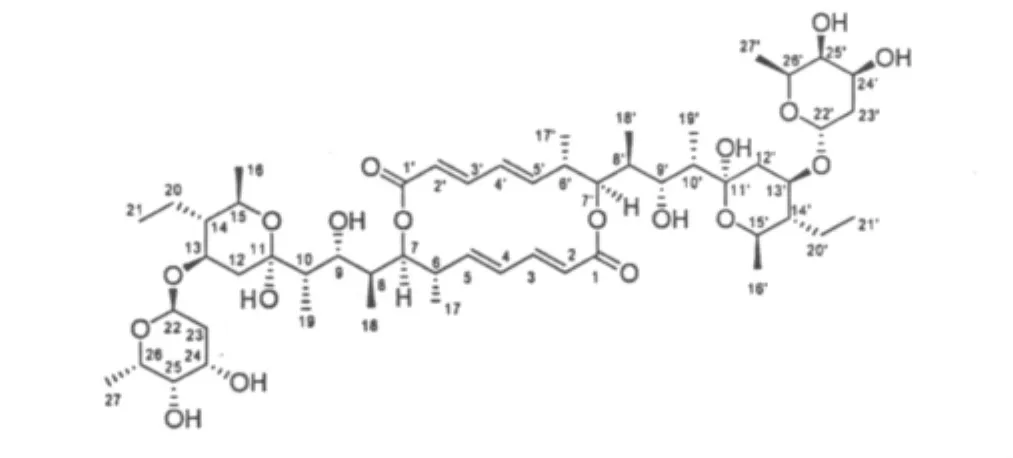
图1 化合物1的结构式Fig.1 Chemical structure of compound 1
1 材料与方法
1.1 材料与仪器
Bruker AVANCE DRX 500核磁共振仪(500/125 MHz,TMS为内标);Bruker amaZon SL离子肼质谱仪;Varian ProStar高效液相色谱仪(配PDA检测器);YMC-Pack ODS-A半制备色谱柱(250×10 mm,5 μm);硅胶薄层层析板(HSGF254)和柱层析用硅胶(100~200目)均为烟台江友硅胶开发有限公司产品;中压制备层析系统EZ Purifier III(上海利穗化工科技有限公司);YMC GEL ODS-A(75 μm);色谱纯乙腈(安徽时联公司);氘代氯仿(CIL);其它化学试剂皆为国产分析纯。
放线菌Streptomyces albiflaviniger SCSIO ZJ28分离自中国南海北部(E 120°0.250'',N 20°22.971'')水深3536 m的海底沉积物样品,菌种保存于中国科学院海洋微生物中心。
M-AM2ab培养基:豆粉0.5%,酵母粉0.5%,可溶性淀粉2%,细菌学蛋白胨0.2%,海盐3%,碳酸钙0.2%,pH 7.2 ~7.4,121 ℃灭菌 30 min 备用。
1.2 方法
1.2.1 海洋链霉菌SCSIO ZJ28的分子生物学鉴定
1.2.1.1 16S rRNA 基因序列的 PCR 扩增
用细菌16S rRNA的简并引物,27F primer(5'-AGAGTTTGATC(AC)TGGCTCAG-3')和1492R primer(5'-ACGG(CT)TACCTTGTTACGACTT-3'),进行PCR扩增。PCR反应体系(25 μL):DNA模板0.5 μL,10 × PCR Buffer 2.5 μL,dNTP(各 2.5 mmol/L)2 μL,27F primer(20 μmol/L)0.5 μL,1492R primer(20 μmol/L)0.5 μL,Tap 酶(5 U·μL)0.2 μL,DMSO 1.25 μL,ddH2O 17.55 μL。PCR 反应条件为94℃预变性5 min,94℃变性1 min;59℃退火1 min,72℃延伸1.5 min;30个循环;72℃延伸10 min;4℃保温。
1.2.1.2 扩增产物的序列测定
用凝胶回收试剂盒(OMEGA)纯化PCR产物,再连接到pCR2.1载体(Invitrogen)中,16S rRNA基因序列由上海美吉生物医药科技有限公司测定。将测出的16S rRNA基因序列进行BLAST分析(http://blast.ncbi.nlm.nih.gov/)。
1.2.1.3 系统发育树的构建
通过CLUSTALX软件进行海洋链霉菌菌株SCSIO ZJ28及链霉菌属最相似菌株的16S rRNA基因序列的对比,使用软件MEGA4构建系统进化树。
1.2.2 菌株的发酵培养
种子培养基和发酵培养基均采用M-AM2ab培养基。种子液用250 mL锥形瓶,每瓶加入50 mL培养基,从平板上接入适量菌种,于28℃、200 rpm的摇床上培养36 h后分别转接于2 L锥形瓶,每瓶200 mL培养基,于28℃、200 rpm条件下培养7 d。
1.2.3 卤虫致死活性检测
取5 mg/mL的DMSO样品提取物溶液5 μL,分别加入到200 μL人工海水、含有10~15个海虾幼虫96孔板中,同时设置DMSO空白组,室温下,在30 min 及1,2,3,5,10,24 h 时计数海虾幼虫死亡个数,计算致死率,以观察卤虫致死活性。
1.2.4 抗菌活性检测
取5 mg/mL的DMSO样品提取物溶液5 μL,加到直径为0.6 cm无菌滤纸片上,置于含枯草芽孢杆菌Bacillus subtilis ATCC6633和大肠杆菌Escherichia coli ATCC25922的LB检测平板,37℃培养24 h,测量抑菌圈大小,判断抑菌活性。
1.2.5 发酵产物的提取与分离
发酵产物(6 L)于4000 rpm离心10 min,分离得到上清液和菌丝体部分,分别用等体积的丁酮和丙酮反复萃取4次,减压浓缩后得到上清液和菌丝体粗提物,经HPLC检测发现其成分相似,予以合并,得浸膏9.5 g。采用正相柱层析,氯仿/甲醇梯度(100∶0,98∶2,96∶4,94∶6,92∶8,90∶10,8∶2,5∶5)洗脱共得到8个组份Fr.1~Fr.8。活性追踪显示亚组分Fr.4~Fr.7为活性组分,进一步经过中压反相柱层析,甲醇/水梯度(100∶0~0∶100)洗脱得到组分Fr.A-1 ~Fr.A-17,通过 TLC 验证合并后对其中 Fr.A-15~Fr.A-17进行常压正相柱层析,石油醚/乙酸乙酯梯度(8∶2,7∶3,6∶4,5∶5,4∶6,3∶7,2∶8,1∶9,0∶10)洗脱,再以半制备HPLC(乙腈/水75% ~100%线性洗脱30 min,流速2.5 mL/min)分离,得到化合物1(12 mg,tR=28 min),分离收率为2 mg/L。
2 结果与讨论
2.1 菌株鉴定
菌株SCSIO ZJ28在ISP2(酵母提取粉0.4%,麦芽提取粉1%,葡萄糖0.4%,海盐3%,pH 7.2~7.4)固体培养基上30℃培养4~5 d后,形成发达的白色气生菌丝和浅黄褐色基生菌丝。16S rRNA基因序列(GenBank JX020704)分析表明 SCSIO ZJ28与链霉菌属 S.albiflaviniger NRRL B-1356T(AJ391812)相似性较高 (99.58%),且聚在同一个进化分支,有较高的自举值(88%)支持。故鉴定该菌株为S.albiflaviniger SCSIO ZJ28,其系统发育树见图2,菌落形态图见图3。

图2 基于16S rRNA基因序列构建的SCSIO ZJ28与其他链霉菌菌种NJ分子系统进化树Fig.2 Neighbour-joining tree based on 16S rRNA gene sequences showing relationship between strain SCSIO ZJ28 and closely related members of genus Streptomyces

图3 菌株SCSIO ZJ28在ISP2培养基上的形态图Fig.3 Phenotype of strain SCSIO ZJ28 on ISP2-meduim plate
2.2 结构鉴定
化合物1白色粉末,(+)ESI-MS给出准分子离子峰 m/z 1047.6[M+Na]+,提示其分子量为1024.6。化合物1的13C NMR仅给出了27个碳信号,故判断化合物1存在对称结构,进而推测其分子式为C54H88O18。化合物的1H及13C NMR数据与文献对照基本一致[13],故鉴定化合物1为elaiophylin。值得注意的是,文献报道C-8和C-12的化学位移分别为 δ 35.9,38.9[13],通过 HMQC 谱发现,δ 1.02 及2.38 的两个质子是连接 δ 39.0 的碳上,而 δ 1.93 的质子是连接在δ 35.9的碳上,故C-8和C-12的化学位移应更正为δ 39.0和35.9。在通过在甲醇溶液中培养,获得了化合物1的单晶,通过X-单晶衍射确认了化合物1的结构(图4)。化合物1的NMR和(+)ESI-MS数据如下:1H NMR(CDCl3,500 MHz)δ:5.65(1H,d,J=15.3 Hz,H-2),6.98(1H,dd,J=15.3,11.2 Hz,H-3),6.13(1H,dd,J=15.0,11.2 Hz,H-4),5.64(1H,dd,J=15.0,10.0 Hz,H-5),2.55(1H,m,H-6),4.73(1H,d,J=10.4 Hz,H-7),1.93(1H,m,H-8),3.94(1H,m,H-9),1.71(1H,m,H-10),1.02(1H,overlapped,H-12),2.38(1H,dd,J=11.9,4.5 Hz,H-12),4.11(1H,m,H-13),1.19(1H,m,H-14),3.89(1H,m,H-15),1.10(3H,d,J=6.2 Hz,H-16),1.04(3H,d,J=7.0 Hz,H-17),0.81(3H,d,J=6.9 Hz,H-18),0.99(3H,d,J=7.0 Hz,H-19),1.66(1H,m,H-20),1.46(1H,m,H-20),0.85(3H,t=7.6 Hz,H-21),5.05(1H,br s,H-22),1.79(2H,dd,J=11.4,4.8 Hz,H-23),3.98(1H,m,H-24),3.62(1H,m,H-25),4.01(1H,m,H-26),1.25(3H,d,J=6.8 Hz,H-27);13C NMR(CDCl3,125 Hz)δ:169.9(C-1),121.0(C-2),144.4(C-3),132.0(C-4),145.0(C-5),40.9(C-6),77.9(C-7),35.9(C-8),70.4(C-9),41.8(C-10),99.1(C-11),39.0(C-12),70.6(C-13),48.5(C-14),66.6(C-15),19.2(C-16),15.0(C-17),9.3(C-18),7.0(C-19),19.5(C-20),8.7(C-21),93.3(C-22),33.7(C-23),65.9(C-24),71.5(C-25),66.1(C-26),16.8(C-27);(+)ESI-MS m/z 1047.6[M+Na]+。

图4 化合物1的单晶结构图Fig.4 The X-ray structure of compound 1
2.3 讨论
海洋放线菌Streptomyces albiflaviniger SCSIO ZJ28的发酵产物具有较好的抗菌活性和卤虫致死活性,我们从中分离鉴定了一类糖基化的大环内酯类抗生素elaiophylin(1)。菌株SCSIO ZJ28成为一种产elaiophylin的耐盐微生物资源。Elaiophylin已在多种链霉菌发酵产物中被发现,具有很好的抗球虫活性,所以被用作为化学合成抗球虫剂的前体[15,16]。该类化合物还具有抗细菌、抗真菌及细胞毒等生物活性。同时,文献报道elaiophylin具有增强瘤胃效率及抗溃疡的作用[17,18]。对生产重要生物活性化合物的产生菌进行代谢工程和生物合成研究,可以提高目标化合物的产量,构建新结构衍生物并发现新的催化机制[19-21]。在后续的工作中,我们将通过代谢工程和组合生物合成技术对elaiophylin的生物合成途经进行研究,获得人工基因置换或缺失的突变菌株,以期提高化合物产量,或者生产新结构衍生物,为新的大环内酯类抗生素的发现提供先导化合物。
1 Lin YC(林永成).Marine Microorganism and Their Metabolites(海洋微生物及其代谢产物).Beijing:Chemical Industry Press,2003.170.
2 Sobolevskaia MP,Kuznetsova TA.Biologically active metabolites of marine actinobacteria.Russ J Bioorg Chem,2010,36:560-573.
3 Wang X(王幸),Wu WH(吴文惠),Chen ZH(陈志华),et al.Research progress on bioactive metabolites from marine microorganism and their structures.Chin J Nat Med(中国天然药物),2010,8:309-320.
4 Tian XP,Tang SK,Dong JD,et al.Marinactinospora thermotolerans gen.nov.,sp.nov.,a marine actinomycete isolated from a sediment in the northern South China Sea.Int J Syst Evol Micr,2009,59:948-952.
5 Tian XP,Zhi XY,Qiu YQ,et al.Sciscionella marina gen.nov.,sp.nov.,a marine actinomycete isolated from a sediment in the northern South China Sea.Int J Syst Evol Micr,2009,59:222-228.
6 Tian XP,Zhang YQ,Li QX,et al.Streptomyces nanshensis sp.nov.,isolated from the Nansha Islands in the South China Sea.Int J Syst Evol Micr,2009,59:745-749.
7 Fenical W,Jensen PR.Developing a new resource for drug discovery:marine actinomycete bacteria.Nat Chem Biol,2006,2:666-673.
8 Zhou JY(周俊勇),Huang HB(黄洪波),Wang ZW(汪中文),et al.The metabolites of indolocarbazole alkloids from the marine-derived Streptomyces sp.SCSIO 1667.Nat Prod Res Dev(天然产物研究与开发),2011,23:415-419.
9 Duan CR(段传人),Yao YL(姚月良),Wang ZW(汪中文),et al.Fermentation optimization ,isolation and identification of tirandamycins A and B from marine-derived Streptomyces sp.SCSIO 1666.Chin J Mar Drugs(中国海洋药物杂志),2010,29(6):12-20.
10 Huang H,Yao Y,He Z,et al.Antimalarial β-carboline and indolactam alkaloids from Marinactinospora thermotolerans,a deep sea isolate.J Nat Prod,2011,74:2122-2127.
11 Ren XM(任香梅),Huang HB(黄洪波),Liu J(刘静),et al.Aromatic amide metabolites from the marine-derived Streptomyces lusitanus SCSIO LR32.Nat Prod Res Dev(天然产物研究与开发),2011,23:591-595.
12 Huang H,Yang T,Ren X,et al.Cytotoxic angucycline class glycosides from the deep sea actinomycete Streptomyces lusitanus SCSIO LR32.J Nat Prod,2012,75:202-208.
13 Lee SY,Kim MS,Kim HS,et al.Structure determination and biological activities of elaiophylin produced by Streptomyces sp.MCY-846.J Microbiol Biotechnol,1996,6:245-249.
14 Ritzau M,Heinze S,Fleck WF,et al.New macrodiolide antibiotics,11-O-monomethyl-and 11,11'-O-dimethylelaiophylins,from Streptomyces sp.HKI-0113 and HKI-0114.J Nat Prod,1998,61:1337-1339.
15 Hammann P,Kretzschmar G,Klein R,et al.Secondary metabolites by chemical screening 14.transformation of elaiophylin in subunits of naturally occurring acid ionophores:synthesis,anticoccidial activity and studies concerning the ionophoric properties.Heterocycles,1991,82:1471-1482.
16 Hammann P,Kretzschmar G,Seibert G.Secondary metabolites by chemical screening.7.1.elaiophylin derivatives and their biological activities.J Antibiot,1990,43:1431-1440.
17 Hammann P,Kretzschmar G.Secondary metabolites by chemical screening.12.13C NMR studies of elaiophylin derivatives.Magn Reson Chem,1991,29:667-670.
18 Liu CM,Jensen L,Westley JW,et al.Elaiophylin as a rumen fermentation efficiency enhancer.J Antibiot,1993,46:350-352.
19 Mo X,Wang Z,Wang B,et al.Cloning and characterization of the biosynthetic gene cluster of the bacterial RNA polymerase inhibitor tirandamycin from marine-derived Streptomyces sp.SCSIO1666.Biochem Biophy Res Commun,2011,406:341-347.
20 Mo X,Huang H,Ma J,et al.Characterization of TrdL as a 10-hydroxy dehydrogenase and generation of new analogues from a tirandamycin biosynthetic pathway.Org Lett,2011,13:2212-2215.
21 Mo X,Ma J,Huang H,et al.△11,12-double bond formation in tirandamycin biosynthesis is atypically catalyzed by TrdE,a glycoside hydrolase family enzyme.J Am Chem Soc,2012,134:2844-2847.
