CAVEOLIN-1对血管吻合后TNF-α、IL-6、IL-10表达的影响
2013-09-12戴先鹏毕国善邓礼明熊国祚南华大学附属第二医院血管外科湖南衡阳421001
戴先鹏 毕国善 邓礼明 申 昕 熊国祚 (南华大学附属第二医院血管外科,湖南 衡阳 421001)
血管吻合口狭窄是导致血管手术后远期通畅率难以提高的重要原因,其主要病理基础是血管平滑肌的增殖和迁移,且发生的过程与创伤修复过程类似。血管损伤后的狭窄过程实际上是血管对损伤作出炎症反应并积极参与修复的过程〔1〕,在血管损伤后的炎症反应过程中,肿瘤坏死因子(TNF-)α和白介素(IL)-6充当重要的促炎因子,可刺激血管平滑肌细胞的增殖与迁移,也可促进成纤维细胞的增生,从而引起血管内膜的增生。小凹蛋白-1(Caveolin-1)是细胞膜上小凹的结构蛋白,能通过“脚手架”区域的共有序列与多种信号分子相互作用,对多种信号分子和血管活性因子起着重要调节作用。Caveolin-1能调节炎症细胞和内皮细胞中信号传导通路,影响炎症细胞对炎症反应的应答,进而影响炎症反应过程。Caveolin-1在血管平滑肌细胞上有着丰富的表达〔2〕。多种血管活性因子促进血管平滑肌增殖时,Caveolin-1表达下降;相反,Caveolin-1表达上调可抑制血管平滑肌细胞的增殖〔3〕。本研究探讨Caveolin-1对血管吻合后狭窄的作用以及与炎症因子的关系。
1 材料和方法
1.1 材料与试剂 健康成年家兔40只,雄性,体重1.5~2.0 kg,由南华大学动物实验部提供。LipofectamineTM2000购于Invitrogen 公司,兔抗 IL-6(bs-6312R)、兔抗 TNF-α(bs-2150R)、兔抗IL-10(bs-0698R)购于北京博奥森生物科技有限公司,链霉亲合素-生物复合物(SABC)试剂盒购于北京中杉金桥公司,鼠抗β-actin(CW0096)购于北京康为世纪公司,鼠抗Caveolin-1(#610058)购于美国BD公司。
1.2 方法
1.2.1 实验分组 40只家兔根据随机化原则分为四组。正常组(假手术组)家兔不作任何处理,手术组家兔分离剪断右侧颈总动脉后,用6-0 Prolene线间断外翻缝合;空转染组在血管吻合剩最后1针时注入空质粒和脂质体混合液后缝合,局部孵育30 min;转染组在血管吻合剩最后一针时注入配好的含pCDNA3.1-Caveolin-1和脂质体的混合液,局部孵育30 min。于术后7、14 d将右侧颈总动脉分离,仔细检查血管吻合口情况,并观察血管通畅无血栓形成后取标本。其中术后7 d的标本放入液氮中用于实时荧光定量(Real time)PCR及Western印迹检测。术后14 d的标本置于10%中性甲醛溶液中固定,用于免疫组化和HE染色。
1.2.2 Caveolin-1质粒转染试剂的配制方法 用已提取好的质粒及LipofectamineTM2000分别稀释于无血清培养基中(两者的比例为1∶3),室温静置4 min再将两者混合室温放置20 min。
1.2.3 苏木精-伊红(HE)染色观察血管内膜变化 取待测吻合口血管组织,甲醛固定后常规石蜡包埋、切片、HE染色,树胶封片保存。光镜下观察血管吻合口形态。
1.2.4 Real time PCR检测吻合口血管组织中Caveolin-1 mRNA的表达 血管组织标本总RNA用Trizol Reagent常规提取,按试剂盒说明,MMLV逆转录系统逆转录成cDNA。采用β-actin为内参照。引物用PrimerPremier 5.0设计,由上海生工生物工程有限公司合成。Caveolin-1引物序列:上游5'-AGCATGTCTGGGGGCAAATA-3',下游 5'-TCACAGTGAAGGTGGTGAAG C-3',产物为 280 bp。PCR 总反应体系 20 μl,含 2 × SYBR Premix Ex TaqTM 10 μl,上、下游引物 10 μmol/L 各 0.4 μl,cDNA 模板 2 μl,ddH2O 7.2 μl。循环设置:95℃10 s,61℃ 20 s,72℃ 15 s循环38次;于95℃ 0 s,65℃ 15 s,95℃ 0 s得融解曲线。反应完成后,得到所有标本的所有记录点曲线。使用软件对数据进行自动分析,调整基线后,计算达到阈值的最低循环数(Ct值)。
1.2.5 Western印迹检测血管组织中Caveolin-1蛋白的表达取血管组织,提取蛋白,二喹啉甲酸(BCA)法进行蛋白定量,取40 μg蛋白加入2×十二烷基硫酸钠(SDS)凝胶加样缓冲液中,100℃加热10 min使蛋白质变性。用10%SDS-聚丙烯酰胺凝胶进行电泳分离,并转移至聚偏二氟乙烯(PDVF)膜。在5%脱脂牛奶中4℃封闭1 h。按1∶500加入一抗,于4℃孵育过夜。Tris盐酸缓冲液(TBST)洗3次,5 min/次,加入辣根过氧化物酶标记的山羊抗兔和山羊抗鼠(按照1∶5 000比例稀释)37℃恒温箱中孵育45 min,TBST洗4次×15 min,用二氨基联苯胺(DAB)染色试剂盒显色并摄像分析。
1.2.6 检测血管组织中TNF-α、IL-6、IL-10蛋白的表达 采用SABC法,操作按试剂盒说明书进行。用磷酸盐缓冲液(PBS)代替一抗做阴性对照。
1.3 统计学方法 应用SPSS10.0统计软件进行分析,实验所得的数据都用±s表示,组间比较采用t检验。
2 结果
2.1 各组家兔血管组织病理变化 HE染色可见,正常组血管内膜光滑,管壁无增厚,内弹力板完整;手术组和空转染组血管组织内膜、中膜增厚明显,可见血管管腔狭窄,内膜下平滑肌细胞明显增生并排列不规则,内皮及内皮下层变性水肿,弹力纤维层显示不清;转染组血管内膜、中膜亦可见不同程度的增厚,管腔有所狭窄,可见中膜层平滑肌细胞有较多增生,但增生程度及狭窄程度均较手术组明显减轻。见图1。
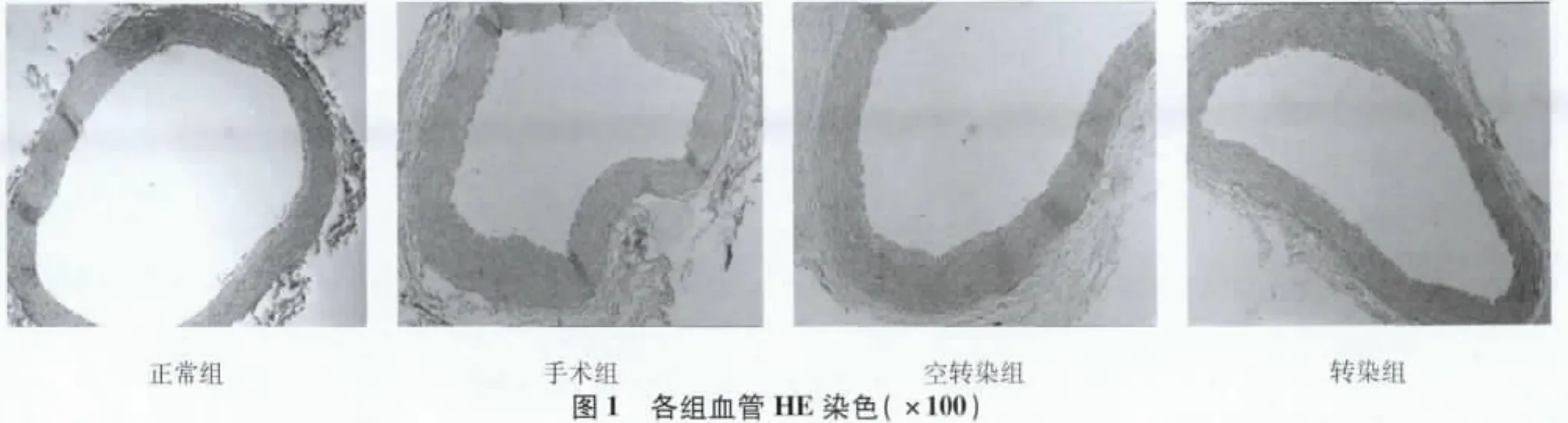
与转染组(0.143±0.008)和正常组(0.078±0.014)比较,手术组(0.365±0.058)和空转染组(0.421±0.052)的内膜中膜面积均显著增高(P<0.01);转染组虽高于对照组,但差异无统计学意义(P>0.05)。
2.2 家兔血管组织中Caveolin-1 mRNA表达 与正常组(0.825±0.042)比较,手术组(0.107±0.019)和空转染组(0.122±0.025)的Caveolin-1 mRNA表达降低(P<0.05),与手术组比较,转染组(0.735±0.046)Caveolin-1 mRNA明显升高(P <0.05)。
2.3 家兔血管组织中Caveolin-1蛋白表达 Caveolin-1在各组均有表达,与正常组(0.798±0.012)比较,手术组(0.397±0.038)和空转染组(0.345±0.027)中Caveolin-1蛋白表达明显降低(P<0.05),而转染组(0.547±0.017)Caveolin-1蛋白表达明显高于手术组(P<0.05)。见图2。
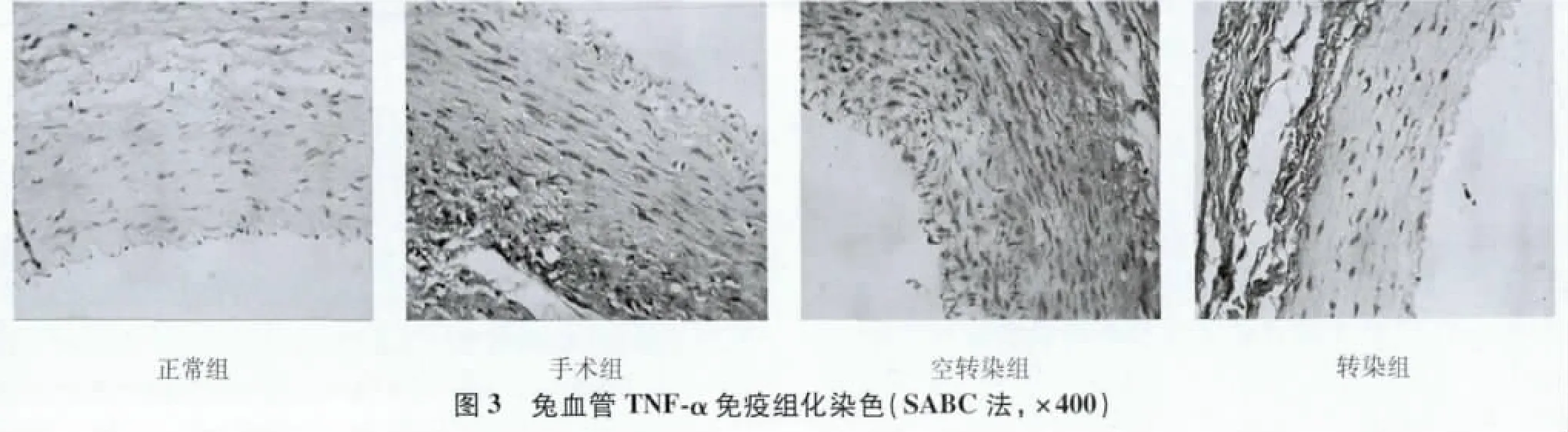
2.4 免疫组织化学检测血管中TNF-α、IL-6和IL-10的表达TNF-α在内皮和平滑肌中均有表达,手术组及空转组表达高于正常组;而与手术组比较,转染组表达下降。与正常组比较,手术组和空转染组IL-6、IL-10表达明显增高;而与手术组比较,转染组IL-6表达明显降低,IL-10表达升高。见图3~图5。
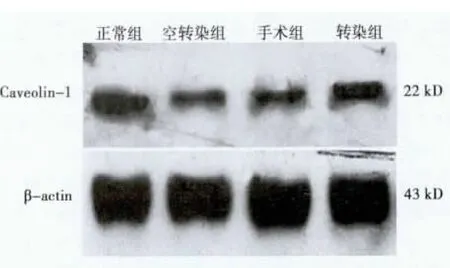
图2 各组家兔血管组织中Caveolin-1蛋白表达情况


3 讨论
Caveolin-1是修饰于Caveolae内表面的标志性结构蛋白,该基因定位于人染色体7q31.1,包含有3个外显子,在不同种属间的结构和序列都保持着高度的相似性〔4〕,在多种细胞中都有表达,主要表达于脂肪细胞、平滑肌细胞、内皮细胞、上皮细胞和成纤维细胞等终末分化细胞〔5〕。Caveolin-1可以参与细胞内的多种生命活动,如胆固醇的转运、细胞转化和信号转导、细胞膜的组装、血管生成和肿瘤形成等。近来的研究证实Caveolin-1在能表达于中性粒细胞、巨噬细胞、淋巴细胞和树突细胞中,表明其在炎症细胞的生理学效应中发挥重要作用,参与调节白细胞表面信号转导及其在细胞内的交通〔6〕。近年来Caveolin-1在血管平滑肌增殖和迁移的作用,越来越引起人们的关注。Caveolin-1在血管内皮细胞和平滑肌细胞上有着丰富的表达,并与多种生长因子相互作用,调节血管平滑肌增殖和迁移。内皮素-1通过ETAR促进血管平滑肌增殖的过程中,可以降低Caveolin-1的表达〔7〕;Caveolin-1还可通过调节炎症细胞、内皮细胞中信号传导通路的活性,影响炎症细胞对炎症反应的应答,进而影响炎症反应过程。TNF-α作为调节Caveolin-1表达的主要介质,通过其受体(TNFR-1)影响Caveolin-1的表达及生物学功能,并进一步调节多条信号通路的活性。有文献报道,在肺泡巨噬细胞中,TNF-α可使Caveolin-1表达下调,使多条炎症反应信号通路激活,引起肺组织损伤。有研究表明,多种血管活性因子促进血管平滑肌增殖时,Caveolin-1表达下降,相反当Caveolin-1表达上调可抑制血管平滑肌细胞的增殖〔3〕。Caveolin-1基因敲除的小鼠的血管平滑肌细胞增殖明显增强〔8〕。因此可以看出Caveolin-1在血管平滑肌增生和迁移起着重要作用。目前Caveolin-1对血管平滑肌增殖的研究主要其中在细胞水平,而在血管吻合口上还少有研究。
本实验结果说明Caveolin-1能明显抑制吻合口组织中TNF-α、IL-6的表达,并上调吻合口组织中 IL-10的表达,减少吻合口血管平滑肌细胞的增殖。但目前Caveolin-1对TNF-α、IL-6的具体作用机制还不清楚。
尽管IL-10作为炎症抑制因子在血管损伤后升高,以抑制炎症的进一步发展来对血管损伤后的血管内膜增生起保护作用,但并不足以完全阻止狭窄的发生及发展,主要起到延缓效应〔9〕。随着分子生物学及基因转染技术的不断发展,血管局部基因转染已成为治疗再狭窄的重要方向,其具有相对简单、特异性强,在局部发挥作用而全身反应小的优势,目前已广泛用于多种实验研究中〔10〕。
综上所述,Caveolin-1在抗狭窄作用中除了能直接抑制血管平滑肌细胞的增殖与迁移外,还有其抗炎和调节促炎和抗炎因子平衡的作用参与其中。但是本研究并未说明Caveolin-1调节炎症相关因子的途径,对此还有待进一步研究。
1 Wu ZH,Zhao SP,Chu LX,et al.Pioglitazone reduces tumor necrosis factor-alpha serum concentration and mRNA expression of adipose tissue in hypercholesterolemic rabbits〔J〕.Int J Cardiol,2010;13(2):151-8.
2 Wood WG,Igbavboa U,Muller WE,et al.Cholesterol asymmetry in synaptic plasma membranes〔J〕.J Neurochem,2011;116(5):684-9.
3 Hassan GS,Williams TM,Frank PG,et al.Caveolin-1-deficient aortic smooth muscle cells show cell autonomous abnormalities in proliferation,migration,and endothelin-based signal transduction〔J〕.Am J PhysiolHeart Circ Physiol,2006;290(6):H2393-401.
4 Glenney JR Jr,Soppet D.Sequence and expression of caveolin,a protein component of caveolae plasma membrane domains phosphorylated on tyrosine in Rous sarcoma virus-transformed fibroblasts〔J〕.Proc Natl Acad Sci USA,1992;89(21):10517-21.
5 Rothberg KG,Heuser JE,Donzell WC,et al.Caveolin ,a protein component of caveolae membrane coats〔J〕.Cell,1992;68(4):673-82.
6 Hu G,Ye RD,Dinauer MC,et al.Neutrophil caveolin-1 expression contributes to mechanism of lung inflammation and injury〔J〕.Am J Physiol Lung Cell Mol Physiol,2008;294(2):L178-86.
7 Luo DX,Cheng J,Xiong Y,et al.Static pressure drives proliferation of vascular smooth muscle cells via caveolin-1 ERK1/2 pathway〔J〕.Biochem Biophys Res Commun,2010;391(4):1693-7.
8 Yang H,He S,Quan Z,et al.Small interfering RNA-mediated caveolin-1 knockout on plasminogen activator inhibitor-1 expression in insulin-stimulated human vascular endothelial cells〔J〕.Acta Biochim Biophy,2007;39(3):224-33.
9 董少红,罗特丹,刘华东,等.颈动脉球囊损伤大鼠白细胞介素6、白细胞介素10及白细胞介素17A mRNA表达:罗格列酮干预的意义〔J〕.中国组织工程研究与临床康复,2009;13(48):9570-4.
10 胡 萍,盛 净,蔡文玮,等.内皮型一氧化氮合酶基因转染对血管损伤后新生内膜增生的影响〔J〕.中国组织工程研究与临床康复,2011;15(2):298-301.
