绿洲土 Cd、Pb、Zn、Ni复合污染下重金属的形态特征和生物有效性
2013-09-11武文飞南忠仁王胜利李程程
武文飞,南忠仁,王胜利,周 婷,廖 琴,李程程
(兰州大学资源环境学院,西部环境教育部重点实验室,兰州 730000)
重金属进入土壤后会对生物形成永久性的潜在危害,且重金属常常发生复合污染,其复合作用改变了金属的生物活性或毒性,使重金属复合污染的危害尤甚[1-4]。因此,众多的环境污染问题中,土壤重金属污染引起了国内外的极大关注[5-6]。近年来,我国学者对西北干旱区绿洲土壤重金属污染现状进行了相关调查研究工作,其结果表明 Cd、Pb、Zn、Ni土壤及蔬菜污染问题尤为突出[7-11]。
土壤中的重金属总量分析一直是国内外学者研究土壤污染问题的主要手段之一,但并不能表明该元素在土壤中的存在状态、迁移能力以及植物吸收的有效性,也不能作为评估它们对生物影响的充分标准[12]。这是因为重金属在土壤中以不同的形态存在,各形态共同决定了重金属的行为特征。相关研究表明,植物从土壤中吸收和富集重金属的多少与土壤中重金属总量并无线性关系,而与土壤中重金属的植物有效态直接相关[13],因此,不仅应对土壤重金属的总量进行分析,还应对土壤重金属的不同赋存形态进行分析。通过研究重金属不同形态对生物吸收的贡献程度,可以确定其生物有效性的大小,进而进行生物有效性评价[14-15]。
影响重金属化学行为和生物有效性的因素除重金属本身性质外,土壤性质和自然环境亦是关键因素[16]。我国西北地区干旱区绿洲有效降雨少、水分蒸发大、昼夜温差大[17],且该区域土壤一般呈现pH高、碳酸盐含量高、土壤有机质含量低等异于其他类型土壤的特点[7]。目前,有关我国西北地区干旱区绿洲土壤-作物体系中重金属迁移转化的研究相对较薄弱,重金属形态分析和生物有效性的研究还较为缺乏。因此,本文即通过盆栽试验,采用Tessier连续提取分级方法,较为系统地探讨干旱区绿洲土壤外源Cd、Pb、Zn、Ni复合污染对油菜生长的影响和重金属的形态特征及其与植物有效性的关系,以期为今后干旱区绿洲土壤重金属污染评价及寻求更确切地评价生物有效性指标的重金属形态提供科学依据。
1 材料与方法
1.1 供试材料
供试土壤为甘肃河西走廊城郊绿洲土,采样深度为0—20 cm。土壤采回后,铺在塑料薄膜上,于自然阴凉通风处风干,压碎,剔除根系及石块等异物,过2 mm尼龙筛备用。其基本理化性质为:pH=8.16,有机质含量1.54%,碳酸盐含量5.64%,阳离子交换量8.10 cmol/kg,供试土壤的 Cd、Pb、Zn、Ni的背景含量分别为0.55、15.92、62.97、53.86 mg/kg。
供试作物为油菜(Brassica campestris L.),品种为吉林大春科丰蔬菜研究所的四月蔓,种子购自张掖市种子公司。
1.2 实验设计
根据长期在研究区域对土壤重金属Cd、Pb、Zn、Ni的污染状况调查中已出现的最大浓度,并考虑到污染还有继续增加的可能,因此对重金属浓度的上限作出了适当的延伸,同时结合土壤环境的重金属二级标准进行梯度划分,确定为试验设计的8个污染水平(表1)。
每个花盆中加入3.0 kg供试土壤,加入不同水平的重金属(以硝酸盐水溶液形式),并加入5.00 g羊粪补充有机质和营养元素(羊粪中 Cd、Pb、Zn 的含量分别为 0.10、1.71、47.03 mg/kg,Ni未检出),制成各浓度污染土壤。各胁迫水平均设置3个平行,TS0为对照。加供试土壤区域地下水使土壤含水率为田间持水量的66%(水中Cd的含量为0.22μg/L,Pb、Zn、Ni均未检出),保持4 d后按农作制度播入油菜种子,蔬菜生长7 d后间苗,每盆留取4棵,生长66 d后收获,采集土壤和植物样品,植物样品分为茎叶和根系两部分,根系用自来水冲洗干净后再用去离子水反复冲洗。土壤样品自然风干后过100目尼龙筛待用。植物样品经105℃杀青2 h,75℃烘干至恒重,称量,粉碎,过60目尼龙筛待用。
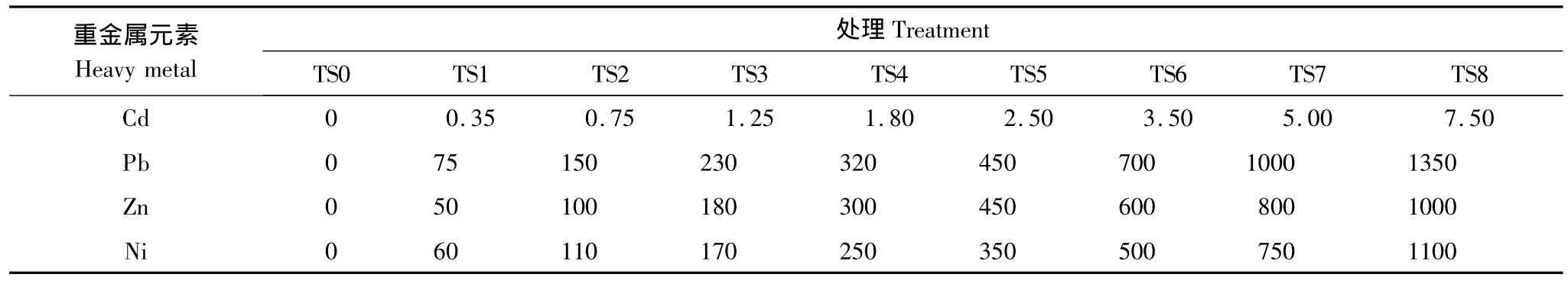
表1 盆栽试验中土壤重金属污染物添加浓度/(mg/kg)Table 1 The concentration of the heavy metals in test soil
1.3 分析测试
土壤理化指标的分析采用土壤农化常规分析法[18],pH测定为pH计法,有机质为重铬酸钾油浴法,碳酸盐为气量法,阳离子交换量为EDTA-铵盐快速测定法。土壤样品采用Tessier五步连续提取法浸提[19],即分别以 1.0 mol/L 的 MgCl2、1.0 mol/L 的 NaAC(用 1.0 mol/L 的 HAC 调节至 pH 值为 5.00)、0.04 mol/L NH2OH·HCl+25%HAC、0.02 mol/L HNO3+30%H2O2+0.8 mol/L HAC、HNO3-HF-HClO4提取可交换态(EXC)、碳酸盐结合态(CAB)、铁锰氧化态(FMO)、有机结合态(OM)和残渣态(RES)的重金属。植物样品采用GB/T 5009中规定的HNO3-HClO4混合酸法消解,消解完全后用1%的稀HNO3过滤定容待测。
Cd、Pb、Zn、Ni的含量用原子吸收光谱仪(Thermo Fishier,SOLAAR M6)测定,以标准溶液绘制的标准曲线确定其含量。
1.4 质量保证
实验中均采用20%平行样、GSS-1标准土样和GSB-6标准菠菜样品进行质量监控,误差控制在5%以内。供试试剂全部为优级纯,实验器皿在使用前均用10%硝酸浸泡24 h以上。
1.5 数据处理
数据采用Microsoft Excel 2003和SPSS 18.0进行统计分析、作图等。
2 结果与讨论
2.1 Cd-Pb-Zn-Ni复合胁迫对油菜生物量的影响
重金属胁迫对植物生长的影响直接反映在植物生物量的变化上。油菜各部位在不同Cd-Pb-Zn-Ni复合胁迫水平下的生物量见图1。由图1可知,在Cd-Pb-Zn-Ni复合胁迫下,油菜各部位的干重随着复合胁迫水平的增加均先增大后减小,与对照相较,根系干重均差异性显著(P<0.05),茎叶干重仅TS5水平差异性不显著(P<0.05)。该结果表明,Cd-Pb-Zn-Ni复合胁迫对油菜干重的影响较大,且毒害作用有一个临界浓度值,低于该临界浓度值时能促进其生长,高于该临界浓度则起到抑制作用。
为进一步了解重金属复合胁迫对干重的影响,引入抑制率(IR)的概念[20]。抑制率原定义是计算植物各部位长度受到外源重金属胁迫时采取的衡量概念,本文依照此概念延伸至干重,尝试用干重抑制率来表征Cd-Pb-Zn-Ni复合胁迫油菜各部位干重的影响程度。抑制率的计算公式为:
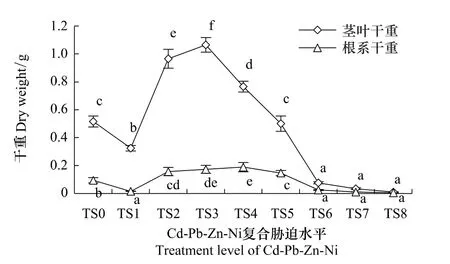
图1 油菜干重与处理水平的关系Fig.1 Influence of heavy metals on dry weight of rape
抑制率=(1-处理值/对照值)×100%
抑制率为负值表示有促进作用,正值表示有抑制作用,且绝对值越大表示促进或抑制作用越强。油菜在不同Cd-Pb-Zn-Ni复合胁迫水平下的茎叶干重抑制率(IRS)和根系干重抑制率(IRR)见表2。由表2可知,干重抑制率的变化幅度较大,说明重金属复合胁迫对干重的影响较大。TS2—TS4水平对茎叶干重有促进作用,TS2—TS5水平对根系干重有促进作用,且促进作用在各自的水平范围内均先增大后减小,对干重的影响表现为TS2—TS3、TS6—TS8水平促进/抑制作用茎叶干重>根系干重,其余水平反之。
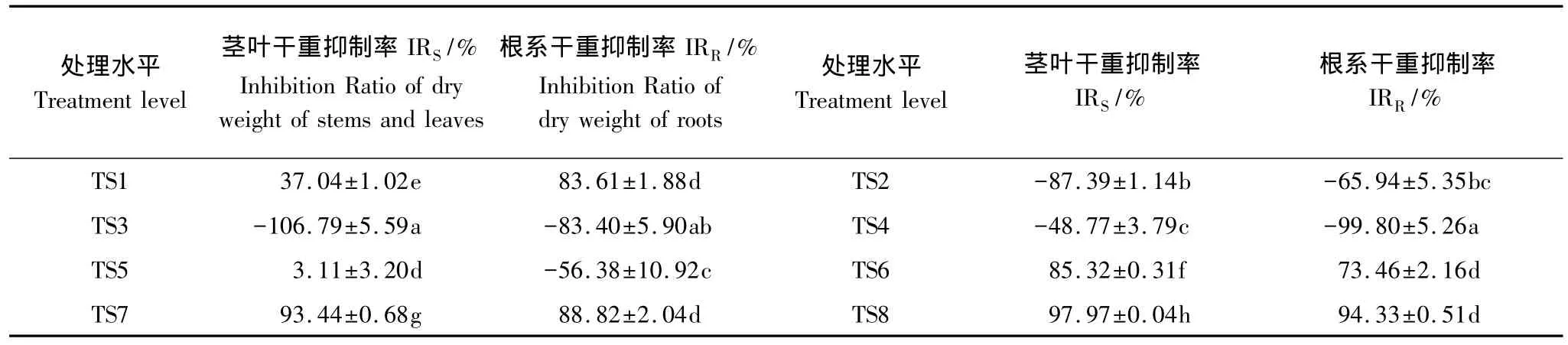
表2 不同水平Cd-Pb-Zn-Ni处理对油菜生长的影响Table 2 Effects of different levels of Cd-Pb-Zn-Ni on the growth of rape
由此可见,在本试验设计的重金属Cd-Pb-Zn-Ni复合胁迫水平的梯度下,低中水平对油菜各部位的生物量有不同程度的促进作用,而高水平则产生了明显的抑制作用。这可能是由于低中水平下重金属的加入促进了油菜对其他营养元素离子的吸收,使得在一定程度上刺激了根系的有丝分裂所致[21]。当土壤外源重金属的浓度超过植物的生长极限值时,植物的各种生理生化、生长环境和营养状况受到不同程度的伤害,其生长发育就开始受到不同程度的抑制[22]。因此,植物体内高浓度的重金属会严重抑制植物的生长发育和新陈代谢,从而使得生物量显著降低[23]。
2.2 Cd-Pb-Zn-Ni复合胁迫下油菜的耐性
土壤污染对植物发生作用时,植物最直接的受害部位是根系[24]。因此,当土壤受到重金属污染时,根系受重金属的影响相对最为严重[25]。重金属首先到达根系,根系对其发生响应,进行有选择的吸收或排斥。同时根系细胞壁中存在着大量交换位点,可将重金属离子交换吸收或固定,从而促进或阻止重金属离子进一步向地上部分运输[26]。因此根系耐性指数(RTI)是用来反映植物体对重金属耐性大小的一个非常重要的指标,可以很好地反映植物对重金属的耐性情况[27]。其计算公式为:RTI=L/L0,式中L0、L分别为对照处理和复合胁迫下蔬菜的根系长度(cm)。各胁迫水平下根系的耐性指数见图2。

图2 不同处理水平下油菜的根系耐性指数(RTI)Fig.2 The root tolerance index of rape under different treatment levels
从图2可以看出,在TS3—TS5水平,油菜的根系耐性指数均大于1.0,说明一定范围内的Cd-Pb-Zn-Ni复合胁迫对油菜根系的生长有促进作用。但超过该范围后,随着复合胁迫水平的提高,根系耐性指数逐渐降低,油菜表现出不适应症状,根系长度开始迅速小于对照,生长受阻。从植物生长状况看,TS6以上水平的重金属复合胁迫已抑制了植物体内正常生理生化活动,使油菜受到了严重伤害,干扰了正常生长,且复合胁迫水平越高,油菜对重金属的耐性能力越差。
2.3 油菜对4种重金属元素的吸收和分布
各胁迫水平下油菜各部位Cd、Pb、Zn、Ni含量的分布情况见图3。
同一植物对不同重金属元素的吸收和累积特性是不同的。由图3及差异性检验(P<0.05)可知,较之对照,各胁迫水平下4种重金属在油菜体内的含量均达显著性水平。Cd、Zn在茎叶中的含量大于根系,Pb、Ni反之,说明Cd、Zn容易通过根系-茎叶界面向上迁移,而Pb、Ni则更易滞留在根系中。随着复合胁迫水平的提高,油菜各部位不同重金属含量的变化趋势和幅度并不一致。其中,茎叶和根系中的Cd含量呈现出先升高后降低的变化趋势;根系中的Pb含量一直在升高,叶中的Pb含量则小幅波动;茎叶和根中的Zn含量在持续增加,但增加量较为接近,根系中Zn含量的增加幅度大于茎叶;茎叶和根中的Ni含量也在持续增加,TS1—TS3水平叶中的Ni含量增长幅度大于根,TS4及其以上水平反之。试验中Pb、Zn、Ni的浓度梯度相似,但油菜各部位对Zn的吸收明显高于Pb、Ni。根系中含量的大小为Zn>Pb>Ni,而茎叶中含量的大小为Zn>Ni>Pb,从侧面反映了Ni较之Pb更易向茎叶转移。
重金属的茎叶含量/根系含量(S/R)能反映出不同重金属在植物体内的运输和分配情况[28-29]。由图3可知,油菜对不同重金属的S/R值有着不同的变化特征和与对照相较的差异(P<0.05)。Cd的S/R值基本上均大于1.0,并在不断升高,TS7水平达到最大值3.24;Pb的S/R值均小于1.0,在TS1—TS5水平变化不大,之后开始骤降;Zn的S/R值先升高后降低,TS2水平达到最大值1.62,之后持续减小,但幅度逐渐减小并趋于稳定,均大于1.0;Ni的S/R值则以较小的幅度波动的减小,且均小于1.0。这说明油菜能将Cd、Zn较多的运输至茎叶,但运输能力在向着相反的方向发展,运输Cd的能力在增强,而运输Zn的能力则在减弱,这与前期油菜关于Cd、Zn复合胁迫下的盆栽实验试验一致[30]。Pb、Ni则更多的滞留在了根系中,不易向茎叶转移,且滞留能力在随着复合胁迫水平的升高而升高,Pb较之Ni被阻留的程度更大。
2.4 土壤中重金属形态的含量变化与分布特征
Tessier五步连续形态提取法将土壤中重金属的形态分为可交换态(EXC)、碳酸盐结合态(CAB)、铁锰氧化态(FMO)、有机结合态(OM)和残渣态(RES)[31]。不同的重金属的赋存形态由于其与土壤各物质的化学行为不同而各异[32]。重金属的形态分布特征常用形态分配系数来表征,即土壤中该重金属各形态占总量的比例。重金属各形态含量在总量中分配能消除土壤重金属各形态含量随重金属总量增加而增加的影响,可较好地表征各形态在重金属总量的相对含量大小,它能够比总量和各形态含量更清楚地指示环境污染对土壤的冲击[33]。
图4和图5分别给出了不同复合胁迫水平下油菜土壤中Cd、Pb、Zn、Ni各形态的含量和分布特征。可见,重金属各形态的含量均在增加。对照土壤中重金属的形态分布特征为,Cd:RES(39.29%)>CAB(31.57%)>FMO(22.27%)>OM(5.89%)>EXC(0.98%),Pb:RES(68.73%)>FMO(20.39%)>CAB(10.88%)>OM(0.00%)>EXC(0.00%),Zn:RES(78.68%)>FMO(15.38%)>OM(4.739%)>CAB(0.72%)>EXC(0.49%),Ni:RES(78.06%)>OM(12.18%)>FMO(8.29%)>CAB(1.47%)>EXC(0.00%),4 种重金属元素均以RES为主要赋存形态,EXC的含量均很小。复合胁迫下土壤中的重金属的各形态含量和形态分布较之对照土壤有了显著变化。
2.4.1 Cd、Pb、Zn、Ni的形态分布特征
重金属各形态EXC、CAB、FMO、OM、RES的变异系数(%):
Cd 分别为134.38、86.19、97.56、65.82、30.69,EXC 对外界胁迫响应强度最大,其次为 FMO 和 CAB,RES最小。其主要赋存形态迅速由RES转变为CAB和FMO,且CAB的分配系数较为稳定,均在31%以上,EXC的比例大大增加。
Pb 分别为 197.67、105.56、78.46、77.61、53.59,EXC 对外界胁迫响应强度最大,其次为 CAB 和 FMO,RES最小。EXC和CAB的分配系数持续增加,而FMO与RES的分配系数则持续下降。Pb在土壤中的主要赋存形态由RES转变为CAB和FMO。
Zn 分别为105.19、104.34、82.25、83.75、16.67,即 EXC 和 CAB 对外界胁迫响应强度最大,且响应能力接近,其次为FMO和OM,RES最小。EXC和CAB的分配系数持续增加,OM逐渐升至稳定水平,而RES则持续下降。Zn在土壤中的主要赋存形态由RES转变为FMO和CAB。
Ni分别为69.75、102.86、97.35、82.25、18.35,即 CAB 对外界胁迫响应强度最大,其次为 FMO 和 OM,RES最小。各形态分配系数的变化趋势和主要赋存形态与Pb类似。
可见,虽然4种重金属元素的形态特征变化程度不相一致,但均表现为EXC和CAB的响应较大,RES的响应较小,且赋存形态以CAB和FMO为主,异于对照土壤。
2.4.2 Cd、Pb、Zn、Ni的活性变化
重金属的各形态中,EXC的活性最大,对环境变化最敏感,易迁移转化,为植物所吸收[34]。CAB态在pH降低时易释放出来被生物利用[35]。FMO具较强的离子键而不易释放[35],OM则以有机质活性基团为配位体的结合或硫离子与重金属的沉淀而不易释放[36],但强氧化条件下这两种形态可能被分解释放,导致部分重金属溶出,引起生物毒性[37]。RES一般性质稳定,正常条件下不易释放,能长期稳定在土壤中,不易为植物吸收,只有通过化学反应转化成可溶态才能对生物产生影响[38]。因此,重金属的存在形态是研究植物有效性的基础。活性系数(MF)能够反映土壤中不同重金属被生物利用,进而对环境构成潜在危害的能力[39]。活性系数的计算公式为:
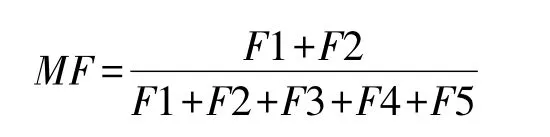

图4 土壤中重金属随着胁迫水平的形态含量变化Fig.4 Form content of four kinds of heavy metals under different treatment levels
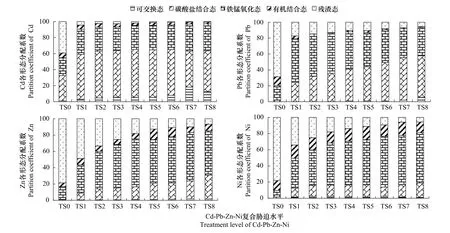
图5 土壤中重金属随着胁迫水平的形态变化特征Fig.5 Form distribution of four kinds of heavy metals under different treatment levels
式中,F1—F5分别表示重金属EXC、CAB、FMO、OM和RES的含量(mg/kg)。
各胁迫水平下个重金属元素Cd、Pb、Zn、Ni的活性系数变化见表3。可知,当胁迫水平较高时,Cd、Pb、Zn、Ni的活性系数均有了不同程度的增加,重金属的活性逐渐有了较大程度的增加,说明外源重金属添加量的增加有利于重金属活性的释放。Cd的活性系数最大,均在0.59以上,逐渐增至较为稳定的水平;Pb的活性系数在不断增大,最大为0.58左右;Zn的活性系数最大为0.30左右,增加程度不及Cd。Ni的活性系数持续增加,最大为0.19左右,不及Cd、Pb、Zn。可见,随着复合胁迫水平的升高及油菜的种植,4种元素的形态分布特征发生了较大的变化,生物有效性均有了不同程度的增加,仅从重金属的植物潜在可利用性来看活化的程度,重金属的活性大小为 Cd>Pb>Zn>Ni。

表3 Cd、Pb、Zn、Ni的活性系数随着复合胁迫水平的变化Table 3 The change of mobility factor Cd,Pb,Zn and Ni under different treatment levels
2.5 土壤中重金属形态的生物有效性
为进一步探索土壤-油菜系统中重金属的生物有效性,进行油菜各部位重金属含量与土壤中重金属各形态含量之间的相关分析和多元逐步回归,结果分别见表4和表5。
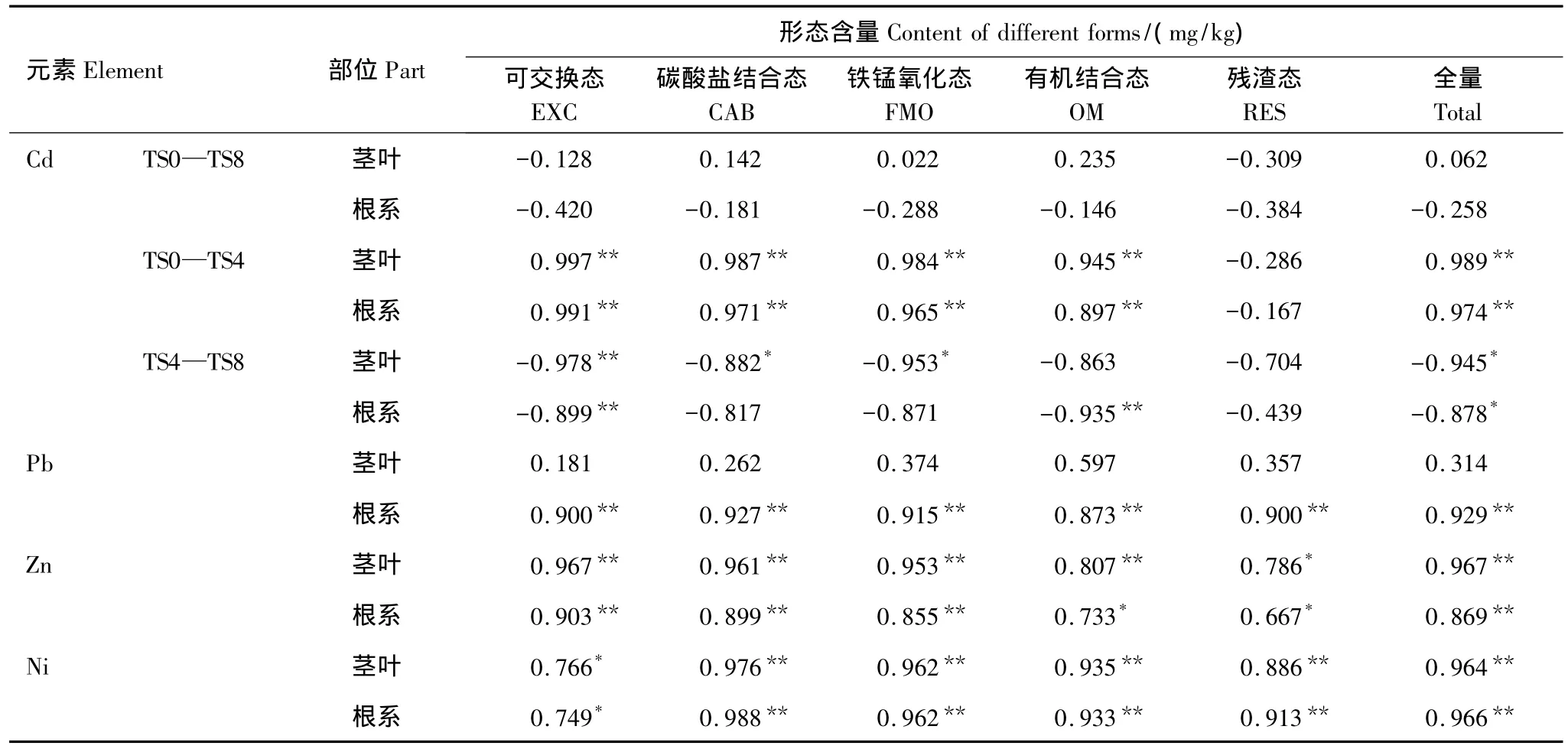
表4 油菜各部位重金属含量与土壤中重金属形态含量的相关性分析Table 4 The correlation between the content of heavy metals in the rape&their content of different forms in the soil
由表4可知,油菜根系和茎叶中的Cd含量以及茎叶中的Pb含量与土壤中相应元素的各形态含量均不显著,图3已表明,根系和茎叶中Cd含量随着复合胁迫水平的提高先升高后降低,而土壤中重金属各形态的含量则均在增加,其对重金属的吸收类型由于重金属复合胁迫对油菜的影响而发生了改变,相关关系由正相关转变为负相关,因而不是单一类型的线性关系,使得整个范围内各形态的含量与部位的含量相关性均不显著。根据图3显示的根系和茎叶中Cd含量的变化趋势,以TS4为分界点分别进行探讨,结果表明,根系和茎叶中Cd含量在TS0—TS4水平范围内与非残渣态和总量均呈极显著的正相关,TS4—TS8水平范围内则均与可交换态和总量呈极显著的负相关。茎叶中Pb含量随着复合胁迫水平的提高而逐渐趋于稳定,且变化较小,这可能与油菜限制重金属Pb离子通过跨膜运输向茎叶转移有关,是油菜自身的根系-茎叶界面对重金属的迁移异于土壤-根系界面对重金属吸收的特点以及在根系-茎叶界面重金属的交互作用所致,因此与土壤中的各形态含量均不显著。根系的Pb含量、根系和茎叶中Zn与Ni的含量与均土壤中相应元素的各形态均显著或极显著相关,但这并不表明各种形态的重金属(尤其是残渣态)对油菜的吸收均起到了重要作用。同时,油菜各部位重金属的含量均与添加量呈极显著正相关,说明外源重金属的添加量在一定程度上代表着土壤中重金属的有效量[40]。

表5 油菜各部位重金属含量与土壤重金属各形态含量的逐步回归方程分析结果Table 5 The results of multiple regression analysis between the concentrations of four kinds of heavy metals in different parts of rape and concentration of forms in soil
同时发现,油菜各部位的Pb、Zn、Ni(茎叶中Pb除外)均与生物有效性不高的RES高度相关。有人认为相关性仅仅是对两个变数之间对应关系的量度,并不能反映它们之间的内在联系[41]。因此,与植物体内重金属含量的Pearson系数显著的形态并不意味着就一定能为植物所吸收。为了筛选出对油菜各部位吸收贡献最大的重金属形态,作出了油菜各部位Cd、Pb、Zn、Ni含量与相应元素形态含量的逐步回归方程,结果见表5。
由回归方程得知,油菜茎叶吸收Cd的主要贡献形态为可交换态,而根系吸收Cd的主要贡献形态则由可交换态转变为有机结合态,根系吸收Pb和油菜各部位吸收Ni的主要贡献形态为碳酸盐结合态,油菜各部位吸收Zn的主要贡献形态亦为可交换态。土壤重金属全量与贡献形态间极显著地线性关系说明,总量是控制有效态含量的主要因素,污染越严重的土壤,其生物有效性就越高。但是全量与贡献形态较小的相关系数说明重金属的生物有效性还受到很多环境因素的影响,如土壤理化性质、母质、土地利用、无机和有机物质的络合作用、植物自身的特性等[42]。
油菜的种植造成了土壤pH的减小,导致CAB释放到土壤溶液中,而根际重金属的胁迫作用改变了根系有机酸等分泌物的构成与数量,导致根系土壤的pH、Eh、有机酸含量等的改变[43],因而也反过来调节重金属在油菜根系的化学过程以及在油菜体内的迁移。土壤中水溶性重金属与其他形态间处于动态平衡之中,水溶性的重金属一旦被油菜吸收而减少时,主要从粘粒和腐殖质所吸附的部分来补充[44]。OM、FMO转为油菜可吸收利用的CAB与EXC的库源,不同母质土壤的性质也影响了这些化学过程。另外,Mench等发现,燕麦根际分泌物可以溶解铁锰氧化物,从而增加Zn、Cd和Ni的植物有效性,但机理方面的研究尚处于探索阶段[45]。
3 结论
(1)Cd-Pb-Zn-Ni复合胁迫下,油菜的干重和根系耐性指数均随着复合胁迫水平的均先增大后减小,Cd-Pb-Zn-Ni复合胁迫对油菜的生长的作用由促进转变为抑制。
(2)对照土壤中Cd、Pb、Zn、Ni均以残渣态为主要赋存形态,随着外源重金属的添加,油菜种植土壤中Cd、Pb、Zn的可交换态和Ni的碳酸盐结合态对外界胁迫响应强度最大,且Cd、Pb的主要赋存形态迅速转变为碳酸盐结合态和铁锰氧化态,Zn的主要赋存形态由残渣态和碳酸盐结合态过渡到碳酸盐结合态和铁锰氧化态,Ni的主要赋存形态为碳酸盐结合态。
(3)Cd、Zn在茎叶中的含量大于根系,Pb、Ni反之。油菜能将Cd、Zn较多的运输至茎叶,且运输Cd的能力较Zn在增强;Pb、Ni则主要积累在根系,不易向茎叶转移,Pb较之Ni更多的被阻留在了土壤中。
(4)Cd、Pb、Zn、Ni各形态对油菜不同部位吸收重金属的主要贡献形态为,油菜茎叶吸收Cd和油菜各部位吸收Zn:可交换态,根系吸收Cd:由可交换态转变为有机结合态,根系吸收Pb和油菜各部位吸收Ni:碳酸盐结合态。
致谢:兰州大学资源环境学院周婷、廖琴同学在样品采集及实验分析中给予帮助;王胜利副教授帮助写作,特此致谢。
[1] Robinson B H,Leblanc M,Petit D,Brooks R R,Kirkman J H,Gregg P E H.The potential of thlaspi caerulescens for phytoremediation of contaminated soils.Plant and Soil,1998,203(1):47-56.
[2] Zhou Q X,Gao Z M.Compound contamination and secondary ecological effects of Cd and as in soil-alfalfa ecosystems.Journal of Environment Science,1994,6(3):330-361.
[3] Meng Z F,XUE C Z,Zhang Z J,Tang X B.Assessment of combined pollution of heavy metals in soils.Agro-Environmental Protection,1999,18(2):87-91.
[4] Zhou D M,Wang Y J,Cang L,Hao X Z,Chen H M.Advances in the research of combined pollution in soil and soil-plant systems.Techniques and Equipment for Environmental Pollution Control,2004,5(10):1-8.
[5] Nan Z R,Zhao C Y.Heavy metal concentrations in gray calcareous soils of baiyin region,Gansu Province,P.R.China.Water,Air,and Soil Pollution,2000,118(1/2):131-142.
[6] Wang S L,Nan Z R,Liu X W,Li Y,Song Q,Ding H X.Accumulation and bioavailability of copper and nickel in wheat plants grown in contaminated soils from the oasis,northwest China.Geoderma,2009,152(3/4):290-295.
[7] Zhao Z J,Nan Z R,Wang S L,Liu X W,Tao Y.Experiments on speciation and bioavailability of selected heavy metals in arid oasis soil,northwest of China.Advances in Earth Sciences,2008,23(11):1194-1200.
[8] Liao Q,Wang S L,Nan Z R,Wu W F,Zhou T,Jin W Q,Zhao C C,Liu J.Experiments on accumulation and chemical forms of Cd,Pb,Zn and Ni in arid oasis soils.Agricultural Research in the Arid Areas,2010,28(5):108-114.
[9] Yang Y M,Nan Z R,Zhao Z J,Wang Z W,Zhao C C,Jin W Q.Accumulation and migration of Cd and Zn in the celery planted in contaminated arid oasis soil,northwest of China.Journal of Shaanxi Normal University:Natural Science Edition,2010,38(2):89-94.
[10] Liu X W,Ding H X,Nan Z R,Zhao Z J,Li Y.Research on the bioavailability and spatial distribution of heavy metals in suburb cropland,Jinchang city,Gansu,China.Ecology and Environmental,2009,18(1):138-142.
[11] Wang Z W,Nan Z R,Zhao Z J,Yang Y M,Wang S L.Effects of Cadmium,Zinc and Nickel on celery growth and bioaccumulation of heavy metals in contaminated arid oasis soils.Journal of Arid Land Resources and Environment,2011,25(2):138-143.
[12] Liu Q,Wang Z J,Shang H X.Research progress in heavy metal speciation and toxicity and bioavailability of heavy metals.Chinese Journal of Environmental Science,1996,17(1):89-92.
[13] Ramos L,Hernández L M,González M J.Sequential fractionation of copper,lead,cadmium and zinc in soils from or near doñana National Park.Journal of Environmental Quality,1994,23(1):50-57.
[14] Huang P M,Adriano D C,Logan T J.Soil Chemistry and Ecosystem Health.Madison WI:Soil Science Society of America,SSSA Special Publication,1998.
[15] Shan X Q,Wang Z W.Speciation analysis and bioavailability.Chinese Journal of Analysis Laboratory,2001,20(6):103-108.
[16] Mclaughlin M J,Parker D R,Clarke J M.Metals and micronutrients-food safety issues.Field Crops Research,1999,60(1/2):143-163.
[17] Chang X X,Zhao W Z,Zhang Z H,Su Y Z.Sap flow and tree conductance of shelter-belt in arid region of China.Agricultural and Forest Meteorology,2006,138(1/4):132-141.
[18] Lu R K.Analytical Method of Soil Agricultural Chemistry.Beijing:Chinese Agriculture Science and Technology Press,1999:147-211.
[19] Tessier A,Campbell P G C,Bission M.Sequential extraction procedure for the speciation of particulate trace metals.Analytical Chemistry,1979,51(7):844-851.
[20] Duan M L,Fu D D,Wang S S,Liang D L,Xue R L,Wu X P.Effects of different selenite concentrations on plant growth,absorption and transportation of selenium in four different vegetables.Acta Scientiae Circumstantiae,2011,31(3):658-665.
[21] An Z Z,Wang X C,Shi W M,Yan W D,Cao Z H.Plant physiological responses to the interactions between heavy metal and nutrients.Soil and Environmental Sciences,2002,11(4):392-396.
[22] Huang K F.Effects of Cd And Pb Stress on the Growth of Zizania Latifolia[D].Yangzhou:Yangzhou University,2008.
[23] Xia H P,Shu W S.Resistance to and uptake of heavy metals by vetiveria zizanioides and paspalum notatum from lead/zinc mine tailings.Acta Ecologica Sinica,2001,21(7):1121-1129.
[24] Zhu Y J,Wang C Y,Ma Y X,Xia G J,Wang Y H.Effect of Arsenic stress on the growth and metabolism of the wheat root system.Acta Ecologica Sinica,2000,20(4):707-710.
[25] Li Y,Wang Y B.Research on Cu uptake and tolerance of four pteridophyta plants.Acta Prataculturae Sinica,2010,19(3):191-197.
[26] Monni S,Uhlig C,Hansene E,Magel E.Ecophysiological responses of empetrum nigrum to heavy metal pollution.Environmental Pollution,2001,112(2):121-129.
[27] Liu X M,Nie J H,Wang Q R.Research on lead uptake and tolerance in six plants.Acta Phytoecologica Sinica,2002,26(5):533-537.
[28] Monni S,Salemaa M,While C,Tuittila E,Huopalainen M.Copper resistance of calluna vulgaris originating from the pollution gradient of a Cu-Ni smelter,in Southwest Finland.Environmental Pollution,2000,109(2):211-219.
[29] Reeves R D.The hyperaccumulation of nickle by serpentine plants//Baker A J M,Proctor J,Reeves R D,eds.The Vegetation of Ultramafic(Serpentine)Soils,UK:Intercept Ltd,1992:253-277.
[30] Yang Y M,Nan Z R,Zhao Z J,Wang S L.Form distribution of Cd,Zn and bioavailability in arid contaminated oasis soil.Journal of Lanzhou University:Natural Sciences,2010,46(1):59-64.
[31] Wang X,Zhou Q X.Distribution of forms for cadmium,lead,copper and zinc in soil and its influences by modifier.Journal of Agro-Environmental Science,2003,22(5):541-545.
[32] Li Y Q,Chen L,Qiu Y L,Zhao J F,Li J Z.Speciation of heavy metals in soil from Shanghai chemical industry park.Ecology and Environment,2004,13(2):154-155.
[33] Sahquillo A,López-Sánchez J F,Rubil R,Rauret G,Thomas R P,Davidson C M,Ure A M.Use of a certified reference material for extractable trace metals to assess sources of uncertainty in the BCR three-stage sequential extraction procedure.Analytica Chimica Acta,1999,382(3):317-327.
[34] Singh A K,Hasnain S I,Banerjee D K.Grain size and geochemical partitioning of heavy metals in sediments of the damodar river-atributary of the lower ganga,India.Environmental Geology,1999,39(1):90-98.
[35] Yang H W,Wang M S,Xu A J,Zhuang X J,Ding L G,Guo B S.Study on the chemical speciation on manganese,cobalt and nickel in sediments from yellow river(Qingshuihe Section).Research of Environmental Sciences,2001,14(5):20-22.
[36] Cui Y,Ding Y S,Gong W M,Ding D W.Study on the correlation between the chemical forms of the heavy metals in soil and the metal uptake by plant.Journal of Dalian Maritime University,2005,31(2):59-63.
[37] Long Q,Zhang J.The method of heavy metals study in shelf sediments and its application.Transaction of Oceanology and Limnology,2002,(3):25-35.
[38] Presley B J,Trefry J H,Shokes R F.Heavy metal inputs to Mississippi Delta sediments,a historical view.Water Air Soil Pollution,1980,13(4):481-494.
[39] Kou S W,Wu J B,Xie S,Cai S Y,Yi R H.Absorption and accumulation of Pb and Cd in sweet potato and species distribution of Pb and Cd in rhizosphere soil.Journal of Agro-Environment Science,2011,30(4):677-683.
[40] Li B W,Xie J Z,Hao J M.Effects of complex contamination of Cadmium,Lead and Zinc on vegetables grown in meadow cinnamon soil.Journal of Agro-Environmental Science,2003,22(3):286-288.
[41] Liu X,Liu S Q,Tang Z H.The relationship between Cd and Pb forms and their availability to rape in major soils of Hebei Province.Acta Ecologica Sinica,2002,22(10):1688-1694.
[42] Zhong X L,Zhou S L,Li J T,Zhao Q G,Liao Q L.Bioavailability of soil heavy metals in the Yangtze River Delta-A case study of Kunshan City in Jiangsu Province.Acta Pedologica Sinica,2008,45(2):240-248.
[43] Chen Y J,Tao S,Deng B S,Zhang X Q,Huang Y.Effect of root system on metal fractionation in rhizosphere of contaminated soil.Acta Pedologica Sinica,2001,38(1):54-59.
[44] Saad A M H,Beltagy A I,Fahmy M A,Mahmoud W M.Lead speciation in the sediments of the heavy polluted western harbor of Alexandria.Water,Air,and Soil Pollution:Focus,2004,4(4/5):375-384.
[45] Mench M J,Fargues S.Metal uptake by iron-efficient and inefficient oats.Plant and Soil,1994,165(2):227-233.
参考文献:
[3] 孟昭福,薛澄泽,张增强,唐新保.土壤中重金属复合污染的表征.农业环境保护,1999,18(2):87-91.
[4] 周东美,王玉军,仓龙,郝秀珍,陈怀满.土壤及土壤-植物系统中复合污染的研究进展.环境污染治理技术与设备,2004,5(10):1-8.
[7] 赵转军,南忠仁,王胜利,刘晓文,陶燕.干旱区绿洲土壤共存重金属元素形态变化及生物有效性实验分析——以Cd、Zn、Ni元素为例.地球科学进展,2008,23(11):1194-1200.
[8] 廖琴,王胜利,南忠仁,武文飞,周婷,晋王强,赵翠翠,刘娇.干旱区绿洲土壤共存重金属Cd、Pb、Zn、Ni的吸收积累及形态分布实验研究.干旱地区农业研究,2010,28(5):108-114.
[9] 杨一鸣,南忠仁,赵转军,王兆炜,赵翠翠,晋王强.西北干旱区污染绿洲土壤中镉、锌在芹菜中的积累与迁移.陕西师范大学学报:自然科学版,2010,38(2):89-94.
[10] 刘晓文,丁海霞,南忠仁,赵转军,李媛.干旱区矿业城市郊区农田土壤重金属有态含量及空间分布特征——以“镍都”金昌市为例.生态环境学报,2009,18(1):138-142.
[11] 王兆炜,南忠仁,赵转军,杨一鸣,王胜利.干旱区绿洲土壤Cd、Zn、Ni复合污染对芹菜生长及重金属积累的影响.干旱区资源与环境,2011,25(2):138-143.
[12] 刘清,王子健,汤鸿霄.重金属形态与生物毒性及生物有效性关系的研究进展.环境科学,1996,17(1):89-92.
[15] 单孝全,王仲文.形态分析与生物可给性.分析试验室,2001,20(6):103-108.
[20] 段曼莉,付冬冬,王松山,梁东丽,薛瑞玲,吴雄平.亚硒酸盐对四种蔬菜生长、吸收及转运硒的影响.环境科学学报,2011,31(3):658-665.
[21] 安志装,王校常,施卫明,严蔚东,曹志洪.重金属与营养元素交互作用的植物生理效应.土壤与环境,2002,11(4):392-396.
[22] 黄凯丰.重金属镉、铅胁迫对茭白生长发育的影响[D].扬州:扬州大学,2008.
[23] 夏汉平,束文圣.香根草和百喜草对铅锌尾矿重金属的抗性与吸收差异研究.生态学报,2001,21(7):1121-1129.
[24] 朱云集,王晨阳,马元喜,夏国军,王永华.砷胁迫对小麦根系生长及活性氧代谢的影响.生态学报,2000,20(4):707-710.
[25] 李影,王友保.4种蕨类草本植物对Cu的吸收和耐性研究.草业学报,2010,19(3):191-197.
[27] 刘秀梅,聂俊华,王庆仁.6种植物对Pb的吸收与耐性研究.植物生态学报,2002,26(5):533-537.
[30] 杨一鸣,南忠仁,赵转军,王胜利.干旱区污染绿洲土壤中Cd和Zn形态分布与生物有效性.兰州大学学报:自然科学版,2010,46(1):59-64.
[31] 王新,周启星.外源镉铅铜锌在土壤中形态分布特性及改性剂的影响.农业环境科学学报,2003,22(5):541-545.
[32] 李宇庆,陈玲,仇雁翎,赵建夫,李金柱.上海化学工业区土壤重金属元素形态分析.生态环境,2004,13(2):154-155.
[35] 杨宏伟,王明仕,徐爱菊,庄晓娟,丁鲁刚,郭博书.黄河(清水河段)沉积物中锰、钴、镍的化学形态研究.环境科学研究,2001,14(5):20-22.
[36] 崔妍,丁永生,公维民,丁德文.土壤中重金属化学形态与植物吸收的关系.大连海事大学学报:自然科学版,2005,31(2):59-63.
[37] 隆茜,张经.陆架区沉积物中重金属研究的基本方法及其应用.海洋湖沼通报,2002,(3):25-35.
[39] 寇士伟,吴锦标,谢素,蔡素英,亦如瀚.红薯对Pb、Cd的吸收累积特征及根际土壤Pb、Cd形态分布研究.农业环境科学学报,2011,30(4):677-683.
[40] 李博文,谢建治,郝晋珉.不同蔬菜对潮褐土镉铅锌复合污染的吸收效应研究.农业环境科学学报,2003,22(3):286-288.
[41] 刘霞,刘树庆,唐兆宏.河北主要土壤中Cd、Pb形态与油菜有效性的关系.生态学报,2002,22(10):1688-1694.
[42] 钟晓兰,周生路,李江涛,赵其国,廖启林.长江三角洲地区土壤重金属生物有效性的研究——以江苏昆山市为例.土壤学报,2008,45(2):240-248.
[43] 陈有鑑,陶澍,邓宝山,张学青,黄艺.不同作物根际环境对土壤重金属形态的影响.土壤学报,2001,38(1):54-59.
