遮蔽行为对海刺猬摄食、生长和性腺性状的影响
2013-09-11罗世滨常亚青周海森
罗世滨,常亚青,赵 冲,周海森
(大连海洋大学农业部北方海水增养殖学重点实验室,大连 116023)
关于动物行为的研究始于20世纪60年代初,是生态学中新兴的前沿学科,它主要是以研究动物的行为功能、适合程度、存活价值以及进化过程为目的[1]。关于陆上动物行为学的研究起步较早,目前已经对很多物种的行为进行了较为全面的研究[2-4],而对于水生动物行为学的研究起步较晚,但随着研究手段的不断进步,特别是在鱼类当中,取得了极大的进展[5-6]。海胆是一种模式生物,近年来随着人们对海胆认知的不断深入,促进了人们对海胆生物学的研究[7-9]。海胆利用它们的管足或者棘将周围环境中的物体,如水草、珊瑚、贝壳等吸附到它们身体背面这种行为被认为是海胆的遮蔽行为。掩蔽行为通常是指海胆利用周围环境中的一些洞穴或者裂缝等场所躲藏自己的行为[10]。掩蔽行为通常认为与海胆躲避捕食者、水流、光照等不利因素有关[11-13]。关于海胆遮蔽行为的研究成为目前关于海胆行为学研究的重点和热点[14-17]。影响海胆遮蔽行为的因素很多,归纳起来可以分为自身因素和外界因素两大类。不同的海胆种类、海胆规格和生理状态都能影响海胆的遮蔽行为,而光照、水流、捕食者、温度、遮蔽物材质等被认为是影响海胆遮蔽行为主要外界环境因素[16,18-19]。遮蔽行为是海胆在长期进化过程中形成的,人们对于这一行为在海胆生活史中功能的研究目前还处于起步阶段。目前比较普遍的观点是海胆遮蔽行为的功能可能与躲避敌害、获取食物、避光、避悬浮颗粒等作用相关[14,20-22]。而关于这一行为形成的环境选择压力以及在海胆生物体内的形成机制目前还不清楚,这种遮蔽行为对海胆生长和发育的影响目前也未见报道。Richner等[17,23]认为海胆这这种遮蔽行为可能是以消耗一定的代谢能量为代价的,这种代价是否会对海胆自身的生长和发育造成影响目前还不得而知。因此,本研究通过实验室条件下,研究生活在不同遮蔽环境条件下海刺猬(G.crenularis)的生长以及身体各部分的发育情况来初步探讨海胆遮蔽行为对海胆生长发育的影响,并和掩蔽行为进行相应的比较,以此来进一步探讨海胆遮蔽行为的生态功能,深入了解海胆遮蔽行为对整个海胆生活史的影响以及海胆形成这种行为的内在因素和进化机制。
1 材料方法
1.1 实验海胆
实验海胆购自辽宁大连旅顺太平洋海珍品养殖公司。实验前,海刺猬暂养在实验室300 L的水槽中,投喂海带,每3 d换水1 次。实验开始时海胆的规格为:壳径(20.88±2.24)mm,壳高(10.39±1.29)mm,体重(3.50±1.05)g。
1.2 实验设计
实验分为两个对照组和一个处理组:空白组(没有砖块和贝壳)、掩蔽组(用空心砖块累起来制造的黑暗环境,海胆无需背遮蔽物就能获得遮蔽效果,正方形孔径边长为(38.30±3.34)mm,层高为(171.90±7.02)mm)和遮蔽组(在水槽中加入菲律宾蛤仔的贝壳,海胆需背贝壳获得遮蔽效果),每个组设4个重复,每个重复有20个海胆,各组海胆初始规格无显著差异。每个重复分别于300 L的水槽中饲养,水槽的槽壁不透光,槽内海水用气泵通气,且每3d换水1次,各水槽的位置随机分配。实验过程中用海带投喂海胆,投喂过程中,掩蔽组则在砖块内外都放置海带,以保证海胆不因摄食而被迫离开自身的偏好环境。实验从2011年3月2日开始到2011年11月2日结束,共8个月。整个实验过程中分别在3月份、4月份、5月份、8月份、10月份测量了其中12个周的各组海胆的周摄食量,且每2个月测量一次海胆的壳径、壳高和体重。在实验结束时各组随机抽取30个海胆,测量其壳径、壳高和体重,之后解剖,测量其性腺湿重、壳湿重、提灯湿重,以此来计算其性腺指数、壳指数和提灯指数。解剖后各部分在65℃条件下烘72 h,测量性腺、壳、提灯的干重,以此来计算各部分的含水量。各指标计算方法:

1.3 统计方法
利用Excel和SPSS统计分析软件对数据进行整理和分析,各组数据均符合正态性分布。利用重复度量分析比较了各组海胆实验期间壳径、壳高和体重的增长情况。各组海胆的周摄食量、存活率、性腺湿重、性腺指数、性腺水分、壳指数、壳干重、壳水分、提灯湿重、提灯干重符合方差齐性,因此利用单因素方差分析统计并比较了各组海胆之间的差异性。而海胆的性腺干重、壳湿重、提灯指数、提灯水分不符合方差齐性,因此利用非参数检验来比较各组海胆之间的差异。各分析的显著水平均设置为P<0.05。
2 结果
实验期间,生活在以菲律宾蛤仔贝壳作为遮蔽环境下的海刺猬,几乎都以贝壳较为完整的遮蔽自己,生活在以砖块作为掩蔽环境下的海刺猬,多生活在砖块的孔洞当中(图2)。
2.1 摄食量和存活率
各组海胆的周摄食量及死亡率列于表1。结果显示,遮蔽组的周摄食量要显著大于掩蔽组(P<0.05),空白组的摄食量小于遮蔽组而大于掩蔽组,但是他们之间的差异不显著(P>0.05)。各组海胆的存活率,掩蔽组要大于遮蔽组,空白组最小,但是他们之间的差异不显著(P>0.05)。
2.2 生长和身体各部分发育
各组海胆实验期间的生长情况见图1。各组海胆的壳径、壳高、体重在实验开始时均没有显著性的差异,实验过程中各组海胆的壳径、壳高、体重都增长明显。整个实验过程中,空白组和遮蔽组海胆的壳径、壳高、体重要显著大于掩蔽组(P<0.05),而空白组和遮蔽组之间没有显著性的差异(P>0.05)。
各组海胆的性腺湿重、性腺指数、性腺水分、壳指数、壳干重、壳水分、提灯湿重、提灯干重、性腺干重、壳湿重、提灯指数、提灯水分的均值、标准差及方差比较的结果列于表2和表3。空白组和遮蔽组的性腺湿重、性腺干重、性腺指数、壳湿重、壳干重、提灯湿重、提灯干重要显著大于掩蔽组(P<0.05),而空白组和遮蔽组之间没有显著性的差异(P>0.05)。空白组、遮蔽组和掩蔽组之间的壳指数、壳水分、提灯水分没有显著性的差异(P>0.05)。掩蔽组的性腺含水量要显著大于遮蔽组和空白组(P<0.05),而空白组和遮蔽组之间没有显著性的差异(P>0.05)。空白组的提灯指数要显著小于遮蔽组和掩蔽组(P<0.05),而遮蔽组和掩蔽组之间没有显著的差异(P>0.05)。
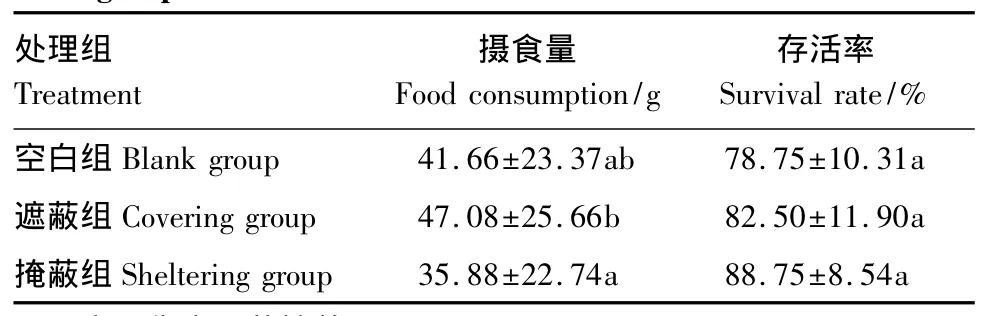
表1 各组海胆的摄食量及存活率Table 1 Food consumption and survival rate of sea urchins among three groups
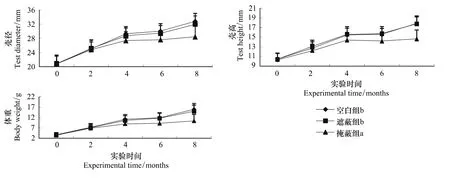
图1 3组海胆实验期间壳径、壳高、体重的增长情况Fig.1 Test diameter,test height and body weight of the three groups during the experiment不同字母代表显著性差异(P<0.05)

表2 各解剖性状的平均数±标准差及方差分析结果Table 2 The Mean±standard deviation(SD)and significant differences of anatomic traits according to One-way ANOVA

表3 各解剖性状的平均数±标准差及非参数检验结果Table 3 The Mean±SD and significant differences of anatomic traits according to the Nonparametric tests
3 讨论
本次研究所取的海胆种类为海刺猬(G.crenularis),是因为在研究过程中我们发现,和其它种类的海胆相比,海刺猬具有非常明显的遮蔽行为(图2)。所选海胆均为2010年5月份于辽宁大连旅顺太平洋海珍品养殖公司育成,到实验开始时为10月龄的未性成熟幼胆,相对于已经性成熟的海胆,以幼胆为材料可以获取到更多关于生长及发育的信息,这样可以更好的观察不同遮蔽环境对海刺猬生长发育的影响。
关于其它种类海胆的遮蔽行为目前已经有了一定程度的认识[16,19,24],各种海胆都有被观察到不同程度的遮蔽行为,在本次实验中也观察到海刺猬也具有比较明显的遮蔽行为。Agatsuma等[16,21,25-26]认为,海胆的遮蔽行为可以让他们在一定程度上避免捕食者的捕食和光给它们带来的伤害,增加自身存活的概率。实验中我们发现,掩蔽组海胆的存活率略高于遮蔽组,而遮蔽组海胆的存活率要略高于空白组,但是它们之间的差异不显著,遮蔽行为并没有提高海刺猬的存活率。这可能是由于在本次实验中,没有引入捕食者,而且实验是在室内进行,光照较弱,因此相对于自然环境,本次实验环境下3组海胆的不利生存因素较少,不会照成死亡率上的显著差异。因此,海刺猬的这种遮蔽行为不是那种用进废退的后天性行为,而是一种比较稳定的先天性行为,即使在有利的环境条件下,这种行为仍然得以保持(图2)。

图2 实验中所观察的海刺猬的遮蔽行为Fig.2 Observation of the covering and sheltering behavior of Glyptocidaris crenularis in the laboratory
在生物漫长的进化过程中,任何行为的形成都是经过长期选择与适应的结果,都会对生物本身的生活史产生影响。生物形成的这些行为特性,有些是有利于自身生长、发育和繁殖的积极的适应策略,而有些则是为了避免环境中的某些不利因子的消极的适应策略,主要目的是为了保持存活及种的延续,而对于其生长发育的影响不大,甚至产生消极的影响[27]。有研究表明海胆的遮蔽行为需要海胆消耗一定量的代谢能量为代价[23],这种消耗似乎会对海胆的生长造成负面影响。以贝壳作为遮蔽物的海胆的生长速度以及身体各部分(壳、亚氏提灯、性腺)的发育与空白组没有显著的差异,且要显著大于掩蔽组。这说明海刺猬遮蔽行为的这种生理消耗并没有影响它的生长和发育,相反,相对于无需背遮蔽物就能获得遮蔽条件的掩蔽组,遮蔽组的生长及发育都要更快。造成这种现象可能有3个原因:第一是海刺猬通过增加摄食来补充遮蔽行为的能量消耗,遮蔽组海胆的摄食量要显著大于掩蔽组而略大于空白组。第二是有研究表明动植物在一定的环境压力条件下,生长、发育及繁殖速度能都加快[28-29],实验中空白组和遮蔽组之间的生长和身体各部分(壳、亚氏提灯、性腺)的发育都没有显著的差异,同时它们都显著大于掩蔽组,造成这种现象的原因很可能就是空白组和遮蔽组的海胆都会被动的收到一定强度的光照胁迫,而掩蔽组海胆在整个实验过程中则不会有这种胁迫,这种胁迫促进了海刺猬的生长和发育。第三,海刺猬在长期的进化过程中形成遮蔽行为很可能并不是为给生长和发育带来优势,而只是为了躲避自然界的一些不利因子,使种得以保存和延续。这一点已经在轮虫(Brachionus calyciflorus)性别的形成中得到了印证,Becks和Agrawal[30-31]通过在实验室条件下观察轮虫在不同选择压下的性别进化过程发现,有性生殖对于轮虫的生活没有长期的利益,有性生殖的出现只是为了适应短期内环境的变化,而一旦轮虫适应了这个变化的环境,有性生殖就会逐渐减弱,无性生殖逐渐增强。而Verling[16,21,26]等人目前的研究也表明海胆的这种遮蔽行为是为了躲避敌害以及光照、水流等外界因素给自身带来的伤害,增加存活的概率。接下来有必要进一步研究该行为对海刺猬繁殖乃至后代生长发育的影响,以此来进一步了解该行为的进化机制及对海刺猬生活史的影响。遮蔽组的海刺猬其生长和发育要显著优于掩蔽组,这可能是由于遮蔽组海刺猬的摄食量显著大于掩蔽组造成的。掩蔽行为和遮蔽行为都是海胆为躲避外界不利条件而形成的一种行为。而海刺猬始终保持耗能的遮蔽行为,原因之一就是两种行为对于食物获得的难易。相对于掩蔽行为,遮蔽行为更容易使海刺猬获得食物,这一点在实验中也得到了证实,实验中遮蔽组的摄食量要显著大于掩蔽组。
不同规格的海胆及在不同的发育阶段,身体各部分发育的重点有所不同,身体各部分之间的能量分配也是有所差异的,前期小规格海胆主要是侧重壳和口器的生长,而大规格到达性成熟以后则侧重生殖腺的生长,相互之间存在补偿效应[32-33]。掩蔽组海胆的提灯指数要显著大于遮蔽组和空白组海胆,而空白组和遮蔽组的性腺指数则要显著大于掩蔽组,这可能就是由于前者和后两者的海刺猬的规格及所处的发育程度的差异所致。
以上研究表明:海刺猬(G.crenularis)的遮蔽行为是其自身长期形成的一种固有行为,反映了它们对外界不利环境条件的一种适应性,有利于提高其适应能力和应对外界环境压力的能力,虽然需要以消耗能量等为代价,但这种行为对海刺猬自身生长和发育不造成影响。海刺猬遮蔽行为的进化选择压力,有待深入研究。
[1] Jiang Z G,Wang Z W.Origin,development and prospective in behavioral ecology.Journal of Nature,1997,19(1):43-46.
[2] Li F S,Ma J Z.Behavioral ecology of black-necked crane during winter at Caohai,Guizhou,China.Acta Ecologica Sinica,2000,20(2):293-298.
[3] Wang H S,Xu H F,Cui F,Xu Y Y,Zhou Z.Effects of temperature on mating behavior and fecundity of beet armyworm Spodoptera exigua(Hübner).Acta Ecologica Sinica,2004,24(1):162-166.
[4] Simmons P J,Young D.Nerve cells and animal behaviour.Yale Journal of Biology and Medicine,2011,84(3):329-329.
[5] Salvanes A G V,Moberg O,Braithwaite V A.Effects of early experience on group behaviour in fish.Animal Behaviour,2007,74(4):805-811.
[6] Brown C,Laland K,Krause J.Fish Cognition and Behaviour.Britain:Blackwell Publishing Ltd,2011.
[7] Lawrence J M,Chang Y Q,Cao X B,Lawrence A L,Watts S A.Potential for production of uni by Strongylocentrotus intermedius using dry formulated feeds.Journal of the World Aquaculture Society,2011,42(2):253-260.
[8] James P J,Heath P L.The effects of season,temperature and photoperiod on the gonad development of Evechinus chloroticus.Aquaculture,2008,285(1/4):67-77.
[9] Chang Y Q,Ding J,Song J,Yang W.Biology Research and Breeding of Sea Cucumber and Sea Urchin.Beijing:Ocean Press,2004:199-268.
[10] Jones G P,Andrew N L.Herbivory and patch dynamics on rocky reefs in temperate Australasia:The roles of fish and sea urchins.Australian Journal of Ecology,1990,15(4):505-520.
[11] Scheibling R E,Hamm J.Interactions between sea urchins(Strongylocentrotus droebachiensis)and their predators in field and laboratory experiments.Marine Biology,1991,110(1):105-116.
[12] Nishizaki M T,Ackerman J D.Juvenile-adult associations in sea urchins Strongylocentrotus franciscanus and S.droebachiensis:is nutrition involved?.Marine Ecology Progress Series,268:93-103.
[13] Nelson B V,Vance R R.Diel foraging patterns of the sea urchin Centrostephanus coronatus as a predator avoidance strategy.Marine Biology,1979,51(3):251-258.
[14] Adams N L.UV radiation evokes negative phototaxis and covering behavior in the sea urchin Strongylocentrotus droebachiensis.Marine Ecology Progress Series,2001,213:87-95.
[15] Amato K R,Emel S L,Lindgren C A,Sullan K M,Wright P R,Gilbert J J.Covering behavior of two co-occurring Jamaican Sea Urchins:differences in the amount of covering and selection of covering material.Bulletin of Marine Science,2008,82(2):255-261.
[16] Verling E,Crook A,Barnes D.Covering behaviour in Paracentrotus lividus:is light important?Marine Biology,2002,140(2):391-396.
[17] Richner H,Milinski M.On the functional significance of masking behaviour in sea urchins-an experiment with Paracentrotus lividus.Marine Ecology Progress Series,2000,205:307-308.
[18] Dumont C P,Drolet D,Deschênes I,Himmelman J H.Multiple factors explain the covering behaviour in the green sea urchin,Strongylocentrotus droebachiensis.Animal Behaviour,2007,73(6):979-986.
[19] Lees D C,Carter G A.The covering response to surge,sunlight,and ultraviolet light in Lytechinus anamesus(Echinoidea).Ecology,1972,53(6):1127-1133.
[20] Nichols K D.The Effects of Predators and Habitat on Sea Urchin Density and Behavior in Southern California Kelp Forests.San Diego:San Diego State University,2009.
[21] Agatsuma Y.Effect of the covering behavior of the juvenile sea urchin Strongylocentrotus intermedius on predation by the spider crab Pugettia quadridens.Fisheries Science,2001,67(6):1181-1183.
[22] Dix T G.Covering response of the echinoid Evechinus chloroticus(Val.).Pacific Science,1970,24(2):187-194.
[23] Kehas A J,Theoharides K A,Gilbert J J.Effect of sunlight intensity and albinism on the covering response of the Caribbean sea urchin Tripneustes ventricosus.Marine Biology,2005,146(6):1111-1117.
[24] James D W.Diet,movement,and covering behavior of the sea urchin Toxopneustes roseus in rhodolith beds in the Gulf of California,México.Marine Biology,2000,137(5/6):913-923.
[25] Verling E,Crook A C,Barnes D K A.The dynamics of covering behaviour in dominant echinoid populations from American and European west coasts.Marine Ecology,2004,25(3):191-206.
[26] Sigg J E,Lloyd-Knight K M,Boal J G.UV radiation influences covering behaviour in the urchin Lytechinus variegatus.Journal of the Marine Biological Association of the United Kingdom,2007,87(5):1257-1261.
[27] Pennisi E.Evolutionary time travel.Science,2011,334(6058):893-895.
[28] Fan J W,Zhong H P,Liang B,Du Z C.A study on competition among perennial ryegrass and six other species in different conditions of stress and disturbance.Acta Phytoecologica Sinica,2003,27(4):522-530.
[29] Liu X M.Environmental variation and fecundity response pattern reveal the inevitable extinction of large animals.Bulletin of Biology,2009,44(10):1-7.
[30] Becks L,Agrawal A F.Higher rates of sex evolve in spatially heterogeneous environments.Nature,2010,468(7320):89-92.
[31] Becks L,Agrawal A F.The effect of sex on the mean and variance of fitness in facultatively sexual rotifers.Journal of Evolutionary Biology,2011,24(3):656-664.
[32] Fernandez C,Boudouresque C F.Nutrition of the sea urchin Paracentrotus lividus(Echinodermata:Echinoidea)fed different artificial food.Marine Ecology Progress Series,2000,204:131-141.
[33] Lyons D A,Scheibling R E.Differences in somatic and gonadic growth of sea urchins(Stronglyocentrotus droebachiensis)fed kelp(Laminaria longicruris)or the invasive alga Codium fragile ssp.tomentosoides are related to energy acquisition.Marine Biology,2007,152(2):285-295.
参考文献:
[1] 蒋志刚,王祖望.行为生态学的起源、发展和前景.自然杂志,1997,19(1):43-46.
[2] 李凤山,马建章.越冬期黑颈鹤个体行为生态的研究.生态学报,2000,20(2):293-298.
[3] 王竑晟,徐洪富,崔峰,许永玉,周真.温度对甜菜夜蛾生殖行为及生殖力的影响.生态学报,2004,24(1):162-166.
[9] 常亚青,丁君,宋坚,杨威.海参、海胆生物学研究与养殖.北京:海洋出版社,2004:199-268.
[28] 樊江文,钟华平,梁飚,杜占池.在不同压力和干扰条件下黑麦草与其它6种植物的竞争研究.植物生态学报,2003,27(4):522-530.
[29] 刘小明.由环境变化和生殖力响应规律揭示大型动物灭绝的必然性.生物学通报,2009,44(10):1-7.
