质粒介导aac(6')-Ib基因检测与喹诺酮类耐药
2013-09-11汪雅萍应春妹张灏旻
赵 倩, 汪雅萍,应春妹, 郑 冰,张灏旻, 杨 俊
(上海交通大学医学院附属仁济医院检验科,上海 200127)
大肠埃希菌是我国泌尿生殖系感染最为常见的病原菌[1],临床治疗常选喹诺酮类抗菌药物[2],在抗菌药物选择压力下,大肠埃希菌对喹诺酮类抗菌药物耐药率逐年升高。喹诺酮类药物耐药机制复杂,主要由靶位改变和主动外排两个机制所致,这两者均由染色体突变引起[3-4]。21世纪初期质粒介导喹诺酮耐药(PMQR)机制被关注,其中喹诺酮类修饰酶基因aac(6')-Ib基因变异体(cr)可引起低水平的PMQR[5]。由于质粒具有接合、转移等多种特性,以此为载体可引起水平传播的耐药基因给人类带来很大危害,因此,研究价值重大。本实验了解上海交通大学医学院附属仁济医院大肠埃希菌对喹诺酮类抗菌药物耐药情况并分析质粒介导aac(6')-Ib基因存在与喹诺酮类药物耐药性的关系。
材料和方法
一、材料
1.菌株来源 收集上海仁济医院2010年3月至2011年3月临床中段尿分离大肠埃希菌121株,其中环丙沙星敏感株27株,耐药株94株;质控菌株为大肠埃希菌ATCC25922。
2.培养基 血平板为上海伊华生物科技有限公司产品。MH平板为法国生物梅里埃公司产品。
3.抗菌药物纸片 阿米卡星、庆大霉素、氨苄西林、氨苄西林-舒巴坦、哌拉西林、头孢唑啉、头孢克洛、头孢呋辛、头孢噻肟、头孢他啶、头孢吡肟、头孢美唑、哌拉西林-他唑巴坦、亚胺培南、美洛培南、厄他培南、萘啶酸、环丙沙星、诺氟沙星、左氧氟沙星、复方磺胺甲口恶唑为英国OXOID公司产品。
4.试剂及仪器 离心柱型-质粒小提试剂盒购于北京天根生化科技有限公司,聚合酶链反应(PCR)扩增及产物电泳相关试剂均购于大连宝生物工程有限公司。PCR引物购于上海英潍捷基贸易有限公司,aac(6')-Ib基因引物序列参照文献[5],见表1。Phoenix-100全自动微生物鉴定仪为美国BD公司产品,Tanon-2500凝胶成像系统为上海天能科技有限公司产品。

表1 aac(6')-Ib基因的PCR引物序列
二、方法
1.菌株鉴定及药敏试验 Phoenix-100全自动微生物鉴定/药敏系统:按仪器说明书操作。所有菌株均严格按2009年美国临床实验室标准化协会(CLSI)的纸片扩散法(K-B)对21种抗菌药物的耐药性检测并判读结果。
2.基因组DNA制备 离心柱型-质粒小提试剂盒(编号:DP103-02)按产品说明书操作。
3.PCR扩增 总反应体系为50 μL,其中10× PCR 缓冲液 (25mM)5 μL,dNTP(10mM)4 μL,上游引物(50pM)和下游引物(50pM)各2 μL,DNA 模板 4 μL,Taq DNA 聚合酶(5 U/μL)0.3 μL,Sterial dd H2O 32.7 μL。aac(6')-Ib 基因PCR反应扩增条件:94℃ 5 min预变性;循环变性94 ℃ 30 s,复性55℃ 30 s,延伸72℃ 30 s,共30个循环;最后72℃延伸5 min。
4.琼脂糖凝胶电泳 取10 μL PCR产物混合2 μL溴酚蓝,1.2%的琼脂糖凝胶(含溴乙锭)电泳,电压恒定为150V,30 min,在紫外灯下观察结果。如果出现明显的482bp亮带即为aac(6')-Ib基因阳性。
5.DNA测序并确定基因型 将所有 aac(6')-Ib基因阳性株的PCR扩增产物送北京六合华大基因科技股份有限公司进行测序。DNA序列利用 NCBI网站(www.ncbi.nlm.nih.gov/)的Blastn程序进行比对确定基因型。
三、统计学方法
采用WHONET5.4软件及 SPSS11.0软件进行统计分析。P<0.05表示差异有统计学意义。
结 果
一、121株大肠埃希菌耐药性检测结果
121株大肠埃希菌临床分离株对厄他培南、亚胺培南、美洛培南3种碳青霉烯类抗菌药物未产生耐药;对头孢美唑、哌拉西林-他唑巴坦、阿米卡星耐药率较低,分别为3.3%、14.0%和16.7%;对其他抗菌药物耐药率均高(>55%);对4种喹诺酮类抗菌药物耐药率均高于75.0%,特别是第一代药物萘啶酸耐药率为91.7%,且只要菌株对喹诺酮类抗菌药物耐药抑菌圈皆为6 mm。对左氧氟沙星敏感率为17.4%明显高于环丙沙星为9.9%,略高于诺氟沙星为14.9%,这可能与环丙沙星作为喹诺酮类代表性药物更常被临床应用以及左氧氟沙星具有优越的体外抗菌活性有关,与文献报道基本相符[6]。
二、大肠埃希菌aac(6')-Ib基因阳性与阴性菌株的耐药性比较结果
大肠埃希菌aac(6')-Ib阳性与阴性菌株的耐药性比较结果见表2。环丙沙星敏感株中未检测aac(6')-Ib基因。
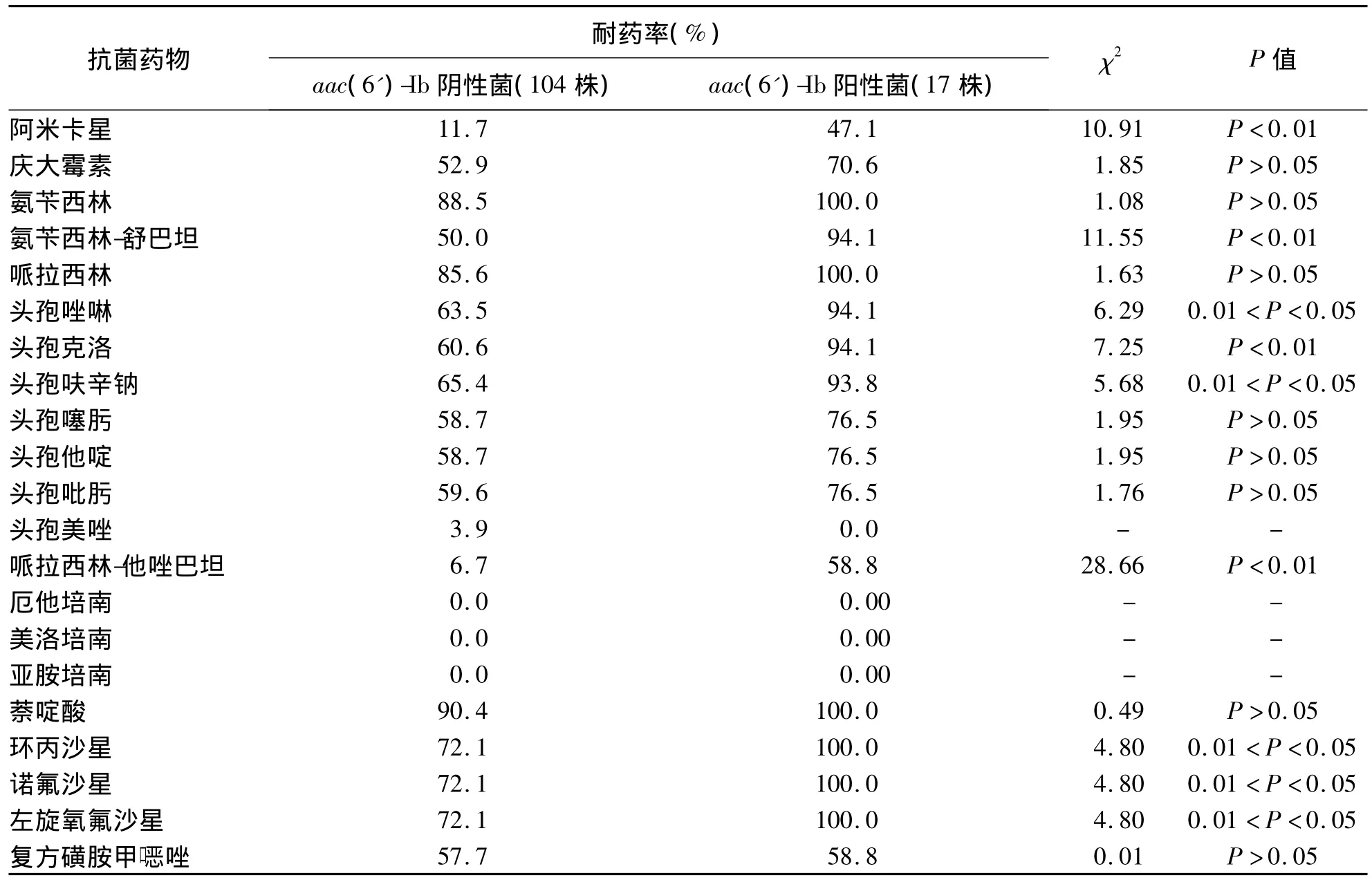
表2 大肠埃希菌aac(6')-Ib基因阳性与基因阴性菌株的耐药性比较 (%)
三、aac(6')-Ib基因PCR扩增及扩增产物测序结果
121株大肠埃希菌中17株扩增出482bp aac(6')-Ib片段,阳性率为14.0%(17/121)。部分菌株的扩增产物电泳条带见图1。琼脂糖凝胶电泳均呈单一条带,且与目的片段大小相符。对所有17株aac(6')-Ib阳性菌株扩增产物进行测序,结果14株在aac(6')-Ib的第223位均出现点突变T→A,即携带aac(6')-Ib-cr[Trp→Arg(色氨酸→精氨酸)],突变率为 82.4%(14/17),经与 NCBI Genebank中aac(6')-Ib-cr基因变异体(cr)比对吻合率为99%(注册号:FJ949571.1);3株菌未发生突变,DNA序列与Genbank中的aac(6')-Ib基因(注册号:HM569733.1)比对吻合率为99%。

图1 部分菌株aac(6')-Ib基因PCR电泳结果
讨 论
喹诺酮类抗菌药物产生耐药的机制复杂,1998年以前人们一直认为喹诺酮类耐药是由细菌拓扑异构酶基因或/和调节外排泵表达的基因发生染色体突变所致[7-8]。近年来质粒介导PMQR机制备受关注,qnr基因和aac(6')-Ib基因cr等相继被发现。朱东安等[9]发现1株同时具有质粒介导的喹诺酮类耐药基因qnr S和CTX-M-3型超广谱β-内酰胺酶的福氏志贺菌。汪雅萍等[10]报道志贺菌若携带qnr基因可使喹诺酮类抗菌药物的敏感性降低。Robicsek等[11]报道aac(6')-Ib基因cr是氨基糖苷乙酰转移酶变异体基因,能修饰灭活氨基糖苷类和喹诺酮类2大类化学母体结构各异药物,并且能提高暴露于环丙沙星的菌株发生染色体突变的几率。研究表明,aac(6')-Ib基因cr于223位、454位发生2个碱基突变可致表达蛋白2处氨基酸位点改变,最终蛋白产物为一类氨基糖苷类乙酰转移酶,该类酶通过对含哌嗪胺为底物的喹诺酮类药物环丙沙星及诺氟沙星脱乙酰化作用致使药物敏感性降低。aac(6')-Ib基因cr在太平洋地区大肠埃希菌中检出率最高[5]。
本研究中,aac(6')-Ib基因检出17株,大肠埃希菌对喹诺酮类抗菌药物敏感菌株中未检测出aac(6')-Ib基因。对17株aac(6')-Ib基因阳性株PCR扩增产物进行测序,其中14株为 aac(6')-Ib基因cr,其余3株未发生突变。突变株与未突变株对21种抗菌药物的耐药率比较差异无统计学意义(P>0.05),可能检出菌株偏少影响统计。我们对大肠埃希菌aac(6')-Ib基因阳性与阴性菌株的耐药性进行比较可见阳性株对阿米卡星耐药率高于阴性株且差异有统计学意义(P<0.01);未见庆大霉素的差异与文献报道稍有不同[5],可能与质粒介导低水平耐药有关;但我们的研究可见在β-内酰胺酶抑制剂药物(氨苄西林-舒巴坦和哌拉西林-他唑巴坦)和头孢菌素类药物(头孢唑啉、头孢克洛和头孢呋辛)间阳性株耐药率高于阴性株且差异有统计学意义(P<0.05);特别是以易遭aac(6')-Ib变异体酶乙酰化的哌嗪胺为底物的氟喹诺酮类药物(环丙沙星和诺氟沙星)间存在阳性株耐药率高于阴性株且差异有统计学意义(P <0.05)[8];至于左氧氟沙星的差异可能与aac(6')-Ib基因cr存在会大大增加环丙沙星染色体选择突变有关[5],染色体突变的同时也引起左氧氟沙星耐药,这有待于进一步研究。
另外,我们已知aac(6')-Ib基因cr可同时导致氨基糖甙类和喹诺酮类两种药物失活,而且还能提高暴露于环丙沙星的菌株发生染色体突变的几率,由本次实验数据可见:大肠埃希菌对喹诺酮类抗菌药物耐药菌株抑菌圈皆为6mm是高水平耐药,更似染色体基因已发生突变造成的耐药,这种推测有待进一步证实。
质粒介导 aac(6')-Ib基因 cr通过参与PMQR机制仅介导低水平的喹诺酮耐药,但其给临床带来的危害严重。其一,PMQR机制易在喹诺酮药物的选择压力下选择出染色体突变株,引起更高水平的喹诺酮类耐药产生。其二,aac(6')-Ib基因cr依借质粒载体可引起多宿主间的广泛传播。其三,质粒通常具有捕捉耐药基因的特性,易造成菌株的多重耐药性。尽管aac(6')-Ib基因cr于21世纪才被关注,但在中国上海自2000年至2001年间其就已经存在于过半的多重耐药大肠埃希菌分离株中[5]。因此,广大医务工作者应重视细菌的耐药问题,合理使用抗菌药物,为及时有效预防和控制院内感染发生,减少多重耐药细菌产生出一份力。
[1]叶任高.临床肾脏病学[M].第2版.北京:人民卫生出版社,2007:339.
[2]Chenia HY,Pillay B,Pillay D.Analysis of the mechanisms of fluoroquinolone resistance in urinary tract pathogens[J].J Antimicrob Chemother,2006,58(6):1274-1278.
[3]Ruiz J.Mechanisms of resistance to quinolones:target alterations,decreased accumulation and DNA gyrase protection[J].J Antimicrob Chemother,2003,51(5):1109-1117.
[4]Sáenz Y,Ruiz J,Zarazaga M,et al.Effect of the efflux pump inhibitor Phe-Arg-beta-naphthylamide on the MIC values of the quinolones,tetracycline and chloramphenicol,in Escherichia coli isolates of different origin[J].J Antimicrob Chemother,2004,53(3):544-545.
[5]Park CH,Robicsek A,Jacoby GA,et al.Prevalence in the United States of aac(6')-Ib-cr encoding a ciprofloxacin-modifying enzyme[J]. Antimicrob Agents Chemother,2006,50(11):3953-3955.
[6]肖时超,吕火祥,沈蓓琼,等.2003年至2007年大肠埃希菌的临床分离及耐药趋势分析[J].中国微生态学杂志,2008,20(4):407-409.
[7]Robicsek A,Sahm DF,Strahilevitz J,et al.Broader distribution of plasmid-mediated quinolone resistance in the United States[J]. Antimicrob Agents Chemother,2005,49(7):3001-3003.
[8]Morgan-Linnell SK,Becnel Boyd L,Steffen D,et al.Mechanisms accounting for fluoroquinolone resistance in Escherichia coli clinical isolates[J].Antimicrob Agents Chemother,2009,53(1):235-241.
[9]朱东安,孙景勇,范惠清.一株福氏志贺菌中同时检出CTX-M-3型超广谱β-内酰胺酶和质粒介导的喹诺酮基因 qnr S[J].检验医学,2009,24(7):489-492.
[10]汪雅萍,应春妹,张灏旻,等.氟喹诺酮耐药志贺菌中质粒介导qnr基因的检测[J].检验医学,2011,26(10):645-647.
[11]Robicsek A,Strahilevitz J,Jacoby GA,,el al.Fluoroquinolone-modifying enzyme:a new adaptation of a common aminoglycoside acetyltransferase[J].Nat Med,2006,12(1):83-88.
